盐胁迫对黄果厚壳桂幼苗荧光和生理特性的影响
2021-08-17李俊贞何乐祖赵春梅覃永华黄松殿刘世男
李俊贞 ,何乐祖 ,赵春梅 ,覃永华 ,2,黄松殿 ,刘世男
(1.广西南宁树木园,广西南宁530004;2.广西壮族自治区林业勘察设计院,广西南宁530004;3.广西大学林学院,广西南宁530004)
土壤盐渍化问题制约着生态系统的稳定性,现已成为全世界面临的难题[1],严重抑制了植物的生长发育[2]。有研究表明,盐胁迫使紫穗槐(Amorpha fruticosa)、沙枣(Elaeagnusspp)、美国白蜡(Fraxinus americanaLinn)、卫矛(Euonymus alatus)和苦楝(Melia azedarch)幼苗的株高、直径、生物量受到显著抑制[1,3-4],除了表型外,其生理形态也会发生巨大变化。盐胁迫会破坏植物叶绿体结构、降低叶绿素含量、减少光合作用等一系列代谢过程[5]。在盐胁迫下,鸡爪槭(Acer palmatumThunb)、酸柚(Citrus grandis)、香樟(Cinnamomum camphora)等幼苗叶片中的叶绿素含量明显降低,同时最大光化学效率(Fv/Fm)和非光化学淬灭系数(NPQ)逐步上升[6-8]。植物组织中积累过多的Na+和Cl-,会打破细胞质内的离子平衡,对植物产生离子毒害[9],为此细胞内会形成一种酶促保护系统以保护自身免受伤害。很多研究表明,植物体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢(CAT)以及抗坏血酸过氧化物酶(APX)等在盐胁迫下会发挥作用来适应不利环境[10]。金荷仙等[11]研究发现,随着NaCl 浓度的升高,白玉兰(Michelia alba)叶片中的 SOD 和 POD 活性呈先升后降趋势;李莹莹等[12]研究发现,随着盐胁迫的加强,猴樟(Cinnamomum bodinieri)叶片中的SOD、POD、CAT 活性及MDA 含量均呈先升高后下降的趋势。这些研究说明,在一定盐浓度范围内,林木可以通过激活自身的抗氧化系统来适应。因此,通过研究植物在盐胁迫条件下的生理响应,将有助于评价该植物的耐盐能力。
黄果厚壳桂(Cryptocarya concinna) 为樟科(Lauraceae)厚壳桂属(Cryptocarya)常绿乔木,主要分布于我国的广西、广东和江西省。其材质厚重、韧性良好、耐湿,木材纹理细致交错、材色光泽亮丽,常用作家具、建筑[13-14]。此外,研究还发现,黄果厚壳桂部分天然产物对人癌细胞表现出中等细胞毒性,并具有较强的抗菌活性[15]。可见,该树种具有较高的材用和药用价值,应用前景广阔。目前,对黄果厚壳桂研究主要集中在对材性和人工林生长规律等少量报道[16],对其抗性的研究鲜有报道。该树种天然分布范围土壤类型主要是赤红壤和红壤,但近年来的调查发现,广西南部滨海地区接近滨海盐土分布区以及广西西南部岩溶山地和西北部的岩溶天坑中的石灰岩土也有分布[17]。
本研究对黄果厚壳桂在NaCl 胁迫下的荧光和生理响应进行研究,以探索其抗盐能力,为黄果厚壳桂合理种植以及扩大栽植范围提供理论依据。
1 材料和方法
1.1 试验材料
试验材料为1 年生黄果厚壳桂实生苗,来源于南宁树木园。选苗时,要求植株苗高、地径一致且无病虫害。
1.2 试验设计
试验在大棚内进行,将试验材料从盆栽移栽至1/2 Hoagland 营养液中水培,每3 d 更换一次营养液,同时使用充气泵全天通气;适应5 d 水培环境后,开始盐胁迫处理。采用随机区组设计,共设4 个NaCl 水平,分别为 0(CK)、50(低浓度)、100(中浓度)、150 mmol/L(高浓度),每个处理6 株试验材料,每个水平3 次重复。处理后10 d 对各指标进行测定。
1.3 测定指标及方法
用德国调试IMAGING-PAM 叶绿素荧光成像系统测定幼苗第3 片叶子的初始荧光(Fo)、最大荧光(Fm)、PSII 最大光化学效率(Fv/Fm)、非光化学淬灭系数(NPQ),重复 3 次。
丙二醛(MDA)含量采用硫代巴比妥酸法测定[18];超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法进行;过氧化物酶(POD)活性的测定采用愈创木酚法[19]进行;多酚氧化酶(PPO)活性的测定采用邻苯二酚法[20]进行;抗坏血酸过氧化物酶(APX)活性采用紫外分光法测定[21];叶绿素含量的测定采用乙醇提取比色法[22]进行。
1.4 数据处理及分析
采用Excel2016、SPSS22.0 进行数据的统计及制图;采用LSD法对数据进行显著性方差分析(P<0.05)。
2 结果与分析
2.1 盐胁迫对黄果厚壳桂MDA 和抗氧化酶活性的影响

由图1-A 可知,幼苗叶片中的MDA 含量随着NaCl 浓度的增加而上升,在 50、100、150 mmol/L 浓度下,MDA 含量较 CK 分别升高 10.6%、37.1%、45.0%,各胁迫浓度均与CK 间存在显著差异(P<0.05);除100 mmol/L 浓度外,其他浓度均与150 mmol/L 浓度存在显著差异(P<0.05)。NaCl 胁迫下叶片的SOD活性呈现先增后降的趋势,低浓度(50 mmol/L)时SOD 活性最高,与CK 相比提高12.8%,且差异显著(图 1-B,P<0.05);但 NaCl 浓度为 100、150 mmol/L时SOD 活性与CK 相比分别降低49.9%、53.0%,差异显著(P<0.05)。与SOD 活性变化规律相似,叶片中的POD 活性也表现出先增后降趋势;其中,50 mmol/L 处理时的POD 活性最高,较CK 显著提高 25.7%(图 1-C,P<0.05);而当 NaCl 浓度升高(100、150 mmol/L)时,SOD 活性逐渐下降,与 CK 相比分别显著提高25.1%、18.2%(P<0.05),可见,总体上处理组SOD 活性高于CK。
叶片中PPO 和APX 活性变化规律一致,都随着 NaCl 浓度的升高而降低(图 1-D、E);与 CK 相比,在 50、100、150 mmol/L 浓度时,PPO 活性分别显著降低 21.4%、24.2%、44.9%(P<0.05),而 APX 活性分别显著降低37.8%、43.3%、26.5%(P<0.05)。
2.2 盐胁迫对黄果厚壳桂色素含量的影响
与CK 相比,各胁迫处理的叶绿素a、叶绿素b、类胡萝卜素含量均降低,且随着NaCl 浓度增大呈逐渐下降趋势,均在150 mmol/L 处理达到最低值;其中,在50、100 mmol/L 浓度下叶绿素a、类胡萝卜素含量降幅较小(图2-A、C),且差异不显著(P>0.05),而150 mmol/L 胁迫时与CK 存在显著差异(P<0.05),叶绿素b 含量随NaCl 胁迫增强降幅较大,50、100 mmol/L 胁迫时叶绿素 b 含量较 CK 分别显著降低30.5%、46.1%(图 2-B,P<0.05)。

2.3 盐胁迫对黄果厚壳桂叶绿素荧光特性的影响
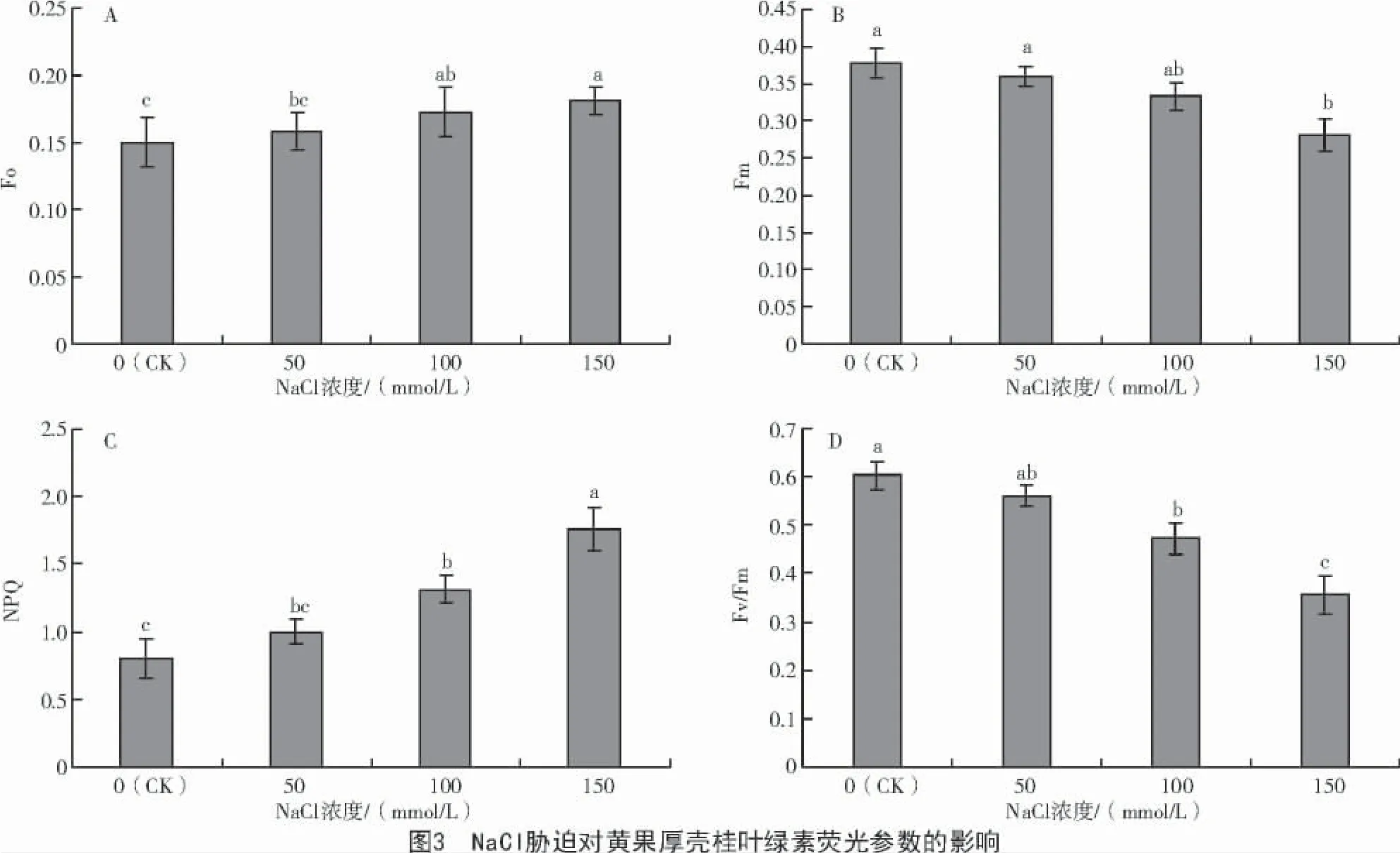
由图3-A 可知,Fo 随NaCl 浓度增加而增大,在 50、100、150 mmol/L 浓度下,幼苗的 Fo 分别比CK 提高 5.3%、15.1%、20.7%,低浓度(50 mmol/L)胁迫下 Fo 与 CK 间差异不显著,100、150 mmol/L 胁迫下均与 CK 间存在显著差异(P<0.05);与 Fo 变化规律相反,Fm 随 NaCl 浓度增加而降低,在 50、100、150 mmol/L 浓度下,幼苗的Fm 较CK 分别降低4.9%、11.9%、25.5%,其中,只有 150 mmol/L 浓度胁迫下与CK 间存在显著差异(图3-B,P<0.05);与Fo 变化规律一致,NPQ 随NaCl 浓度升高而增大,在 50、100、150 mmol/L 浓度下,幼苗 NPQ 与 CK 相比分别升高24.7%、64.4%、119.0%,且除50 mmol/L外,其他2 个胁迫浓度均与CK 间存在显著差异(图 3-C,P<0.05);与 Fm 变化规律一致,Fv/Fm 随NaCl 浓度增加而降低,在 50、100、150 mmol/L 浓度下,幼苗的Fv/Fm 与CK 相比分别降低7.1%、21.7%、41.0%,100、150 mmol/L 浓度胁迫与 CK 间存在显著差异(图 3-D,P<0.05)。
3 结论与讨论
正常环境下,植物体内活性氧(ROS)与其清除往往保持平衡状态[23]。然而,盐胁迫会打破这种平衡,使活性氧大量积累,进而引起MDA 含量增加,对植物生长造成伤害[24]。在长期进化过程中,植物形成了相应抗氧化保护系统,SOD、POD、PPO、APX是其中主要的抗氧化酶[25]。本试验发现,随着盐浓度增大黄果厚壳桂幼苗叶片中的SOD、POD 活动呈先上升后下降的趋势,这与研究白玉兰[11]和猴樟[12]得出在盐胁迫下SOD 和POD 的变化结果一致。表明在低盐胁迫下,SOD、POD 活性增高是植物体内自由基增多引发抗氧化系统反应的结果,用以清除自由基;而高盐胁迫下自由基积累到一定水平,对抗氧化系统造成一定伤害,导致SOD、POD 的活性下降。通过研究扶芳藤(Euonymus fortunei)[26]、烟草(Nicotiana tabacum)[27]、八角金盘(Fatsia japonica)[28]、石榴(Punica granatum)[29]和樟子松(Pinus sylvestrisvar.mongolica)[30]发现,高盐胁迫下,PPO 和 APX 活性显著升高,而本研究发现,黄果厚壳桂幼苗在盐胁迫下的PPO 和APX 活性显著下降,表明这2 个酶活性在盐胁迫下受到严重影响,无法平衡活性氧的毒害。结果说明,黄果厚壳桂有一定耐盐能力,可通过大幅度提升SOD 和POD 活性抵御低盐胁迫环境引起的伤害。
叶绿素作为光合作用的重要色素,当受到盐胁迫时,叶绿体分解酶活性增加,使得叶绿素含量降低[2,5]。研究发现,盐胁迫下棉花(Gossypium hirsutum)[31]、半高丛越橘[32]、八角金盘[28]、鸡爪槭(Acer palmatum)[6]等叶片中的叶绿素和类胡萝卜素含量明显降低。本试验发现,黄果厚壳桂幼苗叶片中叶绿素a/b、类胡萝卜素含量均随盐浓度的升高而降低,与对照相比,低浓度(50 mmol/L)胁迫下各色素含量差异不显著,而较高盐浓度下才达到显著差异。植物叶绿体中的PSⅡ系统受损会导致叶绿素吸收的光能以热和荧光的形式耗散的比例增大[33]。黄果厚壳桂幼苗在盐胁迫下,Fo 升高,Fm 和Fv/Fm下降,表明盐胁迫下黄果厚壳桂叶绿体中PSⅡ反应中心受损,叶片吸收的太阳能以热和荧光形式耗损的比例增加,原初光能转化率下降,这与对酸柚(Citrus grandis)[8]和台湾桤木(Alnus formosana)[34]耐盐能力研究结果类似。此外植物在盐胁迫下可以通过提高自身NPQ 来消耗过剩激发能,以保护自身光合结构来维持光合作用的稳定[35]。在盐胁迫下,黄果厚壳桂叶片中的NPQ 呈上升趋势,说明黄果厚壳桂可以通过增大自身过剩激发能的消耗量来维持光合作用,从而缓解盐胁迫带来的不利影响。
综上,黄果厚壳桂在一定浓度NaCl 胁迫下具有一定的调节能力,该树种可通过提高叶片中SOD、POD 活性和增大NPQ 来适应不利的环境。
