昆虫病原线虫与环境生物、非生物因素关系的研究进展
2021-08-13孔祥鑫金永玲李玉玲谷星慧李江舟徐成体韩日畴
王 杰,戴 康,孔祥鑫,曹 莉,屈 玲,金永玲,李玉玲,谷星慧,李江舟,徐成体*,韩日畴*
(1.青海大学畜牧兽医科学院,西宁 810016;2. 广东省科学院动物研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260;3. 黑龙江八一农垦大学,黑龙江大庆 163319;4.云南省烟草公司玉溪市公司,云南玉溪 653100)
昆虫病原斯氏线虫科Steinernematidae和异小杆线虫科Heterorhabditidae线虫以3龄感染期虫态主动搜索寄主昆虫,对非靶标生物和环境安全,可规模化生产,是具有应用潜力的天敌,已广泛用于防治农林、牧草、花卉和卫生等领域的害虫(Ehlers, 2001; Gaugleretal., 2001; Gaugleretal., 2002; Labaudeetal., 2018)。昆虫病原线虫与其体内携带的共生细菌共同作用致死寄主昆虫。它们以感染期虫态随寄主食物或从昆虫的自然开口(如肛门、气门)、节间膜进入昆虫体内,随后释放肠腔中携带的Xenorhabdus属(与斯氏线虫Steinernema共生)或Photorhabdus属(与异小杆线虫Heterorhabditis共生)共生细菌。线虫以及共生细菌分泌的毒素(毒性因子)导致昆虫死亡,然后利用寄主体内的营养物质繁殖后代。全球著名公司,如德国E-nema公司,荷兰Koppert公司,英国Becker Underwood公司,日本SDS公司等均致力于这类生物农药的研制和商业化(Hanetal., 2000; Grewaletal., 2005; Kayaetal., 2006; Peters, 2013; Shapiro-Ilanetal., 2017)。
各种复杂的环境生物和非生物因素时刻影响着昆虫病原线虫的生存和繁殖(Georgisetal., 2006)。环境生物因素包括同类线虫、共生细菌、寄主昆虫、寄生真菌以及其它昆虫病原等;环境非生物因素主要有土壤类型、温湿度、盐度、紫外线等。本文从昆虫病原线虫与环境生物和非生物因素的关系,综述这类线虫的研究进展,并展望未来的研发方向。
1 昆虫病原线虫与环境生物因素
1.1 昆虫病原线虫
1.1.1昆虫病原线虫种类
目前已从全球分离和鉴定了106种斯氏属和23种异小杆属昆虫病原线虫(表1)(Kozodoi, 1984; Gardneretal., 1994; 刘杰, 1994; Stock, 1996; Stocketal., 1996; Ganguly and Singh, 2000; Cutler and Stock, 2003; Plichtaetal., 2009; Stocketal., 2009; Khatri-Chhetrietal., 2011; Clausietal., 2011; Gorgadzeetal., 2015; Shahinaetal., 2016; Bhatetal., 2020)。我国昆虫病原线虫资源丰富,业已描述的这类线虫种类有19种。

表1 已鉴定的斯氏属和异小杆属线虫种类

续表1 Continued table 1
1.1.2昆虫病原线虫的培养和贮存
昆虫病原线虫培养方法主要有活体培养(Invivo)和离体培养(Invitro)。活体培养技术是利用敏感且容易饲养的昆虫寄主来培养昆虫病原线虫,目前主要使用的是大蜡螟Galleriamellonella幼虫(Dutkyetal., 1964; Dowdsetal., 2002; Gougeetal., 2006; Kotchofaetal., 2019)。离体培养主要包括固体培养(Bedding, 1981; Wouts, 1981)和液体培养(Ehlersetal., 1998)(图1)。固体培养是在含有海绵填充剂的培养基中加入单一共生细菌和无菌线虫构建的(Bedding, 1981; Hanetal., 1992; Hanetal., 1993; Shapiro-Ilanetal., 2014; 颜珣等, 2016);这一培养方法适应性广,设备和培养基成本低廉,但耗费人工,适用于人力成本不高的商业模式(Ehlersetal., 2000; Ehlersetal., 2005)。液体培养主要是应用发酵罐系统进行,可大批量获得昆虫病原线虫;这一培养系统设备、培养基成本和自动化程度高,适用于人力成本较高的商业模式(Ehlersetal., 2005)。
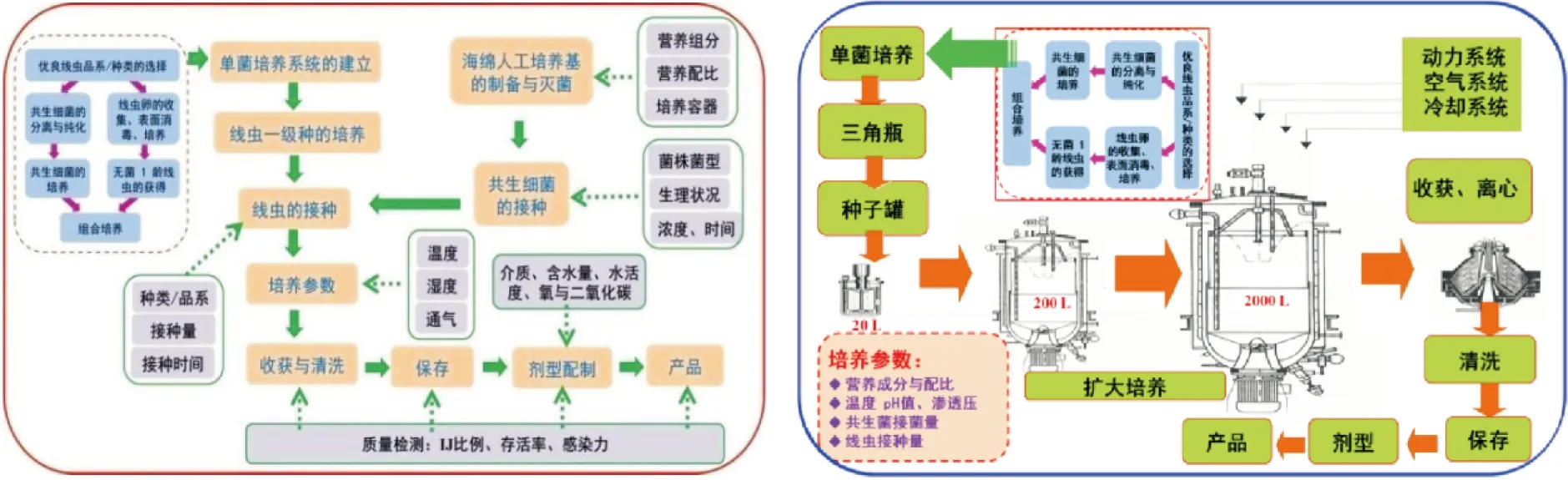
图1 昆虫病原线虫固体和液体培养系统及其参数Fig.1 Solid and liquid culture systems and their parameters for entomopathogenic nematodes
通过优化寄主昆虫的饲料配方可以提高昆虫病原线虫的活体培养产量(Shapiro-Ilanetal., 2012)。于固体和液体培养系统中测定接种线虫的贮存时间、培养基粘度、容器体积和搅拌速率对S.feltiae产量的影响,结果显示,线虫种贮存时间延长有利于增加液体培养线虫产量,液体培养基中添加0.2%琼脂、增加通气量有利于线虫恢复发育和提高产量(Leiteetal., 2017)。培养基优化对于昆虫病原线虫产量和质量至关重要,添加昆虫粉到固体培养基中显著提高感染期线虫产量和毒力(Zhenetal., 2018)。昆虫病原线虫的培养基配方中,大豆粉是最佳的蛋白质来源,在富含大豆蛋白的培养基中获得了较高的产量,此外,在液体培养基中添加0.2%琼脂并使用较高的搅拌速度提高通气速率可以提高线虫的恢复率和最终产量(Choetal., 2011; Leiteetal., 2016; Leiteetal., 2017)。Addis等(2016)发现,可通过接种后3 d时雌虫体总体积准确预测线虫液体培养的产量。液体培养是昆虫病原线虫规模化培养的最佳方法,然而产量的稳定性是该方法需要解决的主要问题(Cortés-Martínezetal., 2020)。总的来说,当市场需求量大时,离体培养方法更适宜,其中液体培养技术更具发展潜力(Cortés-Martínezetal., 2020)。Peters等(2016)和Cortés-Martínez等(2020)详细描述了液体发酵罐培养系统中,不同类型发酵罐(搅拌式、气升式),不同参数(包括培养基、温度、pH、搅拌速率、溶氧、线虫和细菌接种量等),不同昆虫病原线虫及其共生细菌生理状态对各种昆虫病原线虫产量、质量和成本的影响。
昆虫病原线虫的贮存技术也在改进之中。线虫可贮存于海藻酸钠中(Ruiz-Vegaetal., 2018),也可贮存于13%和33%的植物油(如香茅Cymbopogoncitratus,北美圆柏Juniperusvirginiana,辣薄荷Menthapiperita)中(Aquino-Bolaosetal., 2019)。海绵作为贮存载体广泛用于线虫产品的短期贮存;H.bacteriophora,S.carpocapsae和S.feltiae感染期线虫于3种海绵Polyurethane (Scotchbrite)、Melamine(Nanosponge)和Cellulose(Lysol)中贮存10°C下8个月后的存活率均大于50%,并保持对昆虫的感染力(Tourayetal., 2020)。近交、杂交和突变技术已经成功应用于筛选耐贮存的H.bacteriophora线虫品系的筛选(Sumayaetal., 2018)。
1.1.3不同种昆虫病原线虫对同一寄主的竞争感染
大部分不同种线虫可以在同一大蜡螟幼虫体内共同繁殖产生下一代,竞争能力强的线虫在寄主体内获得更高的产量(Sicardetal., 2005; PuaVetal., 2009)。研究表明,多种线虫同时侵染同一寄主与单种线虫侵染相比,侵染率无较大差别(Koppenhoferetal., 1995)。但是,S.carpocapsae和S.glaseri同时侵染蛴螬时,侵染率比单一品系的高(Matsunagaetal., 1996)。H.bacteriophoraH06与H.indicaLN2线虫共同感染同一寄主时,H.indicaLN2携带的共生细菌产生毒素可致死H.bacteriophoraH06,共生细菌中namA基因参与了LN2菌株毒素的合成(Qiuetal., 2009)。昆虫体内营养物质的争夺以及共生细菌的不相容性,介导了昆虫病原线虫的种内和种间竞争,线虫携带能够抑制其竞争对手的共生细菌时,可获得竞争优势(Basheyetal., 2013; O'Callaghanetal., 2014)。
1.1.4多种昆虫病原线虫对昆虫的协同作用
在实践中,多种昆虫病原线虫可混合使用以提高对害虫的防治效果。两种昆虫病原线虫混用后对南方玉米根虫Diabroticaundecimpunctata幼虫防效效果明显高于单一品系的线虫(Chooetal., 1996)。10种不同品系的线虫混合对蔗根象Diaprepesabbreviates防治效果显著增加(Stuartetal., 2004)。H.indica和Steinernemaasiaticum混用后对稻纵卷叶螟Cnaphalocrocismedinalis幼虫的致病速率较单一的昆虫病原线虫快(Sankaretal., 2009)。H.bacteriophoraZT与S.carpocapsaeAll品系的混合对韭菜迟眼蕈蚊Bradysiaodoriphaga幼虫防效达100%,比单独使用一种线虫时防效至少提高37%(李春杰等, 2013)。S.glaseri和H.bacteriophora混合使用对松云鳃金龟Polyphyllafullo幼虫的防治也具有协同作用(Demiretal., 2015)。因此,将不同种或品系的昆虫病原线虫混合应用是一种值得推荐的害虫防治策略。
1.1.5昆虫病原线虫的功能基因和酶
昆虫病原线虫的一些功能基因和酶业已报道。比如线虫寻找寄主行为可分为典型的“埋伏型”(如S.carpocapsae)和“巡航型”(如S.glaseri)(Ruanetal., 2018),呈现不同行为的线虫种类的转录组和小RNA分析结果表明线虫神经肽基因和小RNA的交互作用可能调控Steinernema属线虫行为的多样性(Warnocketal., 2019; Warnocketal., 2021)。转录组和RNAi分析证明,H.bacteriophora线虫的Hb-hsp90-1基因在响应升温和调控感染期恢复发育方面发挥关键作用(Fanellietal., 2021)。
H.bacteriophora的UDP葡萄糖基转移酶UDP-glycosyltransferase抑制昆虫抗菌肽基因表达和蜕皮激素信息因子响应(Kenneyetal., 2020)。大蜡螟幼虫血淋巴可诱导S.carpocapsae和S.feltiae线虫产生系列毒性蛋白(Luetal., 2017; Changetal., 2019)。线虫本身也分泌毒性因子作用于寄主昆虫,如表皮脂类、糜蛋白酶(Chymotrypsin)、丝氨酸羧肽酶(Serine carboxypeptidase)、无脊髓动物溶菌酶(Invertebrate-type lysozyme)和尿苷二磷酸葡萄糖基转移酶(Uridine diphosphate glycosyltransferase)等引起昆虫黑化、细胞反应、抗菌肽合成等(Kenneyetal., 2021)。
1.1.6昆虫病原线虫信息物质蛔甙的作用
线形动物普遍存在的蛔甙类(Ascarosides)信息物质在调节线虫的聚集、趋避、交配、多尔态Dauer形成及扩散传播等行为中发挥了重要作用(Jeongetal., 2005; Kimetal., 2009; Oliveira-Hofmanetal., 2019),昆虫病原线虫能够分泌多种蛔甙,其中ascr#9为昆虫病原线虫所有种属可产生,对线虫的生长发育和扩散具有重要作用(Kaplanetal., 2012; Hartleyetal., 2019; Oliveira-Hofmanetal., 2019)。
1.2 昆虫病原线虫与共生细菌的共生关系
线虫依赖在昆虫血淋巴中的共生细菌产生毒素致死昆虫并将昆虫体转化为适合线虫繁殖的营养物质;作为回报,线虫将共生细菌携带到新的昆虫宿主(Roderetal., 2018)。在寄主体内,线虫分泌的蛋白质对宿主血细胞具有轻微的细胞毒性,而共生细菌分泌的蛋白质显著影响昆虫寄主细胞的活力,两者协同作用致死寄主(Brivioetal., 2018)。共生细菌除了对感染期线虫的致病力产生显著影响外,对线虫干重、蛋白质、氨基酸、糖原和脂肪酸等生化物质的含量也有很大影响(丘雪红等, 2004)。
转录调节因子Lrp调控着X.nematophila菌株共生或病原性的转变,使共生细菌适应不同寄主(如与其共生的线虫或其作用的昆虫)环境(Caoetal., 2020)。业已发现了食物影响寄主与寄生物交互作用的新机制,即高蛋白食物引起斜纹夜蛾Spodopteralitura幼虫血淋巴渗透压升高,导致血淋巴中的X.nematophila共生细菌生长缓慢,从而提高昆虫存活率(Wilsonetal., 2020)。携带不同菌株的H.downesi线虫于干燥条件下的存活率差异显著(Maheretal., 2017)。有趣的是,线虫可携带分泌细菌素或未分泌细菌素的共生细菌,但线虫携带未分泌细菌素的共生细菌后更迅速致死寄主昆虫并成功繁殖,证明与线虫组合的共生细菌需要权衡是抑制同类菌株还是支持线虫繁殖(Meli and Bashey, 2018)。
1.2.1共生细菌及其作用
1.2.1.1共生细菌种类
Xenorhabdus属和Photorhabdus属细菌隶属于变形菌门Proteobacteria的γ-亚纲肠杆菌科Enterobacteriaceae,分别与斯氏线虫属Steinernema和异小杆线虫属Heterorhabditis的昆虫病原线虫互惠共生。这类共生菌是一类革兰氏阴性,不产孢,兼性厌氧型细菌,具有共生性与病原性特点(Ecksteinetal., 2019;Stocketal., 2019)。
MALDI-TOF MS数据库可用于Photorhabdus属共生细菌(Hilletal., 2020)的鉴定。最早的P.luminescens基因组2003年公布(Duchaudetal., 2003)。后来接连公布了多个共生细菌的基因组, 为这类细菌的系统分析、功能基因研究提供了支撑(Ghazaletal., 2017; Duongetal., 2019; Somvanshietal., 2019)。
目前已确定的Xenorhabdus属细菌主要有27种:X.beddingii,X.bovienii,X.budapestensis,X.cabanillasii,X.doucetiae,X.doucetiae,X.eapokensis,X.ehlersii,X.griffiniae,X.hominickii,X.indica,X.innexi,X.ishibashii,X.japonica,X.khoisanae,X.koppenhoeferi,X.kozodoii,X.magdalenensis,X.mauleonii,X.miraniensis,X.nematophila,Xenorhabduspoinarii,X.romanii,X.stockiae,X.szentirmaii,X.thuongxuanensis,X.vietnamensis(Kampferetal., 2017)。Photorhabdus属细菌包括19种:P.akhurstii,P.asymbiotica,P.australis,P.bodei,P.caribbeanensis,P.cinerea,P.hainanensis,P.heterorhabditis,P.kayaii,P.khanii,P.kleinii,P.laumondii,P.luminescens,P.namnaonensis,P.noenieputensis,P.stackebrandtii,P.tasmaniensis,P.temperata和P.thracensis;P.laumondii分为两个亚种:P.laumondiisubsp.laumondii和P.laumondiisubsp.clarkei(Machadoetal., 2018);P.khanii分为P.khaniisubsp.guanajuatensis和P.khaniisubsp.khaini;P.luminescens分为P.luminescenssubsp.luminescens和P.luminescenssubsp.mexicana。最近,Photorhabdus属细菌增加了如下亚种:P.heterorhabditissubsp.aluminescens,P.heterorhabditissubsp.heterorhabditis,P.australissubsp.thailandensis,P.australissubsp.Australis和P.aegyptia(Machadoetal., 2021)。
业已发现,Heterorhabditis线虫感染大蜡螟12 d后,发现Stenotrophomonas与Photorhabdus细菌共存于昆虫尸体中(Wollenbergetal., 2016)。从昆虫病原线虫中也分离出苍白杆菌属Ochrobactrum细菌(Aujoulatetal., 2019);以大蜡螟等昆虫的幼虫于实验室培养几种Steinernema属线虫时,除了核心细菌X.nematophila外,发现还含有变形细菌类Proteobacteria(如Pseudomonas,Stenotrophomonas,Alcaligenes,Achromobacter,Pseudochrobactrum,Ochrobactrum,Brevundimonas,Deftia等);其中有些微生物种类显示杀虫活性(Ogieretal., 2020)。这些微生物如何与共生细菌共存值得继续研究。
1.2.1.2共生细菌的形态和生理生化特征
Xenorhabdus共生细菌过氧化氢酶阴性,不能将硝酸盐还原为亚硝酸盐,目前只能从Steinernema属线虫的肠道内分离得到;Photorhabdus共生细菌过氧化氢酶呈阳性,不能降解硝酸盐(Boemare and Akhurst, 1988)。
共生细菌在体外培养时呈现型变现象,即初生型和次生型菌落和菌体(Akhurst, 1980)。初生型菌体大小长短不一,大量菌体含空泡状内含物;而次生型菌体一般粗长,比较整齐,相互分离(图2)。除了在菌落形态上存在差异外,两型菌生理生化特征也有明显区别。初生型菌可以在鉴别培养基平板上吸收染料,分泌蛋白酶和脂酶,产生胞内晶体蛋白、抑菌物质、色素和荧光素;次生型菌基本没有这些特征或仅有少数菌呈现个别特征(Akhurst and Boemare, 1990)。初生型菌为昆虫病原线虫生长和发育提供更好的营养,次生型则降低昆虫病原线虫的产量,而且仅初生型细菌能被感染期幼虫携带(Akhurst and Boemare, 1990; Han and Ehlers, 2001)。初生型P.luminescens细菌产生两种胞内晶体蛋白CipA和CipB,为线虫繁殖提供营养作用;次生型缺少晶体蛋白(Youetal., 2006)。次生型被认为更有利于脱离昆虫体自由生活、在植物根系中生长,抑制根系植物病原微生物(Ecksteinetal., 2019; Regaioloetal., 2020)。细菌两型性的调控机制仍未明晰,LysR-type调控子HexA作为抑制子调控初生型菌株,AntJ调控Photorahbdus细菌色素的合成,小RNA和分子伴侣Hfq也发挥重要作用(Langeretal., 2017; Ecksteinetal., 2019);XRE家族转录调节因子在P.luminescens菌株菌型转变中也发挥关键作用(Ecksteinetal., 2021)。

图2 昆虫病原细菌的初生型与次生型(Boemare et al., 1996)Fig.2 Primary and secondary forms of entomopathogenic bacteria注:携带共生细菌的菌囊(箭头所指部位);初生型细菌;次生型细菌。Note: The sac containg symbiotic bacteria (point of arrow); Primary form; Secondary form.
1.2.1.3共生细菌对昆虫和植物病原的控制作用
从昆虫病原线虫分离的共生细菌培养液对昆虫和植物病原具有控制作用(表2),同时可以增强其它病原真菌感染昆虫的毒力(Böszörményietal., 2009; Sajjadianetal., 2020;Wuetal., 2020)。从共生细菌X.budapestensis分离出的Fabclavines物质(Wenskietal., 2020)对蚊子产生取食趋避作用(Kajlaetal., 2019)。
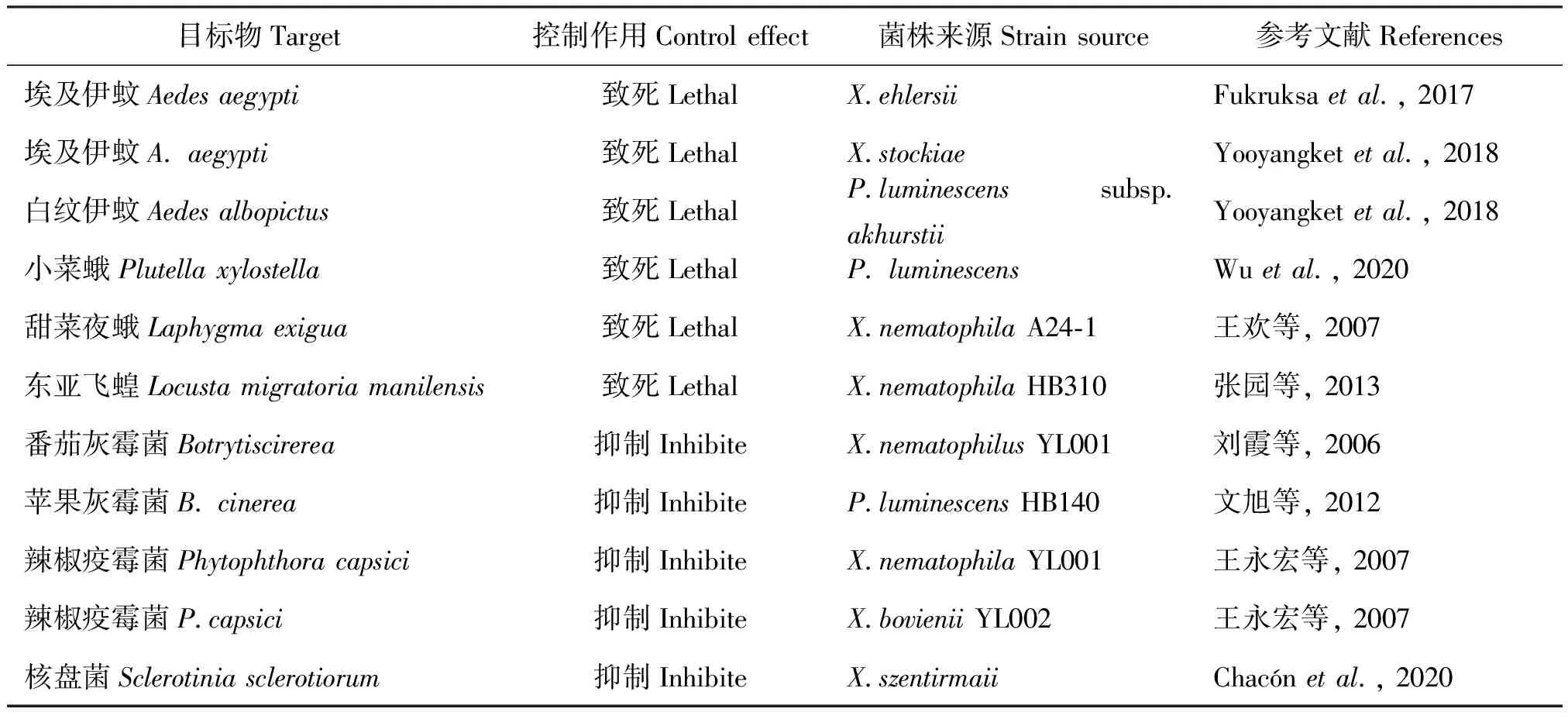
表2 共生细菌对昆虫和植物病原的控制作用
1.2.1.4共生细菌代谢物的抑菌活性
共生细菌产生许多应用价值高的代谢产物(Tobiasetal., 2017; Dreyeretal., 2018; Neubacheretal., 2020),具有很强的抗菌作用(Muangpatetal., 2020),是一类丰富的生防代谢物资源(肖尧等, 2011; Chacón-Orozcoetal., 2020),并可保护被线虫寄生的昆虫尸体免受竞争微生物的伤害(Bertolonietal., 2018; Donmezetal., 2019; Tobiasetal., 2019)。共生细菌代谢物由于不同菌种或菌株代谢物活性成分有较大差异,因而其抑菌类型和抑菌效果存在着极大差异性(方香玲等, 2008; Liuetal., 2019; Mollahetal., 2020)。
多种抗菌代谢物业已从Xenorhabdus和Photorhabdus细菌中获得,有利于研发新型抗生素(Shietal., 2018; Muangpatetal., 2020)。从两属共生细菌中分离的抗菌活性物质包括:Xenocoumacin 1和Xenocoumacin 2(Guoetal., 2017),Odilorhabdins(Sarciauxetal., 2018; Panteletal., 2018),几丁质酶(Liuetal., 2019),Xenematide G(Xietal., 2019),PAX1肽与异香豆素(Dreyeretal., 2019),Nematophin(Zhangetal., 2019),环肽Photoditritide(Zhaoetal., 2019),Darobactin(Imaietal., 2019),以及3种新型抗菌物质Khoicin、Xenopep和Rhabdin(Booysenetal., 2021)。共生细菌将吩嗪Phenazine转化为广泛应用的抗生素,可能有助于细菌-线虫复合体维持其特殊的环境生态位(Shietal., 2019)。3,5-二羟基-4-异丙基-反式-二苯乙烯Isopropylstilbene是Photorhabdus属产生的次生代谢产物,是一种具有抗菌、抗真菌、免疫调节和抗癌活性的多效化合物,在与线虫共生中发挥着重要作用(Hapeshietal., 2019)。X.nematophila在被感染的斑翅果蝇Drosophilasuzukii幼虫血淋巴中激活了抗菌肽的合成(Garrigaetal., 2020)。Booysen等(2021)详细列出了Xenorhabdus细菌产生的各类抗细菌、真菌物质,合成这些抗菌物质的基因簇以及提高抗菌物质产量的培养条件。
共生细菌分泌抗菌物质的调控机制仍在研究中。调控子Lrp、LeuO和HexA被认为控制共生细菌次生代谢(Engeletal., 2017);cpxR基因影响X.nematophila抗菌物质合成(Guoetal., 2019);X.bovienii细菌利用Type Six Secretion Systems(T6SSs)产生抗菌活性物质,抑制Xenorhabdus属其它菌株(Kochanowskyetal., 2020)。
1.2.1.5共生细菌的杀虫活性
共生细菌可产生多种对不同种类昆虫、植物线虫和原生动物具有毒性的杀虫蛋白(Bowenetal., 2000; Panetal., 2002; Tobiasetal., 2018; Muangpatetal., 2020),如PhotorhabdusInsect Related Protein (Pir)(Waterfieldetal., 2005),Makes Caterpillars Floppy(Mcf)(Dabornetal., 2002),PhotorhabdusVirulence Cassettes(Pvc)(Yangetal., 2006),PhotorhabdusInsecticidal Toxin(Pit)(Lietal., 2009),Photox(Visschedyketal., 2012),PaxAB(Zhangetal., 2014),几丁质酶(Mahmoodetal., 2020)和Galtox(Ahujaetal., 2021)。
Tc毒素首次从P.luminescensW14菌株中分离出来,随后在X.nematophila中也发现了类似的毒素(Bowenetal., 1998; Sergeantetal., 2003);Tc毒素由3个亚基TcA、TcB和TcC组成,TcA促进受体-毒素相互作用,TcB和TcC把毒素紧紧包裹住(Gatsogiannisetal., 2018; Rodereretal., 2020)。这类细菌产生的胞内和胞外蛋白对棉铃虫Helicoverpaarmigera初孵幼虫显示出不同程度的生长抑制活性(杨保军等, 2007)。来自X.nematophila的xaxAB基因编码的Alpha-xenorhabdolysin(Xax)毒素,能够触发昆虫和哺乳动物细胞的凋亡(Vigneuxetal., 2007)。Rhabdopeptides是来自共生细菌的一大类非核糖体肽,可对抗携带热带疾病病原体的原生动物(Wescheetal., 2018),并具有致死南方根结线虫Meloidogyneincognita作用(Bietal., 2018)。从X.innexiDSM 16336中分离的7个Rhabdopeptide/xenortide肽对布氏罗得西亚锥虫Trypanosomabrucei和恶性疟原虫Plasmodiumfalciparum均有较强的抑制作用(Zhaoetal., 2018);Photorhabdus细菌分泌多肽抑制亚马逊利什曼原虫Leishmaniaamazonensis,为新药物研发开辟途径(Antonelloetal., 2018)。Antonello等(2019)和Eroglu等(2019)也分别从共生细菌中分离抗锥虫Trypanosoma和二斑叶螨Tetranychusurticae的活性化合物。来自发光杆菌的毒素(TcaB、Txp40、PaTox、PirAB、PTC)具有口服或注射活性,注射这些毒素可提高昆虫血淋巴中酚氧化酶活性,从而触发广泛的免疫反应,导致幼虫死亡(Mathuretal., 2019; Bogdanovicetal., 2019; Shankhuetal., 2020; Nan Gongetal., 2020)。从一株发光杆菌发现的杀虫基因Txp40具有替代全球农业中广泛应用的苏云金芽孢杆菌Bacillusthuringiensis昆虫毒素的巨大潜力(Mathuretal., 2018; Shankhuetal., 2020)。Xenorhabdus细菌的毒素(Xax、srfABC、PirAB、Tp40、hipBA)具有强烈的注射杀虫活性(杨君等, 2008; Yangetal., 2019; 郭笑笑等, 2019; Yadavetal., 2020)。X.stockiae菌株产生的SrfABC毒素对棉铃虫幼虫具有注射杀虫活性,被认为在宿主定殖中也起着重要作用(Yangetal., 2019)。X.nematophila产生的几丁质酶对棉铃虫幼虫具有口服毒性(Mahmoodetal., 2020)。更有趣的是,X.doucetiae细菌产生的脂肽可抑制寄主昆虫的抗菌肽,避免昆虫对共生细菌的攻击(Voetal., 2021)。Shi等(2018)详细总结了共生细菌产生的重要化合物,包括抗菌活性物质。
昆虫口服毒素的杀虫机理仍未明了。TcdA作用于玉米根叶甲Diabroticavirgiferea的中肠的上皮细胞(Bowlingetal., 2017)。在大蜡螟幼虫中,口服Tc杀虫蛋白被证明与中肠的受体如Cadheri、Aminopeptidase、Alkaline phosphatase和ATP-binding cassette subfamily C结合发挥作用,并可穿越中肠到血淋巴引起酚氧化酶反应(Santhoshkumaretal., 2021)。通过酵母双杂交系统,已从大蜡螟幼虫获得参与X.nematophilaPirAB交互作用的Arylphorin蛋白(NanGongetal., 2020)。
以无病原性或低剂量病原微生物感染昆虫可导致其免疫致敏Immune priming,并对后续的病原感染产生一定程度的保护作用,如P.luminescensTT01的热灭活菌体(Wuetal., 2014)或脂多糖(Wuetal., 2015)诱导大蜡螟幼虫免疫致敏;但微球菌Micrococcusluteus致敏的黑腹果蝇Drosophilamelanogaster对Photorhabdus细菌无抵抗作用(Patrnogicetal., 2018),PirA2B2蛋白免疫致敏的大蜡螟幼虫也未明显抵抗P.luminescensTT01感染(Wuetal., 2015)。
从细菌与昆虫的免疫作用研究发现,X.hominickii通过抑制斜纹夜蛾类二十烷酸(Eicosanoid)合成来阻止昆虫的免疫响应(Mollahetal., 2021)。共生细菌的烯基乙酰胺(Phenylethylamides)可抑制介导昆虫免疫响应的血清素(Serotonin)受体(Hasanetal., 2019)。黑腹果蝇Drosophilamelanogaster-Xenorhabdus细菌模型已用于研究昆虫与共生细菌的交互作用(Ozakmanetal., 2020)。
共生细菌毒素广泛应用于小菜蛾Plutellaxylostella、甜菜夜蛾Spodopteraexigua(王欢等, 2007)、双条弗粉Ferrisiavirgata(Hemalathaetal., 2018)、草地贪夜蛾Spodopterafrugiperda(Nuez-Valdezetal., 2019)、埃及伊蚊Aedesaegypti和白纹伊蚊Aedesalbopictus(da Silvaetal., 2020),玉米小斑病菌Bipolarismaydis(王欢等, 2009)、串珠镰刀菌Fusariummoniliforme(崔安妮等, 2015)等害虫或植物病害的控制。
1.2.1.6已应用的共生细菌基因和蛋白
共生细菌基因组编码的其它关键基因也得到关注并逐步走向应用。rpoB基因作为标示物已用于评估线虫微生物群(Ogieretal., 2019)。在Photorhabdus基因组中发现了编码溶菌多糖单氧酶的单个基因,参与降解多糖(如纤维素或几丁质)(Courtadeetal., 2019; Munzoneetal., 2020)。X.nematophila产生两种不同类型的细胞内晶体包涵体,一种由富含蛋氨酸的PixA蛋白组成,另一种由PixB蛋白组成;尽管PixB在Grace的培养基中高度表达,但PixB结晶内含物却不存在,这表明PixB的产生可能在转录后受到控制(Goetschetal., 2006; Lucasetal., 2018)。Heterorhabditischongmingensis中的lin-41基因参与调控该线虫的产卵量并参与调控goa-1的表达,在繁殖过程中起重要调控作用(李朋娅等, 2019)。在转基因酿酒酵母Saccharomycescerevisiae中,来自P.luminescens的苯丙氨酸解氨酶被证明优于植物来源的苯丙氨酸解氨酶用于生产肉桂酸(Gottardietal., 2017)。P.luminescens的luxCDABE基因也已整合用于构建生物传感器(Dinetal., 2019; Bargeretal., 2021)。Tapinarof是由Photorhabdus属细菌产生的二苯乙烯类药物,已商业化用于治疗牛皮癣和异味性皮炎(Parketal., 2020)。利用P.luminescens的antABCDEFGHI基因簇于大肠杆菌Escherichiacoli表达系统可获得蒽醌(Zhouetal., 2019),以及以Type II polyketide synthases合成蒽醌(Bräueretal., 2020)。Glidobactin A和Cepafungin I被认为是极具商业价值的抗癌药物(Zhaoetal., 2020)。异源表达系统业已优化用于生产从Photorhabdus属细菌中分离的肽类抗菌素Darobactin A(Wuisanetal., 2021)。整合Photorhabdus属细菌Type II polyketide synthase基因的大肠杆菌可大量生产胭脂红酸(Yangetal., 2021)。
细菌的杀虫基因也用于构建杀虫转基因菌株和植物。转TcdA基因的拟南芥Arabidopsisthaliana对烟草天蛾Manducasexta和黄瓜点叶甲Diabroticaundecimpunctata幼虫具有毒性(Liuetal., 2003)。tcdA1B1为昆虫病原细菌-发光杆菌P.luminescens的杀虫毒素基因,转杀虫基因TcdA1和tcdB1的阴沟肠杆菌Enterobactercloacae对台湾乳白蚁Coptotermesformosanus(Zhaoetal., 2008)和3种重要农业害虫斜纹夜蛾、甜菜夜蛾、黄曲条跳甲Phyllotretastriolata具有较高的杀虫活性(张鹏波等, 2010)。转共生细菌XnGroEL蛋白的番茄可致死棉铃虫幼虫,并耐受高温和高盐(Kumarietal., 2015)。大肠杆菌表达P.temperataMeg1基因簇pttABC可获得一种新的环脂肽Phototemtide A,对恶性疟原虫具有弱抗原生动物活性(Zhaoetal., 2019)。利用基因突变并耐受苯并噁嗪的Photorhabdus共生细菌与H.bacteriophora线虫组合防治以苯并噁嗪抵抗线虫的玉米根叶甲,获得良好的控制效果(Machadoetal., 2020)。此外,不依赖底盘细胞的重组酶介导的基因组工程(Chassis-independent recombinase-assisted genome engineering, CRAGE)结合CRISPR-Cas9技术已应用于将共生细菌复杂生物合成基因簇高精度、高效率整合到细菌的染色体中,获得高效表达目的基因簇的宿主菌(Liuetal., 2020)。
1.2.2昆虫病原线虫与共生细菌的专化性
1.2.2.1昆虫病原线虫携带共生细菌的位点
Xenorhabdus在Steinernema属昆虫病原线虫中的定殖位点是肠道前端的一个结构:菌囊(Martensetal., 2003; Martens and Goodrich-Blair, 2005)。共生细菌的存在会影响菌囊的大小及形状;X.nematophila只定殖于线虫菌囊内靠近肠道的远端部分,阻断了菌囊与肠道的连通(Snyderetal., 2007)。Photorhabdus属细菌特异性附着于线虫寄主肠道的前端细胞,然后以不同程度延伸至肠道其它部分(Cicheetal., 2003)。Photorhabdus定殖线虫肠道可分3个阶段:母体直肠腺的定殖、感染期线虫肠道的定殖、感染期线虫定殖位点的繁殖(Cicheetal., 2008; 王立婷等, 2013);在一些异小杆线虫感染期幼虫肠道内,定殖的Photorhabdus细菌似乎被一层非细胞结构的基质或者膜保护着,防止它们被寄主消化(Cicheetal., 2008)。
1.2.2.2共生细菌的信息专化性
当感染期线虫感染合适的昆虫宿主时或在线虫体外培养系统中加入合适的共生细菌,感染期线虫将开始进入取食状态,并恢复生长发育,此过程称为发育恢复(Development recovery)(Strauchetal., 1998; Moshayovetal., 2013)。
昆虫血淋巴中含有的信号物质具有诱导感染期线虫恢复的作用(Strauchetal., 1998; Cicheetal., 2003)。在人工培养基中培养的共生细菌也能产生此类信息物质诱导感染期幼虫恢复(Strauchetal.,1998)。Photorhabdus属中的一些共生菌菌株可跨越种属间的鸿沟诱导S.carpocapsae线虫发育,但是Xenorhabdus属细菌产生的信号物质无法诱导异小杆线虫发育(Hanetal., 1998)。这种诱导感染期线虫恢复的信号物质被命名为食物信号(Food signal)(Strauchetal., 1998; Hiraoetal., 2009)。一种共生菌不能使所有非特异共生的感染期线虫恢复,这表明不同种类的共生细菌所产生的食物信号不同(Hanetal., 1999)。异丙基二苯乙烯Isopropylstilbene被认为是从Photorhabdus细菌中诱导感染期线虫发育的信号物质(Shietal., 2018; Hapeshietal., 2019)。
1.2.2.3共生细菌的营养专化性
共生细菌能分泌一系列胞外水解酶将昆虫组织或培养基组分转化为支持线虫的生长、繁殖的营养物质。异小杆线虫的生长繁殖对其共生细菌具有严格种属特异性;而斯氏属线虫在多数Xenorhabdus属共生菌中都可以得到理想的繁殖率(Akhurst, 1983; Sicardetal., 2003; Mitanietal., 2004)。斯氏属线虫无论是在活体条件下(Hanetal., 1999)还是在高营养的人工培养基中(Ehlersetal., 1990;Friedman 1990; Lunauetal., 1993)均能无菌繁殖;然而,异小杆属线虫必须在共生细菌P.luminescens或其代谢产物存在条件下才能繁殖,与斯氏属线虫相比,异小杆属线虫生长对共生细菌的特异性需求更严格(Akhurstetal., 1990; Ehlersetal., 1990; Hanetal., 1990; Aguilleraetal., 1993; Hanetal., 2000)。
1.2.2.4共生细菌的定殖专化性
共生细菌重新定殖于感染期线虫肠道的阶段是昆虫病原线虫-共生细菌关系建立的的关键时期之一,也是线虫-共生细菌系统生活史周而复始的前提(Cicheetal., 2003)。这种关系具有特异性,从自然界分离的异小杆和斯氏线虫属种类都携带特定的共生菌菌株,将线虫培养于非特异的共生菌中可获得肠道未携菌的感染期线虫(Hanetal., 1998; Cicheetal., 2003; Sicardetal., 2004)。
X.nematophila需要nilA、nilB、nilC(Cowlesetal., 2008)和NilDRNA基因参与(Veesenmeyeretal., 2014)才能在S.carpocapsae中完成定殖。已发现,两种共生细菌(P.cinerea和P.temperata)与H.downesi共生,P.cinerea在生长率、抗菌活性、感染期线虫定殖率方面优于P.temperate(Maheretal., 2021)。Photorhabdus和Xenorhabdus细菌均依赖RNA分子伴侣Hfq的小分子RNA-ArcZ调控其关键代谢物质的合成(Neubacheretal., 2020)。
1.2.2.5共生细菌的杀线虫专化性
当昆虫病原线与非特异性共生的共生细菌共同培养时,一些共生细菌菌株产生的毒素对非特异性线虫有致死作用(Hanetal., 2001)。H.bacteriophoraH06线虫与H.indicaLN2线虫的共生细菌组合培养时,LN2线虫携带的共生细菌产生毒素致死H06线虫,namA基因参与了LN2菌株毒素的合成(Qiuetal., 2009)。Steinernemaaffine利用X.bovienii共生细菌通过一种新的机制直接影响其竞争对手,从而影响S.affine和Steinernemafiadiae之间的竞争,且S.affine占据相应的优势(Murfinetal., 2019)。X.szentirmaii依赖ngrA基因产生的抗菌化合物抑制烟草天蛾肠道微生物和X.nematophila,但未影响其本身的生长,且有利于种间竞争(Ciezkietal., 2019)。
1.3 昆虫病原线虫与寄主的关系
1.3.1昆虫病原线虫防治害虫或蜱类
昆虫病原线虫与寄主昆虫之间的关系主要包括寄生作用,昆虫对线虫的免疫作用以及利用活体昆虫(大蜡螟)诱集昆虫病原线虫(Réginaetal., 2019)。利用昆虫病原线虫防治的主要害虫包括桃小食心虫Carposinanipponensis(杨平等, 2000)、小地老虎Agrotisipsilon(Yanetal., 2014)、华北大黑鳃金龟Holotrichiaoblita(Guoetal., 2017)、棉铃虫(Bhatetal., 2019)、斑翅果蝇(Shaweretal., 2018)、加勒比海果蝇Anastrephasuspensa(Heveetal., 2018)、象鼻虫Curculiocaryae(Shapiro-lanetal., 2017)、水椰八角铁甲Octodontanipae(Sandaetal., 2018)、玉米根叶甲(Geisertetal., 2018)、草地贪夜蛾(唐璞等, 2019)、黄曲条跳甲(Yanetal., 2013)、韭菜迟眼蕈蚊(Maetal., 2013)(Labaudeetal., 2018)(表3)。昆虫病原线虫还与杀螨剂或精油混用用于控制微小牛蜱Rhipicephalusmicroplus(Monteiroetal., 2021)。

表3 利用昆虫病原线虫控制的主要害虫
1.3.2昆虫病原线虫与化学药剂混用防治害虫
在害虫防治实践中,为了扩大防治谱或提高防治效果,昆虫病原线虫可与兼容的化学药剂混用(表4)。

表4 昆虫病原线虫与化学药剂混用防治害虫实例
1.3.3昆虫病原线虫与寄主昆虫的交互作用
昆虫病原线虫依赖气味回避被感染的寄主(Baiocchietal., 2017)。线虫进入新寄主后,独立分泌活性物质抑制昆虫的免疫反应,昆虫的防御体系同时对线虫产生响应(李慧萍和韩日畴, 2007; Kenneyetal., 2019)。寄主昆虫的免疫体系主要包括细胞免疫和体液免疫,感染期线虫进入寄主昆虫体内后被寄主昆虫的细胞吞噬或在细胞外被包裹(Lewisetal., 2005)。不同种类的线虫使用不同策略抑制昆虫免疫响应(Brivioetal., 2018)。线虫或共生细菌在感染昆虫的早期阶段可以阻止昆虫花生四烯酸的生物合成,从而阻止宿主昆虫的急性免疫反应(Kimetal., 2018; Chandraetal., 2019)。H.bacteriophora线虫分泌物通过抑制Imd通路促进共生细菌的作用(Kenneyetal., 2019)。昆虫也通过分泌一系列的化学物质来抵抗昆虫病原线虫所携带的共生细菌,大蜡螟体内的多功能肽(Sericotropin)可抵抗共生细菌(Shaiketal., 2020)。
昆虫病原线虫和共生细菌诱导昆虫寄主产生不同的免疫反应,例如,X.nematophila主要诱导参与抗菌反应的基因,而S.carpocapsae则诱导凝集素和涉及黑色素相关基因表达(Cooperetal., 2019; Huotetal., 2020)。业已发现,TGF-β信号介导黑腹果蝇对线虫的代谢响应(Ozakmanetal., 2020);黑腹果蝇的酚氧化酶系统参与抵抗线虫感染的免疫响应(Cooperetal., 2019)。暗黑鳃金龟Holotrichiaparallela的免疫相关基因PGRP-SC1,PPAE-I和GST参与抵抗H.beicherriana线虫感染(Lietal., 2021)。
红棕象甲Rhynchophorusferrugineus利用分泌的化学信号而不是发出的声音吸引S.carpocapsae线虫(Santhietal., 2021)。被线虫感染的玉米根叶甲虫尸的挥发性物质对玉米根叶甲幼虫具有吸引作用,这一行为有利于线虫找到更多的寄主并成功繁殖(Zhangetal., 2019; Santhietal., 2021)。昆虫食物竟可影响其免疫响应,蛋白质的供给量可作为免疫响应的关联指示物(Cotteretal., 2019)。
昆虫肠道微生物可能参与昆虫对昆虫病原线虫的抵抗。研究发现,被线虫感染和未被感染的欧洲鳃金龟Melolonthamelolontha幼虫的中肠微生物群显著不同,共生细菌可定殖肠道,但肠道微生物对共生细菌产生拮抗作用(Skowroneketal., 2020; Sajnagaetal., 2021)。
1.4 昆虫病原线虫与寄生、腐生真菌的关系
昆虫病原线虫在土壤中的天敌主要是捕获线虫的真菌。同时施用昆虫病原线虫和昆虫病原真菌可能会导致更高的昆虫死亡率,而与食线虫真菌结合使用会降低昆虫病原线虫和昆虫病原真菌活性(Jaffeeetal, 2005; El-Boraietal., 2007; Andalóetal., 2008; Buenoetal., 2018)。尽管早期研究表明异小杆线虫对食线虫真菌的抵抗力更高(Timperetal., 1989),但昆虫病原线虫对食线虫真菌的敏感性取决于物种和环境(El-Boraietal., 2009; El-Boraietal., 2011)。有趣的发现,腐生镰刀菌Fusariumsolani可吸引S.diaprepesi线虫并促进其对昆虫的感染效果(Wuetal., 2018)
1.5 昆虫病原线虫与植物病原线虫的关系
昆虫病原线虫以及共生细菌对重要的植物线虫,尤其是对南方根结线虫卵、2龄幼虫具有强烈的抑制作用(Perezetal., 2002; Molinaetal., 2007; Ferreiraetal., 2011; 宋洁等, 2014; Kepenekcietal., 2016; Bietal., 2018; 王鑫鹏, 2018)。于盆栽番茄中S.feltiae和S.riobrave线虫对南方根结线虫具有抑制作用(Perezetal., 2002);昆虫病原线虫的共生细菌P.luminescenssubsp.sonorensis菌株培养液抽提物(40 μg/mL)对根结线虫具有强烈的拮抗作用(Orozcoetal., 2016);Bi等(2018)报道线虫共生细菌X.budapestensisSN84中分离的多种多肽Rhabdopeptides可抑制根结线虫。共生细菌悬液能显著影响南方根结线虫卵的孵化,6 d时Hb-NJ共生菌10倍稀释液对M.incognita卵孵化的抑制作用最强,相对抑制率为70.6%(王鑫鹏, 2018)。
1.6 昆虫病原线虫与其它昆虫病原的关系
除昆虫病原线虫以外,其它昆虫病原如苏云金芽胞杆菌Bacillusthuringiensis(Hattingetal., 2019)、环抱白僵菌Beauveriabassiana(张伟等, 2017)、绿僵菌Metarhiziumanisopliae(黄亚川等, 2020)等昆虫病原广泛应用于害虫的防治。这些病原与昆虫病原线虫的关系对害虫控制也至关重要。
1.6.1苏云金芽胞杆菌
苏云金芽胞杆菌具有杀虫特异性、对人畜无害、对环境无污染,是成功应用的微生物杀虫(Bravoetal., 2011; Jouzanietal., 2017)。昆虫病原线虫所携带的共生细菌能够合成和分泌类花生酸生物合成抑制剂,该抑制剂可增强苏云金芽胞杆菌对不同目标昆虫的致病性(Sajjadianetal., 2020)。P.luminescensTT01菌株通过与苏云金芽孢杆菌Vip3Aa16毒素混用可以有效控制黄地老虎Agrotissegetum(Jalloulietal., 2018)。线虫与苏云金芽胞杆菌联用对黏虫的防控具有协同作用,主要因素是Bt菌株产生的毒素对黏虫产生破坏作用从而有利于线虫的侵染(李而涛等, 2019)。B.thuringiensis和S.carpocapsae线虫混用防治斑翅果蝇也获得增效作用(Mastoreetal., 2021)。
1.6.2病原真菌类
昆虫病原真菌与昆虫病原线虫的混用有助于提高害虫的死亡率(Wakiletal., 2017; Usmanetal., 2020)。S.carpocapsae线虫和布氏白僵菌B.brongniarti联合使用可显著提高对东方异丽金龟Exomalaorientalis的死亡率(Chooetal., 2002)。H.bacteriophora与绿僵菌联合使用对黄褐犀金龟Cyclocephalalurida也有较好的防治效果(Ansarietal., 2004; Anbesseetal., 2008)。S.glaseri与Metarhiziumanisopliae的结合对致死蛴螬3龄幼虫或黑藤象鼻虫Otiorhynchussulcatus3龄幼虫产生增效作用(Ansarietal., 2004; Ansarietal., 2010)。茄腐镰刀菌Fusariumsolani与昆虫病原线虫联合使用也对害虫产生增效作用(Wuetal., 2018)。但是,Usman等(2020)报道,Metarhiziumbrunneum的挥发性化合物影响线虫对多种昆虫的防治效果。
2 昆虫病原线虫与环境非生物因素的关系
昆虫病原线虫的应用受到土壤结构、质地、湿度、温度、田间施用剂量以及施用方法等因素的影响(Puzaetal., 2005; 武海斌等, 2015)。环境因素会影响昆虫病原线虫的生存、繁殖以及它们对目标昆虫的感染(Labaudeetal., 2018)。在应用昆虫病原线虫防治害虫时,利用各种技术手段降低环境因素对线虫的影响有助于实现这类杀虫剂的最佳应用。
2.1 温度
温度是影响昆虫病原线虫的主要因素之一。线虫生存和对寄主侵染所需的最适温度不完全一致。筛选抗高温或者耐寒的昆虫病原线虫品系有利于在高温或者寒冷地区对害虫进行有效防控。
S.carpocapsae在25℃和31℃时,对番茄潜叶蛾Tutaabsoluta的致死率达到89% ~ 91%,但在19℃时致死率仅为76%(Kamalietal., 2018)。在15℃和20℃之间,S.feltiaeSN比H.indicaLN2对韭菜迟眼蕈蚊更有效,这表明两种昆虫病原线虫的最佳侵染温度有差异(Yanetal., 2019)。
S.feltiae是一种中等耐寒的线虫,甘油和海藻糖这些低分子量化合物可作为该物种的冷冻保护剂,并在其耐寒中起重要作用(Alietal., 2014; Alietal., 2015; Alietal. 2016)。线虫在冷冻至-13℃后仍然存活,对昆虫寄主仍然具有致病性(Alietal., 2013)。H.bacteriophora-HBN经过不同的预处理后,于-4℃冷冻5 d后的存活率为86.1% ~ 95.2%,显著高于直接冷冻的存活率17.7%,而H.bacteriphora-NJ经不同温度的预处理后,于-4℃冷冻5 d时的存活率为83%,显著高于其它预处理,这表明适当的预处理可提高两个品系线虫的冷冻存活率(李春杰等, 2015)。研究发现,虫尸剂中的线虫对环境温度的耐受力高于线虫液体剂型(Gulzaretal., 2020)。
2.2 湿度
昆虫病原线虫喜潮湿的环境,因此干燥也是影响昆虫病原线虫生存和防治害虫效果的关键因素之一。筛选耐干燥昆虫病原线虫品系有助于在干旱和半干旱地区对害虫进行有效防治。不同种类线虫的抗干燥能力呈现很大差异,从而影响线虫存活,降低存活线虫对害虫的侵染率。施用昆虫病原线虫不能有效控制玉米根叶甲,原因是线虫在温暖干燥的土壤中迅速死亡(Guyeretal., 2018)。在25℃、相对湿度为50.5%的环境中处理9 h后,Steinerenema线虫仍具有较高的存活率,而Heterorhabditis线虫几乎全部死亡(邢玉芳等, 2009)。随着湿度的增加,H.bacteriophoraHB8线虫侵染活性增加,该品系线虫侵染的最佳土壤含水量为15%,二点委夜蛾Athetislepigone5龄幼虫对H.bacteriophoraHB8线虫最敏感(雷利平, 2013)。在土壤含水量为20%时,S.glaseri对黄地老虎A.segetum幼虫的防治效果最好(张安邦, 2015)。 在干燥条件下,携带共生菌P.temperatasubsp.cinerea的H.downesi比携带共生菌P.temperatasubsp.temperata的H.downesi于大蜡螟幼虫中能产生更多的线虫子代(Maheretal., 2017)。不同线虫防治不同害虫时需要根据土壤含水量不同,采用添加抗干燥剂或者抗蒸发剂可以提高昆虫病原线虫防治害虫的效果(金永玲等, 2009; 金永玲等, 2013)。但最根本的方法还是筛选耐干燥能力强的昆虫病原线虫品系进行害虫防治(Shapiro-Ilanetal., 2014)。
2.3 土壤质地
昆虫病原线虫的分布与土壤类型关系密切。沙壤土和壤土中线虫检出率较粘土的检出率高,说明沙壤土和壤土适于昆虫病原线虫种群的建立(钱秀娟等, 2014)。调查表明,未耕地以及以果树、蔬菜和大田作物为植被的、沙土、沙壤土、壤土以及粘土均有线虫的存在,其中以粘土和未耕地的检出率为最高,分别为8.57%、6.59%(陈书龙等, 2006)。以滤纸和沙子为介质对东北大黑鳃金龟Holotrichiaoblita幼虫进行致病力测定,当沙子为介质时的校正寄生死亡率达95.83%(钱秀娟等, 2005)。H.bacteriophora线虫以蛭石为培养介质,线虫产量明显高于珍珠岩(李春杰等, 2008)。S.feltiae线虫在粘土和沙质壤土中移动(水平、垂直)速率要比在壤土中更快(Lankinetal., 2020)。S.glaseriNC34在土壤中的扩散速度随土壤含水量的增大而加快(王庆雷等, 1995)。S.carpocapsae和H.bacteriophora在壤土(89%)和可可泥炭(93%)的介质中对番茄潜麦蛾Tutaliyabsoluta致死率高于沙壤土(17%)中(Kamalietal., 2018)。土壤含水量为10%、环境温度为25℃、不暴露于紫外线下的沙质土壤是线虫对地中海实蝇3龄幼虫侵染的最适环境条件(Shaurubetal., 2015)。不同含水量的介质对H.bacteriophora-HBN冷冻存活率产生显著影响,其中含水量为50%蛭石中线虫回收率最高(87.4%)(李春杰等, 2014)。
2.4 渗透压
渗透压脱水是将线虫加入高渗透压溶波中,靠溶液的渗透压力将线虫体内的水分吸出(Glazer and Salame, 2000)。通过将离子溶液(增强型人造海水)和非离子溶液(3.2 mol/L甘油)混合,对S.carpocapsaeAll的感染期线虫进行渗透胁迫,从而建立了一种用于昆虫病原线虫渗透性存储的方法(Fengetal., 2006)。由甘油和增强型人造海水的混合物组成的溶液用于在15℃下诱导不同品系的S.carpocapsae部分脱水,所有测试的菌株都对渗透液具有耐受性,而线虫的存活率和感染性均未受到影响(Yanetal., 2011)。环境中渗透压力也会影响昆虫病原线虫的生存。部分线虫拥有特殊的机制排出多余的水,也有的线虫在低渗透压情况下通过肠道排除水分(Thurstonetal., 1994)。
2.5 紫外线
利用昆虫病原线虫防治地上害虫时,紫外线是最重要的影响因子。采用有效方法降低紫外线对这类线虫造成的伤害有助于线虫更好地发挥作用。采用二苯乙烯荧光增白剂(Tinopal LPW)作为线虫的紫外保护剂,在日光灯和日光照射下均没有降低其生物活性,被认为是一种有前途的辐射防护剂(Nickleetal., 1992)。紫外线的影响在昆虫病原线虫之间存在很大的差异,线虫存活率还不足以评估线虫的应用潜力,应当同时评估毒力等性状(Shapiro-Ilanetal., 2015)。昆虫病原线虫不同品系均对紫外辐射具有一定的耐受能力(钱秀娟等, 2019)。添加纳米材料如ZnO、TiO2和Fe3O4等可抵抗紫外线,提高线虫对叶面害虫的防治效果(Makiritaetal., 2020),但不影响感染期线虫存活率(Makiritaetal., 2020)。
3 展望
昆虫病原线虫及其共生细菌业已成为多种有害生物的有效克星,走向了产业化和商业化。展望未来,这类制剂研发过程中需要克服的问题包括:1)昆虫病原线虫及其共生细菌的持续研发仍依赖其对多种害虫以及其它有害目标生物(如蜱、植物线虫、植物和人类病原菌等)的扩展应用和有效控制,这又反过来决定这类制剂的市场深度和广度;2)成本是昆虫病原线虫保持持续商业竞争力的关键因素。未来仍需要更优化的培养系统(包括培养方式、培养参数和质量监控)和更高效的贮存技术;3)共生细菌在昆虫病原线虫繁殖和致死昆虫方面发挥重要作用,共生细菌型变的调控信号和配体,次生型菌株在土壤和植物根系中的作用值得进一步研究;4)共生细菌次生代谢物质的种类挖掘,合成调控机制突破,以及商业化合成与应用仍是学者和企业家的高度期待;5)昆虫病原线虫、共生细菌以及寄主昆虫(尤其是黑腹果蝇Drosophilamelanogaster)三者在生物识别、免疫响应等的交互作用应为未来研究热点;6)通过遗传改良获得适应应用于极端气候条件(如干燥、高温或低温、紫外线等)的昆虫病原线虫品系对扩展这类生物杀虫剂的市场规模极为必要。
