α-卤代酰胺参与的氮杂环构建方法研究进展
2021-08-13汪钢强王航孙绍发吴滨刘吉开
汪钢强,王航,孙绍发,吴滨,刘吉开*
(1中南民族大学 药学院,武汉 430074;2 湖北科技学院 辐射化学与功能材料湖北省重点实验室&非动力核技术研发中心,咸宁 437100)
杂环化合物在医药、农药、材料和精细化工等许多领域发挥着重要作用,因此,开发新颖、有效的合成策略构建杂环化合物一直是人们关注的重点. 构建杂环化合物的合成方法多种多样,其中最为著名的方法就是金属催化. 但运用金属催化剂通常会产生一定量的金属残留,这往往限制了它在生物学和药物研发领域中的应用. 近年来,偶极环加成构建杂环的方法越来越受到关注,并成为继金属催化之后的另一热点. 因其具有高效性、高选择性、操作简便、环境友好等优点, 已经成为高效构建杂环骨架的重要合成工具之一. 2011年,JEFFREY课题组通过研究α-卤代酰胺与环二烯环加成物反应(图1),成功捕获到氮氧烯丙基阳离子中间体,该中间体可提供一种更加有效、高收率、非对映选择性好的制备各种双环内酰胺衍生物的途径[1-2].
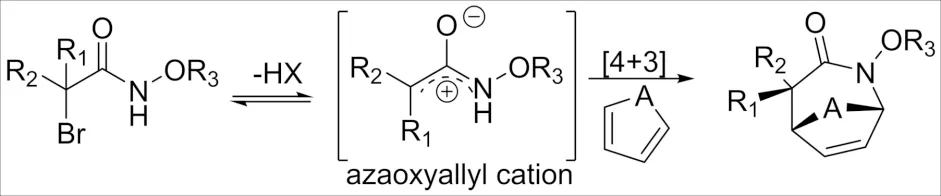
图1 氮氧烯丙基阳离子Fig.1 Azaoxyallyl cation
自此,α-卤代酰胺在碱性反应条件下生成的氮氧烯丙基阳离子产物成为一种备受关注的、高效的1,3-偶极子. 其参与的 [3+m]环加成/环化反应可用于构建各种具有生物活性的含氮杂环[3],该研究领域最新进展表明,原位形成的氮氧烯丙基阳离子的[3+m]环加成/环化反应不仅可用于合成简单的含氮杂环,也可应用于一些重要的天然产物或候选药物合成的关键步骤. 本文将总结近十年来α-卤代酰胺参与的[3+m]环加成反应或环化反应的最新研究进展.
1 α-卤代酰胺参与的[3+2]环加成/环化反应
2015年,研究发现α-卤代酰胺形成的氮氧烯丙基阳离子与吲哚类衍生物发生[3+2]环加成可快速构建吡咯并吲哚类衍生物的合成方法[4-5],通过密度泛函理论(DFT) (B3LYP-D3/6-311G**++)研究表明,该反应可能为一个分步反应途径,其初始的C-C键的形成发生在吲哚C3位,随后反应发生闭环反应得到目标产物. 机理研究表明,无论是使用三氟乙醇(TFE)还是六氟异丙醇(HFIP)溶剂时,反应中都是通过溶剂与氮氧烯丙基阳离子中间体之间的氢键形式稳定氮氧烯丙基阳离子才能使该环加成反应发生.
2016年清华大学LIAO课题组通过利用氮氧烯丙基阳离子与吲哚衍生物[3+2]环加成反应成功合成出天然产物(±)-Minfiensine (图 2)[6].
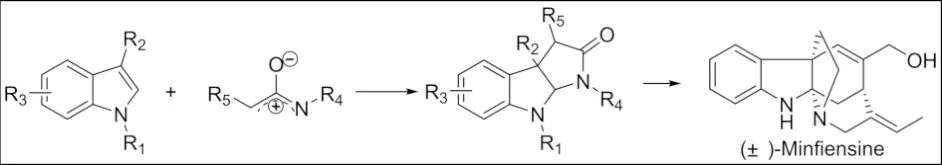
图2 α-卤代酰胺与吲哚衍生物环加成反应Fig.2 Cycloaddition reaction of α-haloamide with indole derivatives
2016年,LIN[7]和JEFFREY[8]分别报道了α-卤代酰胺和羰基化合物的直接[3+2]-环加成反应构建4-噁唑烷酮类化合物. 此外醛、酮、酯和酰胺中的酮基都可以参与该反应,该反应产率很高,在温和的条件下表现出良好的官能团耐受性. 随后,CHEN课题组[9]报道了由α-卤代酰胺与硫叶立德发生[3+1]/[3+2]环加成反应(图 3). 对于带有α-烷基的α-卤代酰胺,在K2CO3的作用下反应通过[3+1]-环加成反应平稳地进行,并且以中等的收率获得了β-内酰胺衍生物,并具有极好的非对映选择性(dr>19∶1). 当用含α-芳基的α-卤代酰胺,在Et3N作用下以 [3+2]-环加成反应发生,生成γ-内酰胺衍生物.
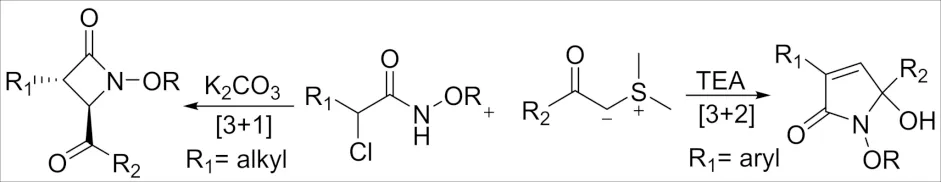
图3 α-卤代酰胺与硫叶立德环加成反应Fig.3 Cycloaddition reaction of α-haloamide and sulfur ylide
2017年,利用α-卤代酰胺[3+2]环加成构建了1,3-二氢-2H-吡咯-2-酮化合物、高效合成了噻唑烷-4-酮及其衍生物的方法,并且发现了简单烯醛与卤代酰胺的消除/[3+2]环加成反应(图4)[10-13]. 该方法也适用于无保护靛红类化合物与卤代酰胺的环加成构建含有螺环[吲哚啉-2,2' -噁唑烷]-3,4' -二酮为核心的杂环化合物.

图4 α-卤代酰胺参与的[3+2]环加成反应Fig.4 [3+2] Cycloaddition reaction of α-haloamide
2017年,HE课题组[14]报道了在DIPA作用下卤代酰胺与环酮的[3+2]环加成合成螺-4-噁唑烷酮(图 5),该反应在室温下以HFIP作溶剂, 4 Å MS 作添加剂. 该反应底物普适性好、产率高、操作简便,使其成为合成螺4-噁唑烷酮的重要方法. 2017年,WANG课题组[15]报道了α-卤代酰胺与烯醛的[3+2]-环加成反应合成噁唑烷-4-酮(图 5). 该体系对底物的普适性研究发现烯醛的取代基位置和电子效应对反应转化的影响有限. 另外,作者考查了其他类型的α-卤代酰胺,实验结果显示出其良好的性能. 当R1为烷基或苯基且R2为氢时,发现α-溴/氯卤代酰胺都可发生反应,并以高收率和良好的非对映选择性产生所需的产物. 但是当使用N-苄基-2-溴-2-甲基丙酰胺底物时,反应不发生.
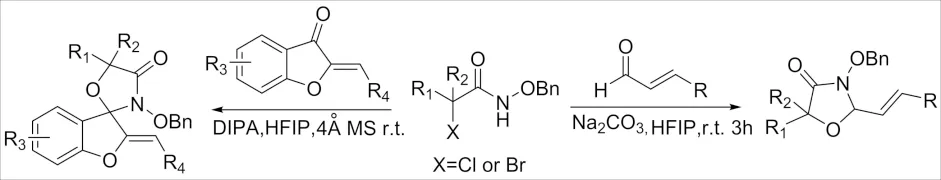
图5 α-卤代酰胺与羰基的[3+2]环加成反应Fig.5 [3+2] Cycloaddition reaction of α-haloamide with carbonyl
2018年,ERDEN 课题组[16]发现了α-卤代酰胺与N-芳基亚胺的[3+2]环加成反应(图 6). 该环加成反应具有较好的区域选择性,研究发现虽然反式咪唑啉-4-酮的生成途径可以进行,但顺式产物更容易产生.
2018年,JI 和 SUN课题组[17]报道了利用α-卤代酰胺与1,3,5-三嗪的[3+2]环加成反应,合成了4-咪唑啉酮及其衍生物(图 6). 该方法的特点是在碱作用下,α-卤代酰胺和1,3,5-三嗪分别原位产生氮杂烯丙基阳离子,并且芳基亚胺作为1,3-和1,2-偶极子参与偶极环加成.
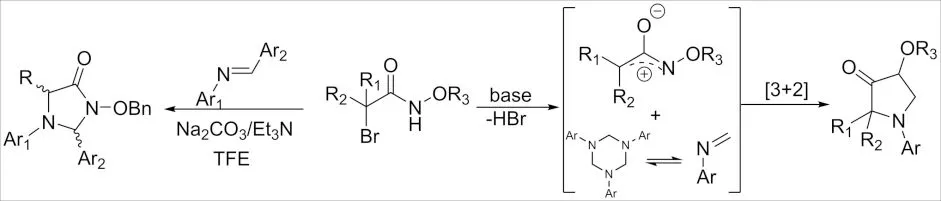
图6 α-卤代酰胺与烯胺的[3+2]环加成反应Fig.6 [3+2] Cycloaddition reaction of α-haloamide and enamine
2018年SINGH等[18]通过芳炔与α-卤代酰胺的[3+2]环加成反应来获得C3未取代和C3取代的吲哚(图7). 值得注意的是,该反应条件不同于该系列化学反应中传统使用的反应条件,即使用THF代替含氟化溶剂,四丁基氟化铵(TBAF)代替了碱. 此外,该反应与其他氮氧烯丙基阳离子反应相反,伯N-烷氧基α-溴酰胺(R2=R3=H)能够反应,但二取代的N-烷氧基溴酰胺(R2和R3≠H)不反应,作者认为该机制可能涉及芳炔与瞬时α-内酰胺的协同环加成,而不是形成经典的氮氧烯丙基阳离子中间体. 他们还证实当把N-烷氧基取代基换成N-苄基酰胺时,反应不发生,这也再次证明了N-烷氧基取代基的重要作用.

图7 α-卤代酰胺与苯炔的[3+2]环加成反应Fig.7 [3+2] Cycloaddition reaction of α-haloamide and benzyne
2018年,报道了卤代酰胺与异氰酸酯、腈、氰胺之间的[3+2]环加成反应,从捕获的中间体表明,原位产生的两性离子在促进合成中起着至关重要的作用[19-20](图 8). 该方法可用于厄贝沙坦等药物的合成.
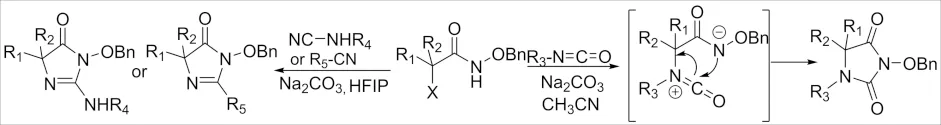
图8 α-卤代酰胺参与的[3+2]环加成反应Fig.8 [3+2] Cycloaddition reaction of α-haloamide
2018年,HUANG课题组[21]报道了α-卤代酰胺和芳香族乙烯的直接[3+2]环加成反应合成吡咯烷酮. 2019年,CHEN等[22]发现氨基磺酸衍生的环状亚胺与未取代或单取代的α-卤代酰胺之间通过aza-Mannich加成/分子内亲核取代环化反应(图9),该反应具有优良的区域选择性和非对映选择性、条件温和、对多种官能团具有优异的耐受性等特点,机理研究表明该反应途径可能是通过aza-Mannich/ SN2环化反应实现的.

图9 α-卤代酰胺与环状亚胺的[3+2]环加成反应Fig.9 [3+2] Cycloaddition reaction of α-haloamide and cyclic imine
2019年,分别发现了α-卤代酰胺与环丙烯酮、硫代羰基化合物的[3+2]-环加成反应(图10)[23-24]. 其中,反应过程中2-氨基噻唑烷酮-4-酮中的C2氨基在HFIP中表现出高度的不稳定性,为其用作潜在的反应活性基团,并引入重要的官能团提供了机会. 重要的是,这种化学合成方法不需要任何路易斯酸或金属催化剂就能有效地发挥作用.
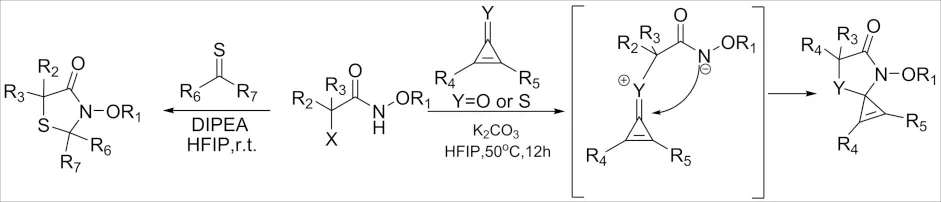
图10 α-卤代酰胺与环丙烯酮的[3+2]环加成反应Fig.10 [3+2] Cycloaddition reaction of α-haloamide andcyclopropenone
2019年LIN等[25]报道了α-卤代酰胺与1,2-苯并异噁唑之间的新颖且高效的[3+2]环加成反应(图11),但是该反应对1,2-苯并异噁唑上的取代基比较敏感,当使用3-甲基-1,2-苯并异噁唑时,仅以13%~16%的收率获得不稳定的三环咪唑酮,这可能是由于空间位阻效应所引起的. 2019年,CHEN课题组[26]报道了巴比妥酸酯衍生的烯烃和α-卤代酰胺通过多米诺aza-Michael/SN2反应以优异的产率获得螺环巴比妥酸酯-吡咯烷酮. 该多米诺[3+2]环化反应为合成螺巴比妥酸酯-吡咯烷酮提供了实用的合成方法.
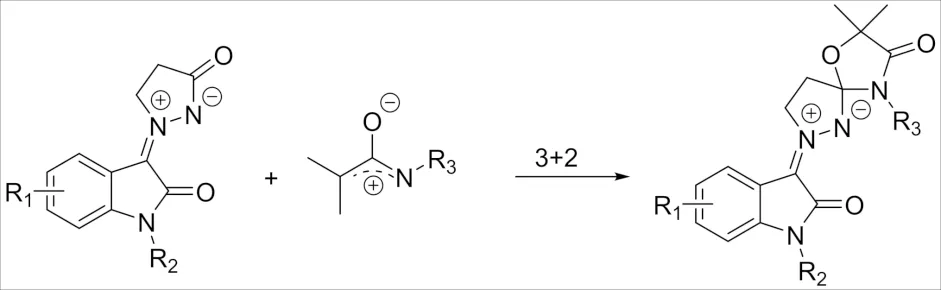
图11 α-卤代酰胺与靛红亚甲亚胺的[3+2]环加成反应Fig.11 [3+2] Cycloaddition reaction of α-haloamide and isatinimine
2020年,CHEN课题组[27]报道了一种不寻常的靛红亚甲亚胺与氮氧基烯丙基阳离子[2+3]环加成的反应,这项工作不仅揭示了靛红亚甲亚胺在环加成反应中的新作用,而且还提供了有效地获得前所未有的螺杂环化合物的途径,该反应没有像其他靛红亚甲亚胺1,3-偶极子和氮氧烯丙基阳离子那样经历[3+3]环加成过程的原因可能是由于靛红亚甲亚胺的空间效应或电子效应所引起的.
2 α-卤代酰胺参与的[3+3]环加成/环化反应
2016年,WU课题组[28]报道了α-卤代酰胺与异喹啉N-氧化物之间的[3+3]环加成合成1,11b-二氢-[1,2,4]噁二嗪基[3,2-a]异喹啉-2(3H)-酮类化合物的合成方法(图12). 值得注意的是碱的选择对产物有着重要的影响,使用Na2CO3或Cs2CO3做碱时,得到不同的化合物. 原因是当碱性过强时,生成的产物会发生去质子化,导致N-O断裂,氧负离子的分子内亲核攻击并重排生成2-(异喹啉-1-基氧基)乙酰胺.
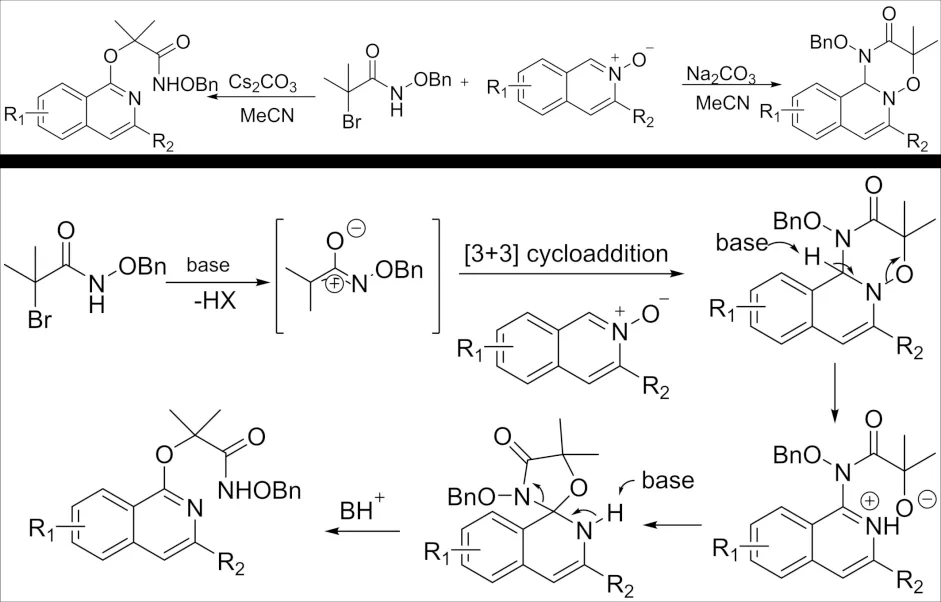
图12 α-卤代酰胺与异喹啉N -氧化物的[3+3]环加成反应Fig.12 [3+3] Cycloaddition reaction of α-haloamide with isoquinoline N-oxide
2017年,相继报道了α-卤代酰胺与硝酮环加成合成1,2,4-噁二嗪-5-酮化合物的方法[29-32],该方法可应用于快速构建含噁二嗪类骨架的药物合成.在DIPEA作用下α-卤代酰胺与靛红硝酮类化合物之间的[3+3]环加成反应合成螺型1,2,4-噁二嗪烷-5-酮羟吲哚化合物[33],底物普适性探究表明: 该反应具有较高的非对映选择性. 该方法为潜在的生物活性螺环吲哚提供了直接和有效的途径,并且该螺环吲哚含有六元杂环骨架.
同年还报道了α-卤代酰胺和氯代腙原位生成的氮氧烯丙基阳离子和腈亚胺偶极子的[3+3]环加成反应合成 (Z)- 4h -1,3,4-噁二嗪- 6(5H)-亚胺(图13)的方法[34],该反应过程中氮氧烯丙基阳离子的反应活性位点为C,O-1,3偶极并且作者通过DFT[CPCM-B3LYP/6-311+G(d,p)]理论计算证实其机理的可靠性.

图13 α-卤代酰胺和氯代腙的[3+3]环加成反应Fig.13 [3+3] Cycloaddition reaction of α-haloamide and chlorohydrazone
2017年,分别报道了α-卤代酰胺与2-烯基吲哚和叠氮化合物之间的新型[3+3]环加成反应(图14)[35-36]. 该方法是为数不多的合成1,2,3,4-四氮六元杂环的方法,为1,2,3,4-四嗪及其衍生物的应用提供了一种可靠、方便的合成方法.
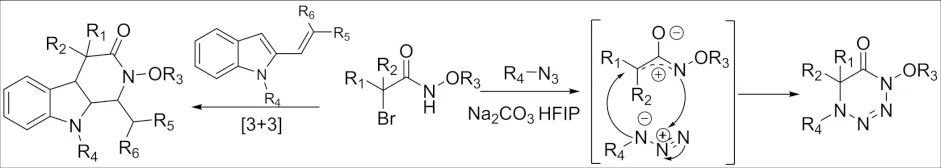
图14 α-卤代酰胺参与的[3+3]环加成反应Fig.14 [3+3] Cycloaddition reaction of α-haloamide
2018年,XIAO等[37]报告了一种由Ag(I)介导的C,N-环偶氮甲亚胺与氮氧烯丙基阳离子的[3+3]环加成反应,以良好或优异的产率获得一系列重要的生物活性较好的异喹啉稠合的三嗪衍生物. 同时该小组开发了一种无金属催化下在碘或溴(I2或Br2)存在下原位生成C,N-环偶氮甲亚胺与氮氧烯丙基阳离子偶极环加成的方法[38],以优异的产率获得了一系列重要的异喹啉稠合的三嗪衍生物,特别是其产物结构中含有一个比较有价值的烯基C—X键(X=Br,I)(图15),为其结构修饰提供了一个很好的活性位点.

图15 α-卤代酰胺与C,N-环偶氮甲亚胺的[3+3]环加成反应 Fig.15 [3+3] Cycloaddition reaction of α-haloamide and C,N-cycloazomethine
2018年,GANDON等[39]报道了Ca(NTf2)2/n-Bu4NPF6催化2-呋喃基甲醇、苯胺和α-卤代酰胺之间aza-Piancatelli/氮氧烯丙基阳离子三组分环化构建环戊[b]-哌嗪酮衍生物策略. 作者通过DFT计算解释了aza-Piancatelli/氮氧烯丙基阳离子反应的反应机理. 2018年,WANG课题组[40]报道了α-卤代酰胺与原位生成的腈氧化物进行环加成,合成了1,2,4-噁二嗪-5-酮及其衍生物. 2019年,WANG课题组[41]报道了在Et3N作用下α-卤代酰胺与1,4-二噻吩-2,5-二醇的环加成反应(图 16),合成硫吗啉代-3-酮衍生物. 该方法表现出良好的官能团耐受性,该方法可用于含硫杂环化合物的合成.
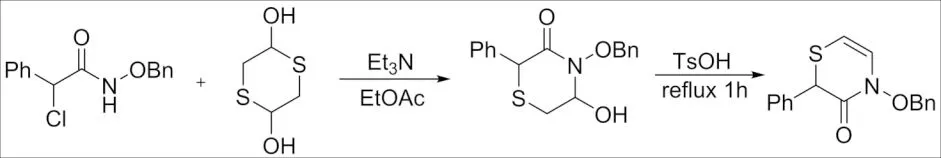
图16 α-卤代酰胺与1,4-二噻吩-2,5-二醇的[3+3]环加成反应Fig.16 [3+3] Cycloaddition reaction of α-haloamide with 1,4-dithiophene-2,5-diol
3 α-卤代酰胺参与的[3+4]环加成/环化反应
2011年,JEFFREY[42]首次报道了N-苄氧基α-卤代酰胺在含氟溶剂中碱性条件下与环状二烯反应(图1),以高收率和非对映选择性合成出双环内酰胺类化合物. 并且作者通过DFT计算(B3LYP/6-31G*)和大量实验数据证实了该反应是通过氮氧烯丙基阳离子中间体进行. 另外研究表明α-卤代酰胺化合物中N-烷氧基取代基对于该反应是必不可少的,通过理论计算分析表明它起到稳定阳离子中间体的作用. 随后2013年,JEFFREY等[1-3]又实现了通过将芳香二烯连接到氮氧烯丙基阳离子氮末端的原料,开发出一种分子内形式 [3+4]环加成反应构建多种多杂环稠合的杂环结构合成方法(图17).
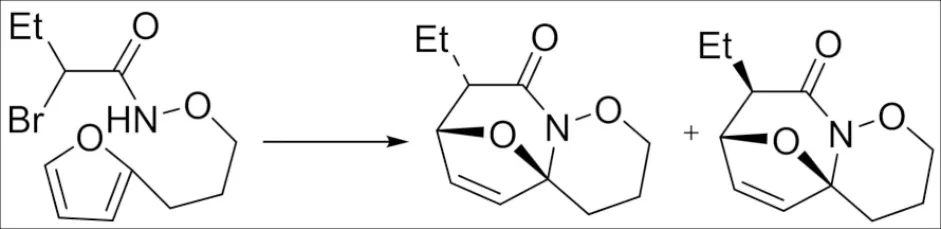
图17 分子内 [3+4]环加成反应Fig.17 Intramolecular [3+4] cycloaddition reaction
进一步研究发现呋喃和吡咯衍生物均可适合于该分子内[3+4]-环加成反应[43]. 但是值得注意的是,底物中连接的碳链长度对反应结果具有显著影响,当碳链为5至7个碳时,反应可以很好地进行,然而,如果将连接碳链进一步加长至8个碳原子或更长的长度时,不能获得环加成产物,而是得到一些结构独特的大环产物(图 18).

图18 分子内 [3+4]环加成反应Fig.18 Intramolecular [3+4] cycloaddition reaction
2016年LIAO课题组[44]介绍了无金属催化经由氮氧烯丙基阳离子中间体的分子内环化构建N-羟基氧化吲哚的反应,该方法可用于构建一些生物活性的吲哚类化合物,研究发现反应底物中的-OH是必不可少的,可能其能够稳定形成的氮氧烯丙基阳离子中间体.
2019年,ZHAO课题组[45]报道了无金属催化α-卤代酰胺和苯并异噁唑[3+4]环加成反应合成多取代苯并二氮杂卓衍生物的新方法(图19),该过程无需添加过渡金属催化剂即可进行,具有很好的应用价值.
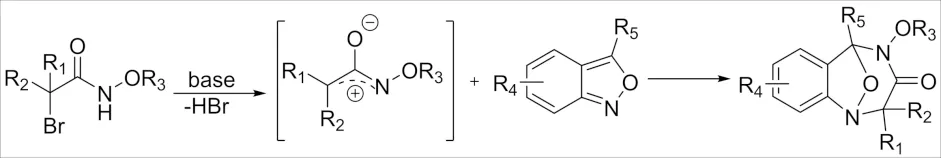
图19 α-卤代酰胺和苯并异噁唑 [3+4]环加成反应Fig.19 [3+4] Cycloaddition reaction of α-haloamide and benzisoxazole
2019年,SAHA[46]和KIM[47]课题组先后报道了碱促进γ-羟基和δ-羟基的α,β-不饱和羰基化合物与氮氧烯丙基阳离子[3+3]/[3+4]环加成反应(图 20),该方法可用于快速构建6,7元含N,O杂环类化合物. 反应机理应为首先羟基烯酮中的羟基进行氮氧烯丙基阳离子然后再经过分子内aza-Michael 加成反应形成所需要的目标化合物.
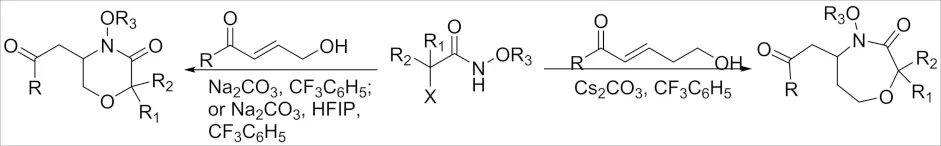
图20 α-卤代酰胺和羟基烯酮环加成反应 Fig.20 Cycloaddition reaction of α-haloamide and hydroxyketene
2019年,ZHANG[48]报道了N-(2-氯甲基)芳基酰胺与N-烷氧基α-卤代酰胺经过串联aza-Mannich加成/分子内SN2多米诺[4+3]环化反应合成四氢-1,4-苯并二氮杂-3-酮生物的合成方法,产率最高达95%. 2020年KIM课题组[49-50]报道了一种无催化剂作用下制备空间位阻较大的α-氨基酸酰氨合成1,4-苯并二氮杂-3-酮衍生物的方法(图21). 此外,作者还介绍了一种2-氨基苯基α,β-不饱和羰基与α-卤代酰胺的aza/aza-[4+3]环加成反应制备1,4-苯并二氮杂-3-酮衍生物的重要方法.

图21 α-卤代酰胺参与的 [3+4]环加成反应Fig.21 [3+4] Cycloaddition reaction involving α-haloamide
2020年,报道了一种无金属催化α-卤代酰胺与N-磺酰基-1-氮杂-1,3-丁二烯经多米诺aza-Mannich加成/分子内SN2环化反应制备1,4-二氮杂庚酮衍生物的合成方法[51],该反应产率高,并具有广泛的底物范围. 随后,由HFIP介导的靛红酸酐与α-卤代酰胺[4+3]环化构建七元1,4-苯并二氮杂二酮衍生物的方法被报道[52](图22),该反应首先经过靛红酸酐脱羧,与HFIP加成,再与氮氧烯丙基阳离子加成,然后分子内取代等多步串联反应所形成的.
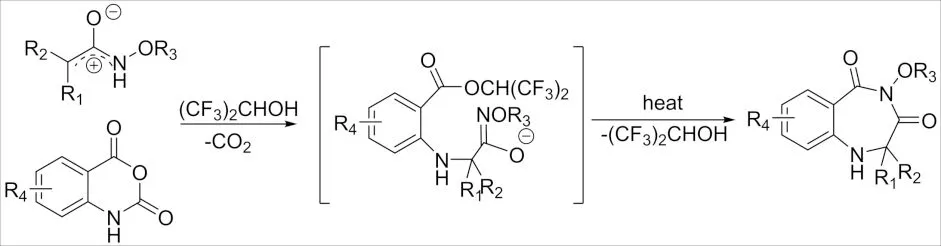
图22 α-卤代酰胺与靛红酸酐的 [3+4]环加成反应Fig.22 [3+4] Cycloaddition reaction of α-haloamide andisatoic anhydride
4 α-卤代酰胺参与的其他环加成/环化反应
2016年,报道了一种由取代基控制化学反应选择性的合成方法(图23)[53],通过亚甲基吲哚满酮和α-溴代酰胺制备具有优异的非对映选择性的螺氧化吲哚和噁唑多辛吲哚的方法,当为N-苄氧基-α-溴代酰胺发生消除-迈克尔加成来构建螺氧吲哚,而当底物为N-苯甲酰基-α-溴代酰胺时发生的是环化-迈克尔加成来制备噁唑多辛吲哚. 通过机理分析,该两种合成方法都涉及到一个亲核反应和亲核触发的串联反应.
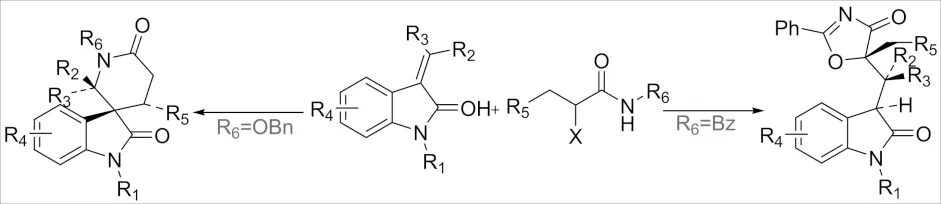
图23 α-卤代酰胺与亚甲基吲哚满酮的环加成反应Fig.23 Cycloaddition reaction of α-haloamide withmethylene indolinone
2018年,ZHANG等[54]报道了一种α-卤代酰胺与N-(2-氯甲基)芳基酰胺[4+2]环加成反应(图24),与传统的卤代酰胺的参与的环加成反应不同的是N-(2-氯甲基)芳基酰胺原位生成的氮杂-邻醌甲基化物并没有和氮氧杂烯丙基阳离子发生[4+3]反应,而是与氮氧杂烯丙基阳离子中C=O双键发生[4+2] 环加成得到1,4-二氢-2H-苯并[d] [1,3]噁嗪产物,产率高达可达99%.
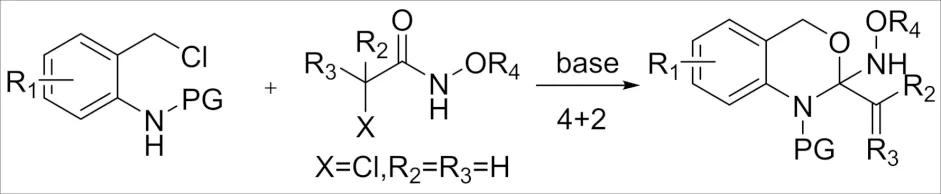
图24 α-卤代酰胺与氮杂-邻醌甲基化物的 [2+4]环加成反应Fig.24 [2+4] Cycloaddition reaction of α-haloamide withaza-o-quinone methide
2019年,BIJU课题组[55]开发出无过渡金属条件下原位生成氮氧烯丙基阳离子与托品酮的[8+3]-环加成反应来构建环庚三烯稠1,4-噁二酮的合成方法(图25). 研究发现当与α位无取代的托品酮反应时,环加成反应后会进行1,7-H转移,而当α位为芳基取代时,环加成反应形成后不会发生1,7-H转移.
2020年,同样发现由托品酮和α-卤代酰胺之间的[8+3]环加成合成一种含氮[7,6]双环化合物方法[56],该反应的选择性可以通过α-卤代酰胺的取代基来控制. 该反应机理为托品酮和α-卤代酰胺先生成4-噁唑烷酮中间体,再通过[1,2]迁移可得两种化合物,并且该两种化合物的比率可以通过α-卤代酰胺的取代基来调控(图26).
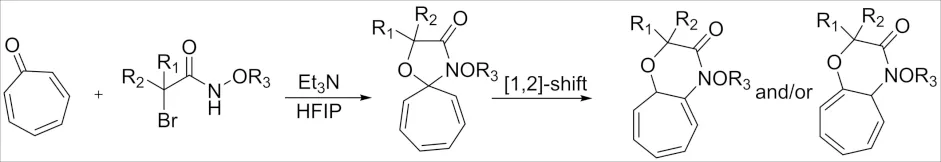
图26 α-卤代酰胺与托品酮[8+3]环加成反应Fig.26 [8+3] Cycloaddition reaction of α-haloamide and tropinone
5 总结与展望
本文总结了使用原位形成的氮氧烯丙基阳离子通过[3+m]-环加成/环化反应在含氮杂环合成中的最新进展. 这些环加成/环化过程不仅可应用于各种含氮杂环的简便构建中,而且还可以应用于天然产物的全合成和药物先导化合物的后期修饰中.从简单化合物合成具有结构多样性的复杂分子一直是有机合成领域的一个挑战问题[57],在未来杂环化合物合成中使用氮氧烯丙基阳离子作为关键中间体将进一步引起化学家的关注. 尽管过去近十年中这方面的研究取得了一些重大进展,但仍然存在一些挑战和机遇:首先,在氮氧烯丙基阳离子的[3+m]-环加成/环化反应中,大多数报道的m-单元亲偶体需要预先合成,因此将来的目标是不断开发出更加有效地利用原位形成的氮杂烯丙基阳离子与同时产生、原位生成的反应物进行环加成/环化反应;其次,与氮氧基烯丙基阳离子相比,涉及二氮氧基烯丙基阳离子中间体的环加成反应在很大程度上一直未被探索出来,需进一步努力摸索途径方法;第三,氮氧基烯丙基阳离子参与的不对称环加成/环化反应将是未来研究的另一个非常重要的方向.
