鸡蛋壳基多孔碳酸钙对刚果红吸附特性研究
2021-08-12陈燕萌何春妮王永仕蒙莫姬蓝峻峰
陈燕萌,何春妮,潘 亭,王永仕,蒙莫姬,蓝峻峰
(1.广西科技师范学院,广西来宾546199;2.来宾市检验检测中心)
碳酸钙是一种稳定的无机材料,是无机材料重要的成员。在自然界中,碳酸钙主要以石灰石、大理石、白垩等形式存在,其无水结晶形态主要有方解石、文石、球霰石3种[1]。碳酸钙粉体具有明显的补强增白和增强制品刚性、抗冲性以及易加工、易成型、无味、无毒、成本低等优势,因而被广泛应用于塑料、电缆、造纸、饲料、涂料、医药、日用化工等新领域,具有广阔的发展前景。
多孔碳酸钙是近代发展起来的一种新型多功能材料,拥有比表面积大、生物相容性好等优势,被广泛应用于多种行业,如药物载体[2-3]、生物微胶囊[4-5]、生物陶瓷[6-7]、造纸[8]、化妆品[9]、超疏水表面构建[10]等领域。目前,国内外在制备多孔碳酸钙时常采用 的 方 法 有 乳 状 液 膜 法[11]、模 板 法[12]、溶 剂/水 热法[13]、共沉淀法[14]、凝胶结晶法、盐析法[15]等。其中,模板法是制备多孔碳酸钙技术较成熟且常用的一种方法。
刚果红是一种典型的联苯胺类偶氮染料,在生产和使用过程中流失率高,易进入水体,是印染废水中有代表性的污染物之一。国内外常用于工业染料废水处理的方法有:氧化法、絮凝法、混凝法、吸附法、电凝聚法、膜处理以及催化反应等方法[16],其中吸附法是一种经济有效、便捷快速的处理方法。常用的吸附剂有生物质、壳聚糖、活性炭、粉煤灰和膨胀石墨等,但这些吸附剂不仅价格昂贵,且在存在吸附量小、循环利用率低、机械性能较差、吸附的离子不易回收等问题。
鸡蛋壳主要成分为CaCO3,占蛋壳干重的95%以上[17],是一种丰富的钙源。本文以鸡蛋壳为原料,采用模板法制备多孔碳酸钙,并将其应用于刚果红的吸附研究以期为工业染料的处理提供新思路,具有以废治废的实际意义。
1 实验部分
1.1 实验仪器与试剂
1.1.1 主要实验仪器
FZ102型中草药粉碎机;SGZ-82A型恒温水浴振荡器;JA12002型电子分析天平;H1850型离心机;UV-2600型紫外可见分光光度计、IRTracer-100型红外光谱;Sigma300型扫描电子显微镜。
1.1.2 主要实验试剂
氢氧化钠、盐酸、十二烷基硫酸钠(SDS)、碳酸钠、无水乙醇,均是AR级;刚果红,AR级。
1.2 实验方法
1.2.1 鸡蛋壳粉的预处理
将收集的废弃鸡蛋壳冲洗干净,去除残留的蛋清液及外壳污物后,放入质量分数为5.5%的氢氧化钠溶液,缓慢加热、搅拌,去除鸡蛋壳的内膜。脱膜后的蛋壳用自来水淘洗数遍,沥干大部分水分,置于100℃电热干燥箱中干燥1 h,最后取出粉碎,装袋密封保存,备用。
1.2.2 多孔碳酸钙的制备工艺
图1 为鸡蛋粉制多孔碳酸钙的工艺流程。
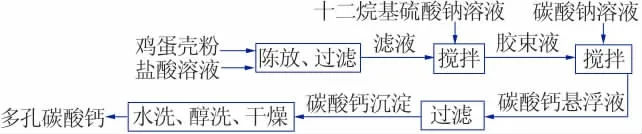
图1 鸡蛋壳粉制多孔碳酸钙的工艺流程图Fig.1 Process flow chart of preparing porous calcium carbonate from egg shell powder
操作要点:将一定量处理好的鸡蛋壳粉加入到一定浓度的HCl溶液中充分反应,陈放一段时间后进行过滤,除去过量的蛋壳粉末,保留滤液;室温下,在搅拌过程中往滤液中加入一定浓度的SDS溶液,搅拌1min后加入一定浓度的Na2CO3溶液,继续搅拌10 min,得到碳酸钙悬浮液;最后过滤,得到碳酸钙沉淀,对沉淀进行洗涤、干燥,最终得到多孔碳酸钙产品。
1.2.3 多孔碳酸钙的吸附实验
称取一定量的多孔碳酸钙置于250 mL带塞锥形瓶中,加入一定量质量浓度为300 mg/L的刚果红溶液,置于恒温水浴振荡器中吸附一定时间,取出离心10 min,吸取上层清液,利用紫外可见分光光度计在波长为500 nm处测其吸光度,通过刚果红标准曲线方程计算溶液浓度,然后根据下列公式计算刚果红的吸附量Q和吸附率η:

式中,η为吸附率,%;Q为吸附量,mg/g;V为刚果红溶液体积,mL;C0为刚果红溶液初始质量浓度,mg/L;C为吸附后刚果红质量浓度,mg/L;m为吸附剂质量,g。
1.3 刚果红标准曲线的绘制
准确称取刚果红标准样品0.050 0 g,加入少量蒸馏水溶解后移入500 mL容量瓶内,定容至刻度,摇匀,制得100 mg/L刚果红标准溶液,备用。
分 别 移 取10、15、20、25、30 mL,质 量 浓 度 为100 mg/L刚果红标准溶液,置于1、2、3、4、5号50 mL的容量瓶中,定容,摇匀,得到质量浓度依次为20、30、40、50、60 mg/L的刚果红溶液。以蒸馏水为参比,利用紫外可见分光光度计在500 nm处分别测定以上不同浓度刚果红溶液的吸光度。以刚果红的质量浓度C为横坐标、以吸光度A为纵坐标进行线性拟合,得到标准曲线和线性回归方程:y=0.014x+0.012 45,R2=0.999 8,如图2所示。

图2 刚果红标准曲线Fig.2 Standard curve of congo red
2 结果与分析
2.1 扫描电镜分析
图3 分别为不加模板剂与添加模板剂的碳酸钙产品的SEM图。由图3可见,所制碳酸钙产品为球形碳酸钙。对比图3a和图3b可知,不加模板剂制备出来的碳酸钙表面较光滑,而添加模板剂制备出来的多孔碳酸钙产品表面非常粗糙,孔道清晰可见。

图3 碳酸钙材料的SEM图Fig.3 SEM images of calcium carbonate materials
2.2 吸附性能研究
2.2.1 多孔碳酸钙投加量对吸附效果的影响
分 别 称 取0.05、0.10、0.15、0.20、0.25、0.30 g多孔碳酸钙样品置于250 mL带塞锥形瓶中,分别加入25 mL质量浓度为300 mg/L的刚果红溶液,于30℃的恒温水浴振荡器中恒温吸附6 h后,取出离心10 min,吸取上层清液,利用紫外可见分光光度计在波长为500 nm处测定其吸光度,并计算出对应的吸附率,结果如图4所示。由图4可以看出,随着多孔碳酸钙用量的增加,对刚果红的吸附率随之增加,当多孔碳酸钙添加量为0.15 g时,吸附率达到最大,为92.82%,此后继续增加碳酸钙用量,吸附率趋于平衡,故选择0.15 g为较佳用量。

图4 多孔碳酸钙投加量对吸附效果的影响Fig.4 Influence of the dosage of porous calcium carbonate on the adsorption effect
2.2.2 刚果红溶液初始浓度对吸附效果的影响
配 制 质 量 浓 度 分 别 为100、200、300、400、500、600 mg/L的刚果红溶液,移取各浓度刚果红溶液25 mL于250 mL带塞锥形瓶中,分别加入0.15 g多孔碳酸钙,于30℃的恒温水浴振荡器中恒温吸附6 h后,取出离心10 min,吸取上层清液,利用紫外可见分光光度计在波长为500 nm处测定其吸光度,并计算出对应的吸附率和吸附量,结果见图5。由图5可以看出,随着刚果红浓度的增加,多孔碳酸钙对刚果红的吸附率呈现下降趋势,但吸附量呈现上升趋势,并在质量浓度为300 mg/L时,吸附量达到最大值,此后继续增大浓度,吸附量趋于平稳。综合两者考虑,故选择300 mg/L为刚果红较佳吸附浓度。
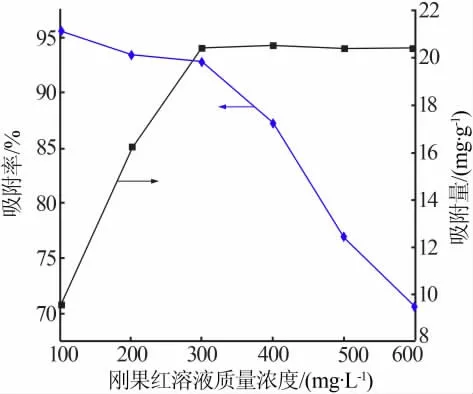
图5 刚果红溶液初始浓度对吸附效果的影响Fig.5 Influence of initial concentration of Congo red solution on adsorption effect
2.2.3 吸附时间对吸附效果的影响
分别称取10份0.15 g多孔碳酸钙样品置于250 mL带塞锥形瓶中,同时加入25 mL质量浓度为300 mg/L刚果红溶液,于30℃的恒温水浴振荡器中恒温吸附,设置各试样吸附时间依次为1、2、3、4、5、6、7、8、9、10 h,吸附到达设定时间后,取出离心10 min,吸取上层清液,利用紫外可见分光光度计在波长为500 nm处测定其吸光度,并计算出对应的吸附率,结果如图6所示。由图6可以看出,随着吸附时间的延长,多孔碳酸钙对刚果红的吸附率呈现上升趋势,在6 h内吸附率增长速度较快,在6 h之后吸附率增长速度变慢,且在7 h后吸附率几乎达到平衡,故选择7 h为最佳吸附时间。
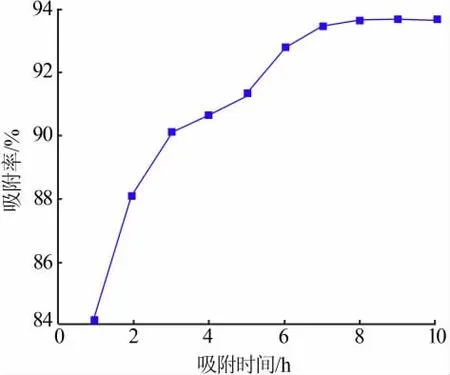
图6 吸附时间对吸附效果的影响Fig.6 Influence of adsorption time on adsorption effect
2.2.4吸附温度对吸附效果的影响
称取6份0.15 g多孔碳酸钙样品置于250 mL带塞锥形瓶中,加入25 mL质量浓度为300 mg/L刚果红溶液,分别于20、30、40、50、60、70、80℃的恒温水浴振荡器中恒温吸附7 h后,取出离心10 min,吸取上层清液,利用紫外可见分光光度计在波长为500 nm处测定其吸光度,并计算出对应的吸附率η,结果见图7。由图7可见,吸附温度从20℃增加到80℃时,吸附率从90.3%增长到93.2%,可见温度虽对吸附效果有一定的影响,但影响程度不是很大,可结合实际条件选择室温作为吸附温度。

图7 吸附温度对吸附效果的影响Fig.7 Influence of adsorption temperature on adsorption effect
2.3 吸附等温模型
图8 为多孔碳酸钙在恒温20、30、40℃下吸附刚果红的等温吸附线。为进一步分析刚果红的吸附特性,采用不同的等温吸附方程来研究拟合刚果红的等温吸附模型,包括Langmuir和Freundlich等温吸附模型。Langmuir和Freundlich吸附等温式分别为[18]:
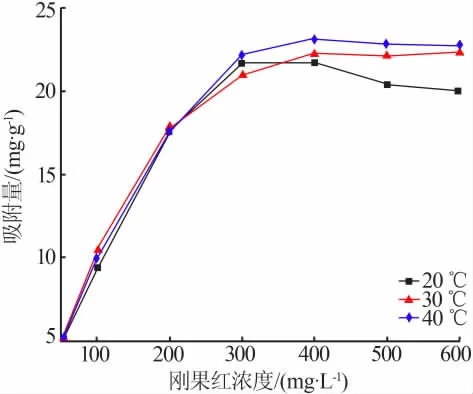
图8 20、30、40℃下的等温吸附线Fig.8 Adsorption isotherms at 20,30,40℃
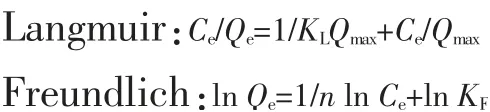
式中:Qe为平衡吸附量,mg/g;Qmax为单分子吸附时饱和吸附量,mg/g;Ce为吸附达平衡后吸附质的浓度,mg/L;KL为Langmuir吸附平衡常数,L/mg;n为Freundlich吸附强度;KF为Freundlich吸附平衡常数。
在相同的吸附时间和吸附剂用量下,改变刚果红的初始质量浓度(100、200、300、400、500 mg/L)和吸附温度(20、30、40℃),测其吸附率,并用Langmuir和Freundlich吸附等温模型分别对数据进行线性拟合,拟合结果见表1。由表1可以看出,采用Langmuir方程拟合的R2分别为0.98、0.997、0.975,明显优于采用Freundlich方程拟合的R2(分别为0.385、0.803、0.795),这说明多孔碳酸钙对刚果红的吸附较符合Langmuir等温吸附模型。由于Langmuir模型是描述单分子层的理论模型,因此,表明多孔碳酸钙对刚果红的吸附属于单分子层吸附。

表1 多孔碳酸钙对刚果红的吸附等温拟合参数Table 1 Fitting parameters of adsorption isotherm of porous calcium carbonate to Congo red
2.4 吸附动力学模型
分别采用准一级吸附动力学方程和准二级吸附动力学方程拟合多孔碳酸钙对质量浓度为300 mg/L刚果红的吸附量随着时间变化关系,拟合参数见表2。准一级动力学方程和准二级动力学方程分别为:

表2 多孔碳酸钙对刚果红的吸附动力学模型参数Table 2 Model parameters of adsorption kinetics of porous calcium carbonate to Congo red

式中Qe为平衡吸附量,mg/g;Qt为时间t时的吸附量,mg/g;k1为准一级吸附速率常数,g/(mg·min);k2为准二级吸附速率常数,g/(mg·min)。
由表2可以看出,准二级吸附动力学方程拟合出来的相关系数R2=0.999,拟合效果优于准一级,表明多孔碳酸钙对刚果红吸附动力学比较符合准二级动力学模型。
2.5 红外表征分析
分别将吸附刚果红前、后的多孔碳酸钙和溴化钾以1∶100的质量比混合,用玛瑙研钵磨成粉,进行压片后放到型号为IRTracer-100的红外光谱仪测其红外光谱,结果如图9所示。由图9看出,对比吸附刚果红前后吸附剂的红外谱图,在1796 cm-1附近出现的弱峰是碳酸钙C=O伸缩振动吸收峰,1 421 cm-1附近出现的是碳酸钙C—O不对称伸缩振动吸收峰,在876 cm-1附近处出现的为碳酸钙C—O面内弯曲振动吸收峰,在713 cm-1附近出现的是碳酸钙C—O面外弯曲振动吸收峰[19]。吸附前、后多孔碳酸钙材料的吸收峰没有出现明显变化,只是吸附后的碳酸钙各峰吸收强度有所增强,说明多孔碳酸钙对刚果红的吸附主要以物理吸附为主。

图9 多孔碳酸钙吸附刚果红前后的红外谱图Fig.9 Infrared spectra of porous calcium carbonate before and after adsorption of Congo red
3 结论
以废弃物鸡蛋壳为原料,以十二烷基硫酸钠为模板剂,可成功制得球形多孔碳酸钙微粒,且该产品对刚果红具有一定的吸附能力。试验结果表明,所制多孔碳酸钙材料对刚果红的适宜吸附条件为:室温、多孔碳酸钙添加量为0.15 g、质量浓度为300 mg/L的刚果红溶液25 mL、吸附时间为7 h;该条件下的吸附率约为93%。多孔碳酸钙对刚果红的吸附属于单分子层吸附,吸附动力学比较符合准二级动力学模型。
