氨碱废液溶采二层盐制备优级液体盐工艺研究
2021-08-12王润璞胡开宝王占和高卫星
王润璞,杜 威,胡开宝,王占和,高卫星,唐 娜
(1.天津科技大学化工与材料学院,天津300457;2.内蒙古兰太实业股份有限公司)
内蒙古吉兰泰盐湖开采多年,其卤水水质老化问题日渐严重[1-3]。同时,以液体盐为原料,氨碱法生产纯碱的工艺中会产生氨碱废液,国内对于废液的处理多以达标排放为目的,导致废液中大量的氯化钠、氯化钙等流失,造成环境污染的同时也浪费了资源[4-6]。目前氨碱废液高效利用的方法虽然很多,但是仍存在能耗高、后处理困难、成本高等问题[7-12]。
基于此,本文针对内蒙古吉兰泰盐湖所面临的技术难题,以硫酸钙反应动力学和结晶动力学为基础,深入探讨氨碱废液与蒸馏水混兑及溶采二层盐的反应机制,确定氨碱废液混兑比例对液体盐中SO42-和Ca2+浓度的影响规律,为氨碱废液中化学资源的综合利用和高纯度纯碱用液体盐的可控制备提供基础数据。
1 实验部分
1.1 实验材料
实验过程中所用的二层盐来自内蒙古兰太实业有限公司制盐分厂液体盐工段,氨碱废液取自吉兰泰氨碱厂,二层盐及氨碱废液组成分别如表1和表2所示。

表1 二层盐化学组成Table 1 Chemical composition of two-layer salt %

表2 氨碱废液化学组成Table 2 Chemical composition of ammonia alkali waste liquid g/L
1.2 实验方法
1.2.1 拉曼在线监测反应速率
通过RXN2-HYBRID型拉曼光谱仪在线监测CaCl2和Na2SO4在水溶液中的反应速率,控制反应温度为25℃、搅拌速率为300 r/min、钙离子与硫酸根物质的量比为1∶1。通过拉曼光谱特征峰强度的变化,探究反应物和生成物浓度随时间的变化规律。
1.2.2 二层盐饱和卤水混配氨碱废液制备液体盐
以蒸馏水溶解过量二层盐,通过机械搅拌加快二层盐溶解速率,卤水饱和后经沉降、过滤进行不溶物分离,即得到二层盐饱和卤水,通过混配氨碱废液去除卤水中的硫酸根,考察反应时间和搅拌速率等因素对卤水中硫酸根和钙离子浓度的影响规律。除硫酸根后的卤水经沉降处理后得到液体盐,分析其化学组成。工艺流程如图1所示。

图1 饱和二层盐卤水加氨碱废液制备液体盐过程Fig.1 Process of preparing liquid salt by the reaction of saturated two-layer salt brine and ammonia alkali waste liquid
1.2.3 氨碱废液混配蒸馏水后直接溶采二层盐制备液体盐
根据二层盐饱和卤水混配氨碱废液制备液体盐实验提供的数据,将氨碱废液与蒸馏水进行混兑,通过机械搅拌获得均匀稀释的氨碱废液,然后向其中加入二层盐,考察不同氨碱废液与蒸馏水的混兑比例对卤水中硫酸根和钙离子浓度的影响规律。通过该工艺得到饱和卤水并分析其化学组成。工艺流程如图2所示。
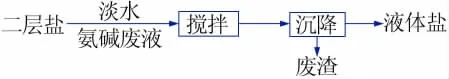
图2 蒸馏水与氨碱废液混配溶采二层盐制备液体盐过程Fig.2 Process of mixing deionized water and ammonia alkali waste liquid and dissolving two layers of salt to prepare liquid salt
2 结果与讨论
2.1 硫酸钙反应速率在线监测
2.1.1 Na2SO4和CaSO4·2H2O在水溶液中的拉曼特征峰
使用拉曼光谱仪分别对Na2SO4水溶液和CaSO4·2H2O的水溶液中悬浮固相进行离线测试,得到其拉曼谱图如图3所示。

图3 硫酸钠和二水硫酸钙的拉曼谱图Fig.3 Raman spectra of sodium sulfate and calcium sulfate dihydrate
分析Na2SO4和CaSO4·2H2O的拉曼谱图可知,Na2SO4的特征峰在981 cm-1处,CaSO4·2H2O的特征峰在1 008 cm-1处,通过拉曼光谱可以有效区分反应物和反应产物。
2.1.2 在线监测硫酸钙的反应过程
拉曼光谱特征峰强度的变化可以反映物质浓度的变化规律,结果见图4。由图4可知,反应体系中Na2SO4浓度随反应的不断进行缓慢降低,当反应时间超过30 min后,Na2SO4浓度随时间的变化较小;当反应时间超过60 min后,Na2SO4浓度逐渐降为0且不再发生变化,说明Na2SO4已完全反应。同时,CaSO4·2H2O拉曼特征峰强度从0逐渐升高,反应前10 min,其特征峰强度维持在0处不变,在10 min后,CaSO4·2H2O的特征峰强度开始增加,说明CaSO4·2H2O不断结晶析出,当反应时间超过60 min后,其特征峰强度保持在最大值不再发生变化。

图4 在线拉曼监测反应过程中物质的变化趋势Fig.4 Change trend of substances during the online Raman monitoring reaction process
由反应物Na2SO4和反应产物CaSO4·2H2O的质量浓度随时间的变化趋势可知:CaSO4·2H2O的结晶过程中反应速率小于其结晶速率,且结晶与反应几乎同时终止,反应过程是该过程的速率控制的关键步骤。
2.2 饱和二层盐卤水混配氨碱废液制备液体盐
2.2.1 搅拌速率对液体盐化学纯度的影响
根据在线拉曼测定的结果,10 min的时候液相中硫酸根含量已经有明显的减少,因此,该实验研究了25℃、饱和二层盐卤水中硫酸根与氨碱废液中钙离子的物质的量比为1∶1、选取反应时间在10 min条件下,不同搅拌速率对SO42-去除率的影响,其实验结果如表3所示。由表3可知,相同反应温度、反应时间以及氨碱废液与饱和卤水混兑比例下,当搅拌速率为120~300 r/min时,液体盐中硫酸根去除率随搅拌速率增大而增高。这是因为搅拌速率越大,氨碱废液与饱和卤水混合越均匀,分子之间的碰撞机会增大,加速了硫酸根和钙离子的反应进程。因此,搅拌速率越大硫酸根去除效果越好。

表3 搅拌速率对SO42-去除率的影响Table 3 Effect of stirring rate on SO42-removal rate
试验结果中的离子含量分析采用标准QB/T 1879—2001《液体盐》,该标准中优级液体盐的NaCl含量大于290 g/L,SO42-含量低于5 g/L,Ca2+含量低于2 g/L。反应时间和搅拌速率分别为10 min、300 r/min时,溶液中SO42-含量最低,说明该条件下SO42-与Ca2+的反应速率较快且硫酸钙的结晶速率及其沉降速率也较为理想,此时液体盐中SO42-质量浓度降至4.39 g/L。
2.2.2 反应时间对液体盐化学纯度的影响
通过在线拉曼提供的数据,该实验在彻底平衡时,需要的时间大于1 h,因此,实验研究了25℃、SO42-与Ca2+的物质的量比为1∶1、搅拌速率为300 r/min条件下,不同反应时间对SO42-去除率的影响,结果如表4所示。
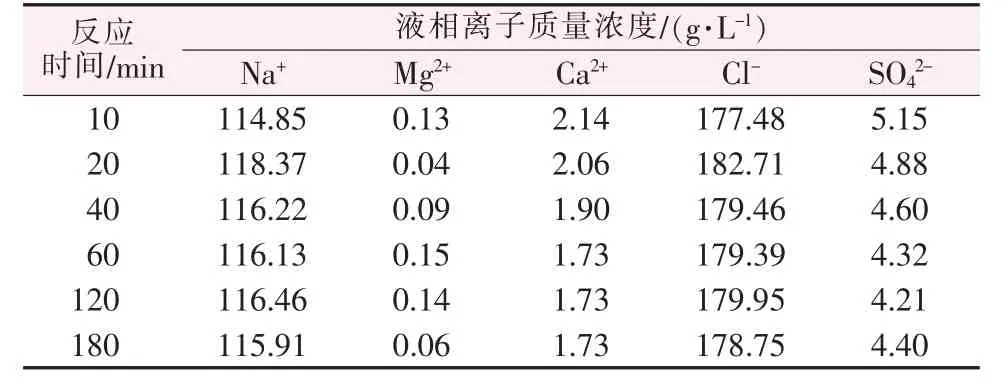
表4 反应时间对SO42-去除率的影响Table 4 Effect of reaction time on SO42-removal rate
由表4可知,SO42-在溶液中的含量随反应时间延长逐渐降低。当反应时间增加至180 min时,硫酸根浓度略有增加。这是因为反应时间更长之后,SO42-与Ca2+反应趋于平衡,该卤水体系达到新的水盐平衡状态,硫酸根浓度趋于饱和从而其浓度上升。反应时间在60~120 min时,液体盐中各离子含量变化基本不大,反应时间为120 min时,液体盐中SO42-含量为4.21 g/L。
2.3 氨碱废液混配蒸馏水后直接溶采二层盐制备液体盐
2.3.1 蒸馏水与氨碱废液的比例对液体盐品质的影响
通过饱和二层盐卤水混配氨碱废液制备液体盐的实验数据,该实验研究了25℃、搅拌速率为300 r/min、反应时间为120 min时,通过调控不同蒸馏水与氨碱废液体积比,得到硫酸根和钙离子物质的量比分别为1.00∶1、1.10∶1、1.20∶1、1.30∶1、1.40∶1、1.50∶1的盐溶液,考察在溶采二层盐实验中硫酸根含量的影响。实验结果如表5所示。由表5可知,随蒸馏水所占体积比的增加,SO42-含量增加,而Ca2+含量下降。蒸馏水和氨碱废液混兑体积比为(4.96~5.43)∶1时,得到的二层盐饱和卤水中Ca2+含量大于2 g/L,即氨碱废液的用量偏高;蒸馏水与氨碱废液混兑体积比为(5.55~7.13)∶1时,得到的二层盐饱和卤水中Ca2+含量与SO42-含量均达到优级液体盐标准。

表5 蒸馏水与氨碱废液体积比对制备液体盐的影响Table 5 Effect of the volume ratio of distilled water and ammonia alkali waste liquid on the preparation of liquid salt
2.3.2 两种工艺优劣对比分析
饱和卤水混配氨碱废液和混兑氨碱废液直接溶解二层盐这两种工艺都可以得到优级液体盐,但两种工艺各有优缺点。
蒸馏水溶解二层盐获得饱和卤水,并在每升卤水中加入0.116 2 L氨碱废液,搅拌速率为300 r/min,反应120 min,分离后可获得优级液体盐。该工艺优点是液体盐化学组成波动小,其缺点是氨碱废液中的蒸馏水无法充分利用,产品液体盐中NaCl浓度相对较低。该工艺如图5所示。

图5 氨碱废液处理饱和二层盐卤水制备液体盐生产工艺技术路线图Fig.5 Technical route map of the production process for preparing liquid salt by reacting ammonia-alkali waste liquid with saturated two-layer salt brine
使用混兑氨碱废液溶解二层盐工艺中,蒸馏水与 氨 碱 废 液 体 积 比 为(5.55~6.36)∶1,反 应 时 间 为120 min,搅拌速率为300 r/min,固液分离后获得液体盐。其优点是获得的液体盐浓度相对较高,Ca2+和SO42-含量相对较低,其缺点是混配误差等因素对获得的液体盐离子含量造成较大波动,因此通过进一步向其不合格产品中加入氨碱废液进行硫酸根深度处理,使其产品质量达到纯碱用液体盐标准,其工艺技术路线如图6所示。

图6 蒸馏水与氨碱废液混兑制备液体盐生产工艺技术路线图Fig.6 Technical route map of the production of liquid salt by mixing deionized water and ammonia-base waste liquid
3 结论
通过对CaSO4·2H2O反应结晶过程的在线监测以及以氨碱废液和吉兰泰盐湖二层盐为原料制备液体盐的不同工艺进行了研究,得到以下工艺参数及结论。
CaCl2和Na2SO4的反应速率 小于CaSO4·2H2O的结晶速率,结晶与反应几乎同时终止,反应过程是CaSO4·2H2O结晶过程的速率控制步骤。
在饱和二层盐卤水混配氨碱废液制备液体盐工艺中,随搅拌速率和反应时间的增加,硫酸根去除率增大。该工艺最佳转速为300 r/min,停留时间为120 min,该工艺生产液体盐中各离子含量符合制碱用液体盐标准,但获得的液体盐NaCl浓度相对较低。
氨碱废液混配蒸馏水后直接溶采二层盐制备液体盐工艺中,随着氨碱废液比例的增加,液体盐中硫酸根含量逐渐降低。该工艺的最佳条件是蒸馏水与氨碱废液体积比为(5.55~6.36)∶1,反应时间为120 min,搅拌速率为300 r/min,该生产工艺产品中各离子含量符合优级液体盐标准,NaCl近饱和。
