溶胶-凝胶法制备氧化硅-氧化铝体系凝胶及合成过程研究进展
2021-08-12聂轶苗刘攀攀刘淑贤王迎春翟培鑫刘朔宇
夏 淼,聂轶苗,刘攀攀,王 玲,刘淑贤,王 森,王迎春,翟培鑫,刘朔宇
(华北理工大学矿业工程学院,河北唐山063210)
矿物聚合材料是一类新型碱激发胶凝材料,由于其制备工艺简单、能耗低、性能优异[1]且多以工业固体废弃物作原料,故引起广泛关注[2-4]。利用粉煤灰制备矿物聚合材料是对粉煤灰绿色综合利用的有效途径之一,但因其原料的复杂性及产品的收缩率较大且有返霜现象[5]等不确定性问题的存在,导致粉煤灰基矿物聚合材料未能被大规模应用,而这些问题与其反应机理尚不明确密切相关。在粉煤灰制备矿物聚合材料反应机理的研究中,由于各种粉煤灰来源不同,其化学成分和物相组成差异较大[6],使其反应机理研究的难度系数增大。
目前对于粉煤灰基矿物聚合材料反应机理的研究多采用3种方式进行:1)对粉煤灰基矿物聚合材料进行力学性能(抗压强度和抗折强度)的测试[7],间接推测反应过程;2)研究粉煤灰在碱性条件下的溶出特性[8],以此来对粉煤灰中的活性成分及含量进行定量分析;3)人工合成制备纯度较高的SiO2-Al2O3粉末[9]替代复杂的粉煤灰原料,主要研究硅、铝两种元素的变化情况。由于SiO2-Al2O3粉末煅烧后具有与偏高岭土相似的结构[10],也有一定的碱激发活性,而且这种合成粉体的纯度、成分、性能人工可调节范围大。因此通过借鉴对合成粉体的结构与性能的研究结果,对粉煤灰基矿物聚合材料的合成机理进行类似的过程判断和机理分析,是一种有效的研究思路。
在研究SiO2-Al2O3粉体的合成时,可参考SiO2-Al2O3凝胶的合成及其有关性能与机理方面的研究成果。因二者制备过程相似,且对SiO2-Al2O3凝胶合成工艺和性能的要求更为严苛,同时国内外对SiO2-Al2O3凝胶的研究也相对深入。因此,本文通过对SiO2-Al2O3凝胶研究现状进行综述的基础上,为SiO2-Al2O3粉体的合成提供实验指导和理论数据。
1 溶胶-凝胶法制备SiO2-Al2O3体系凝胶的工艺过程及基本原理
溶胶是一种热力学不稳定的分散体系,其溶质多为1~100 nm的固体颗粒,在液体溶剂中不停地进行布朗运动。在温度改变、有外力作用(搅拌)、化学反应等影响下失去部分溶剂,使得体系黏度增大,进而形成具有一定强度的凝胶。凝胶的分类有很多种[11],若溶剂为气体时,称为气凝胶,若气凝胶是采用非超临界干燥法制得的,又称为干凝胶。
常用的制备凝胶的方法有溶胶-凝胶法、固相合成法、化学共沉淀法等,其中溶胶-凝胶法应用广泛,原因是该法所需设备简单、过程易于控制、合成及烧结温度较低,且制备的凝胶材料组分均匀、产品纯度较高[11]。
1.1 SiO2-Al2O3体系凝胶的制备工艺过程
SiO2-Al2O3体系凝胶包括纯SiO2凝胶、纯Al2O3凝胶以及SiO2-Al2O3复合凝胶。SiO2凝胶是由有机醇硅盐或无机硅盐,在酸性或碱性条件下发生水解生成SiO2溶胶,而后在碱性条件下缩聚成湿凝胶,再老化干燥得干凝胶,最后煅烧得到相应的材料,流程如图1所示,图中硅前驱体为硅源原料。
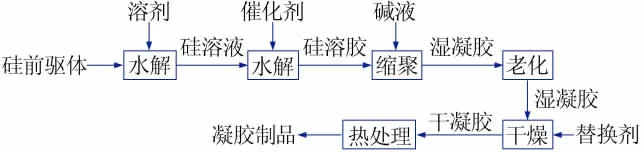
图1 SiO2凝胶制备工艺流程图Fig.1 Process flow diagram of preparation of SiO2 gel
Al2O3凝胶主要以有机醇铝盐或无机铝盐为原料,酸性条件下水解成溶胶,碱性条件下缩聚成湿凝胶,再老化干燥得干凝胶,最后煅烧得相应制品材料,其制备过程与图1相似。
由于SiO2-Al2O3复合凝胶具有单一的SiO2或Al2O3凝胶所不具有的优良性能,如SiO2的加入可提高Al2O3凝胶的α-Al2O3相转变温度[12]进而改善其性能等。SiO2-Al2O3复合凝胶是先分别制备SiO2溶胶和Al2O3溶胶,再按一定比例混合均匀,在碱性环境中缩聚,然后老化、干燥、煅烧而成。图2为分别以TEOS(硅酸乙酯)为硅源、以有机醇铝源为铝源制备SiO2-Al2O3复合凝胶的工艺流程。
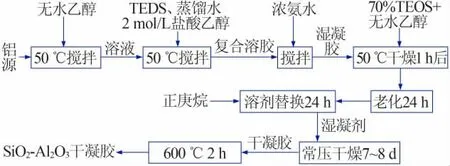
图2 SiO2-Al2O3复合凝胶的制备工艺流程图Fig.2 Process flow diagram of SiO2-Al2O3composite gel
1.2 SiO2-Al2O3体系凝胶形成的基本原理
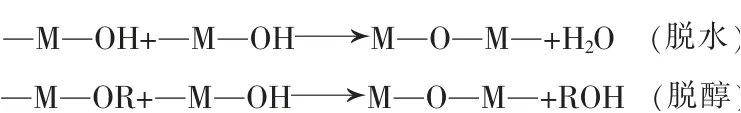
一般认为,SiO2-Al2O3体系凝胶的形成主要有两个关键步骤,第一是前驱体的水解,第二是水解产物发生缩聚,其反应过程及化学方程式如下:
首先,前驱体电离或与水反应(M为前驱体中金属阳离子,z为M离子的价数,—OR为有机基团,n和x表示基团数目)。

然后,脱水或脱醇缩聚:
2 溶胶-凝胶法制备SiO2-Al2O3体系凝胶的影响因素及规律
采用溶胶-凝胶法制备SiO2-Al2O3体系凝胶的工艺过程与最终材料制品的性能要求有关,但基本过程如图2所示,其中涉及的实验因素较多,现对主要影响因素进行分别说明。
2.1 不同的硅源、铝源前驱体对SiO2-Al2O3体系凝胶合成及结构性能的影响
前驱体是SiO2-Al2O3体系凝胶合成的重要参数之一[13],不同铝源、硅源,由于本身结构不同,水解过程和最终形成的水解产物不同,会对由其制备的制品或材料造成不同的影响。
硅源前驱体主要采用有机硅醇盐,如正硅酸甲酯(TMOS)和正硅酸乙酯(TEOS)等,因其易溶于普通有机溶剂中,形成高纯度、高分散的均匀溶液[14],常用作制备凝胶体系的有机硅源。但由于TMOS有毒,故优选TEOS作硅源。其他一些廉价的化学试剂,如水玻璃、多聚硅氧烷(E40)作为硅源制得的材料性能相对较差,还需深入研究。
在SiO2-Al2O3体系凝胶合成过程中,TEOS需先水解生成硅酸和乙醇,硅酸之间或硅酸与未完全水解的TEOS之间缩聚成低聚合物,低聚合物继续聚合形成具有三维网状结构的高聚物[15]。由TEOS水解相对速率与溶液pH关系图(图3)[16]可知,当溶液pH在0~7~10变动时,随着pH的增加,TEOS水解相对速率呈现先减小后增大的趋势。当溶液pH=7时,TEOS水解相对速率最小。由此可见,TEOS在酸性和碱性条件下均能发生水解,但在不同条件下,TEOS水解所得前驱体的聚合程度和形态不同,陈彦广等[17]研究了不同pH(pH=1~10)条件下TEOS水解后合成的ZSM-5分子筛,结果表明,碱性(pH=10)条件下,合成的分子筛晶粒近似六方形片状结构,粒径为200~700 nm且大小不均匀,而在酸性(硫酸溶液,pH=2)条件下合成的分子筛晶粒近似规则的椭圆形片状结构,粒径在200 nm左右,且大小较为均匀。分析原因认为,TEOS在碱性介质中,水解速率小于聚合速率,易形成短链交联结构,在酸性介质中,聚合速率小于水解速率,易形成三维笼状[18]。
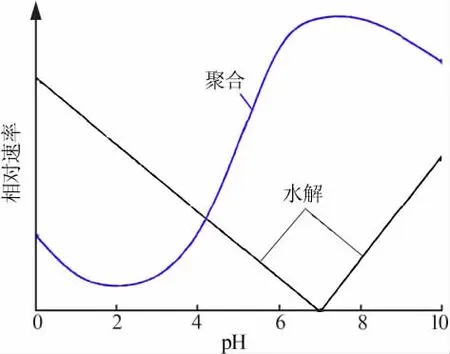
图3 TEOS水解和聚合反应相对速率与pH的关系[16]Fig.3 Relationship between pH and relative velocity of TEOS hydrolyzed and gathered[16]
常见铝源有两大类,有机铝源和无机铝源。常用的有机铝源为有机铝醇盐,如异丙醇铝(AIP)和仲丁醇铝(ASB)。Al2O3凝胶制备过程中添加有机铝醇盐后多采用乙酰乙酸乙酯、乙酰丙酮等螯合剂控制铝源水解速度,冰醋酸等有机酸为催化剂,甲醇为分散剂,溶解到乙醇和水的混合溶剂中,控制水解温度为50~80℃,由此制备的Al2O3凝胶纯度高、孔隙分布均匀[19]。由于Al2O3凝胶具有高化学活性,特别是其中的二聚物和寡聚单元的存在,极易与水反应生成具有3个羟基结构且难溶于乙醇的拜耳石相Al(OH)3。同时由于其干燥过程中的吸湿特性[20],很难获得块状、稳定的高孔隙度凝胶[21],再加上有机醇盐价格较高,制备凝胶工艺复杂,因此,价格低廉、操作简单的无机铝盐更易受到研究者的青睐。常用无机铝源主要为Al(NO3)3·9H2O和AlCl3·6H2O。无机铝盐多以乙醇和水为溶剂、环氧丙烷为凝胶助剂,即可得到Al2O3溶胶。其中,Al(NO3)3·9H2O作铝源所得凝胶为球形颗粒且相互堆积,以AlCl3·6H2O为铝源制备的凝胶为针状颗粒且相互搭接。两种无机铝盐制备的Al2O3凝胶颗粒形貌不同主要与氯离子和硝 酸 根 的 电 负 性 差 异[19,22]有 关,前 者 表 现 为 非 配 位性,不参与胶体粒子形成过程,后者具有弱配位性,会参与到水解和聚合过程中。但无机铝盐不能通过自身发生水解-缩聚反应,需要外加有机环氧化物[13]作催化剂,增加无机铝盐水解和聚合过程的可控性,所制备的溶胶更稳定,但性能不及有机铝源所制备的Al2O3凝胶。
将SiO2溶胶和Al2O3溶胶按比例混合制备SiO2-Al2O3复合凝胶时,由于每种前驱体的水解速度不同,因此需先配制水解速度慢的,待均匀稳定后再混合,可以避免在凝胶前产生沉淀[23]或组分的偏析[24],导致溶液生成不均匀的溶胶,影响最终的材料或制品性能。
除了使用单一的硅源制备SiO2-Al2O3体系凝胶材料外,还可以同时使用两种不同可水解基团的硅氧烷作前驱体,制备柔韧性和回弹性更加优异的凝胶材料[25]。但是由于此类前驱体种类繁多,任意两种前驱体相互作用可能会形成不同性能的凝胶,所以需要针对性地进行实验研究。
2.2 pH对SiO2-Al2O3体系凝胶合成及结构性能的影响
由于不同种类的硅、铝前驱体在不同pH溶液中发生水解和缩聚的反应速率不同,因而溶液pH对SiO2-Al2O3体系凝胶的合成及性能影响很大[13]。
常用硅源TEOS在酸性或碱性条件下均能水解,一般认为,酸有助水解,碱有助聚合[13,26]。在酸性条件下TEOS水解成线型SiO2溶胶[27],并形成多分支弱交联的聚合物凝胶,但稳定性较差;在碱性水解剂作用下,易形成相对致密的球形SiO2溶胶,稳定性较好[28]。在SiO2-Al2O3复合凝胶合成时,铝源和硅源只有在强碱性条件下,才能缩聚形成类沸石结构[17],所以可采用一步法,即在碱性条件下,完成水解和缩聚反应;也可采用酸碱两步法,在酸性条件下分别水解得到硅、铝溶胶,然后在碱性条件下混合缩聚。酸性条件下进行硅源水解时,催化剂可用硝酸[12,16]、硫酸[17]、盐酸 乙醇[23]、盐酸[24,29-30]、HF[23]、醋酸[19]等,溶剂为甲醇、乙醇和丙酮,乙醇最为常用。中性条件下,可用尿素[27]催化TEOS水解。碱性条件下硅源和铝源前驱体的水解和缩聚反应,一般采用氨水作催化剂。
各种不同pH的溶液中,TEOS水解速率和产物不尽相同,水解后生成凝胶的凝结时间、所得材料结构及其性能也各不相同[17,31]。但目前对具体实验中pH的确定,需根据最终材料的性能要求来进行反向实验研究确定,这方面的理论研究还比较缺乏,特别是对水解产物结构和成分的直接研究,鲜见报道。
另外,OH-的浓度及其加入方式对SiO2-Al2O3体系凝胶的合成影响也比较大。丛培源[32]采用氨水、碳酸铵和尿素研究了OH-的引入对莫来石粉体的影响,结果表明,高浓度氨水(水与氨水的体积比为1∶1)滴加,容易造成局部碱度过高,铝离子偏析,形成AlOOH沉淀,而采用低浓度(水与氨水的体积比为5∶1)氨水时,没有AlOOH沉淀;以碳酸铵形式引入OH-,有利于铝离子进入Si—O—Si—O网络结构中,形成Si—O—Al—O结构;尿素用量低(尿素与Al3+物质的量比为2∶1)时,释放出的OH-有利于铝离子进入Si—O—Si—O网络,直接形成莫来石;尿素用量高(尿素与Al3+物质的量比为8∶1)时,溶胶中出现富铝和富硅区,热处理时,首先生成尖晶石。
2.3 不同原料配比对SiO2-Al2O3体系凝胶合成及结构性能的影响
在SiO2-Al2O3体系凝胶的合成中,除了硅源和铝源前驱体的选取及对应溶液的pH需要考虑外,还有一些因素也会影响凝胶的结构和性能,如SiO2-Al2O3体系中的Si与Al物质的量比、水和无水乙醇的用量、催化剂的种类及用量等实验因素,在进行SiO2-Al2O3体系凝胶的合成之前,需研究这些因素对所得凝胶结构及性能的影响规律。
2.3.1 Si与Al物质的量比对SiO2-Al2O3体系凝胶合成及结构性能的影响
在SiO2-Al2O3复合凝胶合成时,将两种溶胶(铝溶胶和硅溶胶)混合的同时可催化溶胶的凝胶化进程,其中硅、铝溶胶含量的多寡,直接影响凝胶的物理性质[31],进而影响最终产品的性能。
首先将铝溶胶加入到硅溶胶中,复合溶胶的凝胶时间大幅缩短,当Si与Al物质的量比为10∶1、7∶1逐渐降低至5∶1、4∶1时,胶凝时间逐渐减小[31],凝胶密度也逐渐降低(凝胶的密度则可通过配制溶液时所用原料体积进行理论计算)[31-33]。一方面因为随着铝溶胶的加入致使溶液中SiO2溶胶含量相对降低,当混合溶胶中以Al—OH结构为主时,缩聚反应速率加快[24]。另一方面,由于实验制备的SiO2溶胶乙醇含量低于Al2O3溶胶,因此,当Al2O3溶胶比例增加时,单位体积的混合溶胶中SiO2和Al2O3浓度变小,最终所得凝胶的密度也变小。同时随着Al含量的增加(Si与Al物质的量比为1∶3、1∶4、1∶6、1∶12逐渐变小),湿凝胶的颜色由浑浊逐渐变为澄清[33]。总之,随着铝溶胶的加入,复合凝胶的凝胶时间、密度、颜色等基本性质均发生不同程度的改变。
将SiO2溶胶加入到Al2O3溶胶时,复合凝胶的结构和性能随加入量逐渐改变。随着硅含量逐渐增加,体系中Al—OH的对称、反对称伸缩振动、组合振动及反对称形变振动均出现减弱现象,甚至在硅质量分数为10.6%[24]时基本消失;Al—O振动峰向高频方向偏移,这是由于SiO2溶胶中存在Si—OH基团,与Al2O3溶胶中Al—OH作用生成氢键并发生缩聚,形成Al—O—Si的缘故。同时,SiO2-Al2O3复合凝胶的相转变温度和比表面积均有不同程度的提高[24],其形貌也由针叶状或长条状逐渐变为球状。
由于选取的硅源和铝源、制备工艺(如干燥)以及最终制备的材料性能侧重点各不相同,考核指标也各不相同,最终得到优化条件时的Si与Al物质的量比也有所不同,如以比表面积为考核指标,有学者分别在Si与Al物质的量比为1∶3[34]、1∶4[16]及w(Si)=13.3%[24]时,得到比表面积较大的凝胶,因此,还需要在弄清楚其反应机理的基础上进行相应的Si与Al物质的量比配制。
2.3.2 溶剂的种类和水的用量对SiO2-Al2O3体系凝胶合成的影响
溶剂种类的选择对SiO2-Al2O3体系凝胶的合成也很重要,一般选择乙醇作TEOS和无机铝源的溶剂,有机铝源则多选择相应的醇作溶剂[35],如异丙醇选作异丙醇铝的溶剂。
溶剂的作用主要是对反应物进行溶解,适量的乙醇可加快TEOS的水解反应速度,但当乙醇过量时,其本身的羟基会与TEOS水解生成的羟基发生缩聚反应,抑制TEOS的水解[17],因此乙醇的用量需要确定在合理的范围,在实验中,TEOS与无水乙醇的物质的量比取值有1∶4[11]、1∶5[24]、1∶7[23]等。
水是SiO2-Al2O3体系凝胶合成时所需的反应物之一,同时具有部分溶剂作用,其含量对制备工艺和最终材料的性能具有重大影响[27],当水的用量太多或太少时,凝胶在干燥过程中收缩率均会增大,进而影响其密度等凝胶物理性质,一般取水与TEOS物质的量比为(4~6)∶1;对铝源来说,水太少铝源水解不充分,水太多导致不能凝胶或凝胶不完全,因此,一般水与铝源的物质的量比为(25~100)∶1。当水含量低时,可以考虑通过调节水含量来调控铝硅酸盐的水解反应[33]。
2.3.3 环氧丙烷用量对SiO2-Al2O3体系凝胶合成的影响
作为网络凝胶诱导剂的环氧丙烷(PO)对凝胶时间起着主导作用[33],其促凝机理主要是吸收溶胶中羟基聚合铝离子和氢离子等质子,同时由于PO受到氯离子攻击,发生不可逆转的开环反应,使水合羟基聚合铝离子内的羟基脱水聚合生成羟基氧化铝低聚体,促进溶胶体系的pH均匀缓慢地增长,进而促进反应粒子的水解、缩聚及最终三维骨架的形成。因而,随着PO用量增加,凝胶时间缩短。当PO用量过少时,水解和缩聚反应速率都较小,凝胶时间较长,甚至无法形成完整凝胶,即使生成凝胶也主要以链状形式聚合,使溶胶内部结构强度减弱,导致最终材料的收缩率增大;而PO用量过多,则会导致溶胶pH增长过快,硅、铝结构发生团聚甚至沉淀,一般取PO与铝源原料的物质的量比为3∶1[36]、2∶1[33]等。
2.3.4 其他原料添加的影响
在SiO2-Al2O3体系凝胶合成过程中,有时会通过引入纤维[30]、纳米颗粒[37]或螯合剂[38],采用有机硅氧烷等前驱体等方式[25],使最终产品材料具有高透过性、足够稳定性等性能。
2.4 干燥方式对SiO2-Al2O3体系凝胶合成及结构性能的影响
SiO2-Al2O3体系凝胶的干燥工艺是其制备过程中的重要一环,也是较为困难的一步[13],其目的是在不影响凝胶的三维网络结构的前提下,将三维孔洞中的溶剂排出。如果采用直接干燥,由于气液界面产生的表面张力会破坏凝胶的网络结构,因此一般采用超临界干燥,即利用一定温度和压力,使溶剂转变成一种介于液态和气态之间的特殊状态,溶剂界面张力消失从孔洞排出。但采用这种干燥方式,常涉及高温高压,具有一定的危险性,现在有不少学者采用常压干燥,即通过老化、溶剂置换、表面改性和常压干燥等一系列工序进行处理。所谓老化就是利用表面张力低的溶剂[14]对凝胶进行浸泡,置换出凝胶孔洞中原来表面张力大的溶剂,避免干燥过程中凝胶的收缩,从而增强凝胶的骨架结构。表面改性则是通过加入或包覆一些物质,消除骨架上的—OH,避免因相邻—OH脱水缩聚导致开裂,影响凝胶性能。
老化所用溶剂多为乙醇,老化时间为24~36 h,置换溶剂的种类、用量(或浓度)及置换时间需依据湿凝胶质量变化趋势确定,如正庚烷、正己烷24 h[31]等。
3 SiO2-Al2O3体系凝胶的合成过程研究进展
对于SiO2-Al2O3体系凝胶合成的考核指标,常用的有胶凝时间、颗粒大小、比表面积、强度、收缩率、隔热系数等定量指标,同时还有凝胶形貌(是否开裂、颜色是否透明等)等定性指标,综合考虑以确定实验工艺条件。这些考核指标是由最终产品性能或应用领域来决定的。该体系凝胶的生成机理,目前比较认可的是水解-缩聚两个关键环节,其中有关水解过程中硅源和铝源的物相、结构变化及产物等,学者们做了大量研究工作,主要通过X射线衍射(XRD)分析物相变化、红外光谱分析(IR)研究物相结构变化、核磁共振(NMR)进行硅的聚合度和铝的配位研究,同时结合扫描电镜(SEM)和透射电镜(TEM)进行形貌和组织结构等观察。
一般认为,硅源TEOS无论在酸性还是碱性水解剂作用下,均生成SiO2溶胶[27],只是形态有所不同。随着对SiO2凝胶煅烧温度升高,红外光谱图中Si—OH振动峰逐渐消失,生成Si—O—Si键,煅烧温度再升高时此处峰发生“蓝移”,说明发生缩聚反应[14]。但此时1 100 cm-1处峰仍为单峰,所以,此处还需深入研究其呈现单峰的原因。有机和无机铝源制备的Al2O3溶胶都以勃姆石形式存在,即γ-AlOOH,经过1 200℃煅烧其物相组成经过γ-Al2O3、δ-Al2O3、θ-Al2O3的非晶相变化过程,最后转变为较稳定的α-Al2O3晶相,同时对应的差热曲线上会出现一系列对应的放热峰[21]。
随着硅含量的逐渐增加,SiO2-Al2O3复合凝胶的物相、铝的配位状况均发生改变。复合凝胶中物相由多晶勃姆石逐渐向无定形SiO2过渡,原来Al2O3凝胶中θ-Al2O3物相IR谱峰强度逐渐变弱,当硅含量为17.3%(质量分数)时θ-Al2O3消失[24],说明SiO2溶胶中Si—OH基团与Al2O3溶胶中Al—OH结构作用形成Al—O—Si[14,39]。煅烧后,该峰的强度增大[18];同 时,Al—O吸 收 峰 消 失,4次 配 位Al—O振动峰发生“蓝移”,这是由于Si代H形成Al-O-Si的缘故[24],而6次配位的Al—O吸收峰也在逐渐增强。有分析认为是此处与Si—O—Si峰值重合的缘故[24],具体原因可以结合核磁共振谱图进行详细分析,只是未见有报道。
随着铝含量的增加,960 cm-1处Si—OH振动峰、800 cm-1和460 cm-1处环状结构的Si—O—Si键峰[23]强度均呈现逐渐降低趋势,说明Si—O—Al键逐渐增多。煅烧温度为50℃和100℃时,6次配位Al—O振动峰(640 cm-1)发 生“红移”,这 是由Si—O—Al成键后Si原子较强的给电子能力所导致[40]。4次配位Al—O振动峰只出现在煅烧温度为300℃及以上的试样中,这可能是由于随着吸附水和结构水的脱除,部分6次配位的Al—O转化为4次配位,导致剩余6次配位Al—O结构张力得以释放,振动峰向高波数移动[41]。
以上分析研究表明,在SiO2-Al2O3体系凝胶形成的过程中,确实发生了水解和缩聚反应,且有Si—O—Al键生成,即部分铝呈铝氧四面体形式存在。这些结论从红外光谱分析中可以得出,只是缺乏定量性描述,如铝发生改变的具体比例、影响其改变的原因及改变程度的关系等。对于水解和缩聚反应的动力学问题,只是以凝胶黏度变化率结合原子力显 微 镜 等 手 段 进 行 了 探 讨 性 研 究 工 作[40,42],还 需 要深入研究。
4 存在问题及展望
目前对于SiO2-Al2O3体系凝胶的合成与对应材料制备的研究比较深入,其中影响因素及其影响规律的研究也比较细致,但仍存在一些问题,需要进一步深入研究:1)主要元素含量的影响规律研究范畴比较窄,在SiO2-Al2O3体系凝胶中,有时不可避免地引入其他碱金属或碱土金属离子,如K+、Na+、Ca2+,而这些离子对SiO2-Al2O3体系凝胶的影响不明。因此,在后续的研究中,需对不同碱金属或碱土金属离子的影响规律进行研究,通过控制不同离子的浓度,对所合成凝胶的物理性质进行观察,研究其结构变化规律和聚合度变化情况。只有将这些影响因素及影响规律研究透彻,才可能对SiO2-Al2O3体系凝胶的合成及结构与性能把握更加全面;2)对于SiO2-Al2O3体系凝胶形成过程有定性描述,但是缺乏定量描述的精确实验数据,如随着硅溶胶加入铝溶胶中,铝配位数发生改变的比例,以及铝配位数的改变对凝胶结构及性能的影响程度。
虽然在SiO2-Al2O3体系凝胶现有研究中存在一些问题,但该体系凝胶的优异性能毋庸置疑,未来的研究方向可以构建SiO2-Al2O3体系凝胶成分-结构-性能关系模型,通过各种分析方法对其性能进行检测,为SiO2-Al2O3体系凝胶的结构、性能设计提供基础数据。随着对该体系凝胶制备流程的优化研究、凝胶制备的精准控制与设计等工作的深入,必将为此体系凝胶材料本身的应用和发展带来广阔前景,同时带动碱激发胶凝材料,特别是与其相似性更高的粉煤灰基碱激发胶凝材料等相关领域的快速发展,为扩大粉煤灰的应用范畴并提高其利用率奠定基础,为国民经济发展贡献力量。
