颅脑损伤患者血清IL-6、β2-MG和D-D水平与脑水肿的相关性分析
2021-08-12王悠杨璐
王悠,杨璐
(四川大学华西医院创伤医学中心,四川 成都 610041)
颅脑损伤为神经外科常见疾病,外伤冲击可致神经元胞体和轴索损伤,而病灶出血可致局部毒性物质堆积,加重血脑屏障损伤,从而继发脑水肿,导致颅内高压、脑疝形成,威胁患者生命健康[1-2]。白细胞介素-6(interleukin-6,IL-6)是参与中枢介导、神经修复等生理过程的重要炎症因子[3]。β2微球蛋白(β2-microglobulin,β2-MG)是由淋巴细胞、血小板、多形核白细胞产生的一种低分子量血清球蛋白,正常情况下合成与释放保持稳定,颅脑损伤患者缺氧导致中枢神经系统受累,可引起血液中β2-MG水平升高[4]。D-二聚体(D-dimer,D-D)是反映机体高凝状态和激发纤溶亢进的敏感指标,已有研究[5]证实血清中D-D含量变化可反映脑组织损伤程度。本研究通过收集颅脑损伤伴脑水肿患者的临床资料,分析患者脑水肿程度及进展情况与损伤后血清IL-6、β2-MG、D-D水平的相关性。
1 资料与方法
1.1 一般资料
收集2018年1月至2019年12月因颅脑损伤于四川大学华西医院创伤医学中心住院治疗的106例患者的临床资料,将其纳入观察组,其中男性62例,女性44例;年龄18~76岁,平均(48.33±14.40)岁;格拉斯哥昏迷评分(Glasgow coma scale,GCS)3~15分,平均(7.40±2.15)分。纳入标准:(1)受伤时间<6 h;(2)经头颅CT检查明确脑水肿情况。排除标准:(1)受伤前有颅脑外伤、神经系统退行性疾病、脑卒中等病史;(2)伤后1周内死亡或失访者;(3)肝肾功能不全;(4)合并恶性肿瘤。另选取同期体检的100名正常健康志愿者作为对照组,其中男性55例,女性45例;年龄18~74岁,平均(47.20±15.27)岁。两组研究对象的性别、年龄分布比较,差异无统计学意义(P>0.05)。
1.2 脑水肿评估方法
观察组患者入院当日及入院后3 d、5 d、7 d分别行头颅CT检查,由两名高年资主治医生共同阅片,脑水肿体积=(脑水肿最大层面的长×宽×层/2)-(该层面血肿的长×宽×层/2)。
1.3 血清学指标检测
采集观察组患者入院当日及入院后3 d、5 d、7 d和对照组研究对象体检当日的清晨空腹静脉血5 mL,3 000 rpm离心10 min,分离血清-20 ℃保存送检。采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测血清IL-6水平,试剂盒购自美国R&D公司;采用放射免疫法检测血清β2-MG水平,试剂盒购自北京原子高科股份有限公司;采用免疫比浊法检测血清D-D水平,试剂盒购自安徽伊普诺康生物公司,操作均按照试剂盒说明书进行。
1.4 统计学分析
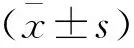
2 结果
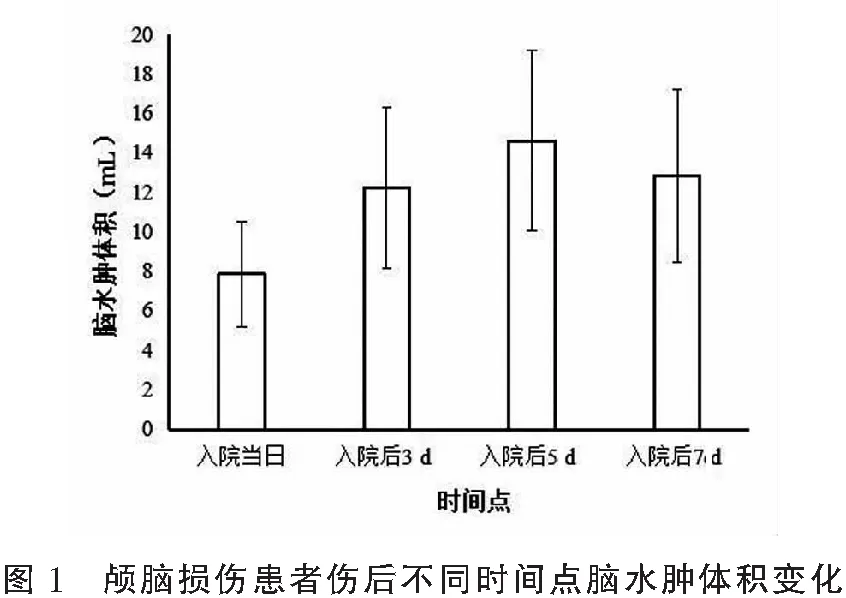
2.1 颅脑损伤患者伤后不同时间点脑水肿体积变化
观察组患者入院当日及入院后3 d、5 d、7 d的脑水肿体积分别为(7.86±2.67)mL、(12.22±4.08)mL、(14.63±4.62)mL、(12.83±4.40)mL,脑水肿体积从伤后持续升高,5 d时达高峰,然后逐渐下降。见图1。
2.2 颅脑损伤患者伤后不同时间点血清IL-6、β2-MG、D-D水平与对照组比较
观察组患者伤后不同时间点血清IL-6、β2-MG、D-D水平均高于对照组,差异有统计学意义(P<0.05);且观察组患者血清IL-6、β2-MG、D-D水平从伤后持续升高,到3 d时达至高峰,然后逐渐下降。见表1。
表1 颅脑损伤患者伤后不同时间点血清IL-6、β2-MG、D-D水平与对照组比较
2.3 颅脑损伤患者入院时血清IL-6、β2-MG、D-D水平与伤后不同时间点脑水肿体积的相关性分析
Pearson相关性分析显示,颅脑损伤患者入院时血清IL-6、β2-MG、D-D水平均与入院当日检测的脑水肿体积显著正相关(r=0.675、0.628、0.427,P<0.05);且入院时血清IL-6、β2-MG水平还与入院后3 d、5 d检测的脑水肿体积显著正相关(r=0.588、0.550、0.542、0.533,P<0.05)。见表2。
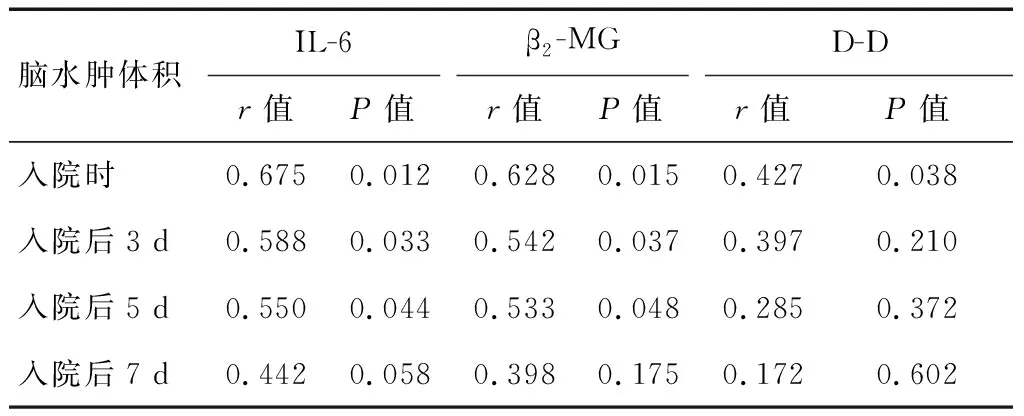
表2 颅脑损伤患者入院时血清IL-6、β2-MG、D-D水平与伤后不同时间点脑水肿体积的相关性分析
2.4 颅脑损伤患者入院时血清IL-6、β2-MG、D-D水平与脑水肿体积最大进展量的相关性分析
以颅脑损伤患者入院当日脑水肿体积作为最小值,以入院后5d达高峰时的脑水肿体积作为最大值,脑水肿体积最大进展量=最大值-最小值,其平均水平为(6.77±2.88)mL。Pearson相关性分析显示,颅脑损伤患者入院时血清IL-6水平与水肿体积最大进展量显著正相关(r=0.488,P<0.05);颅脑损伤患者入院时血清β2-MG、D-D水平与脑水肿体积最大进展量无显著相关性(P>0.05)。见表3。
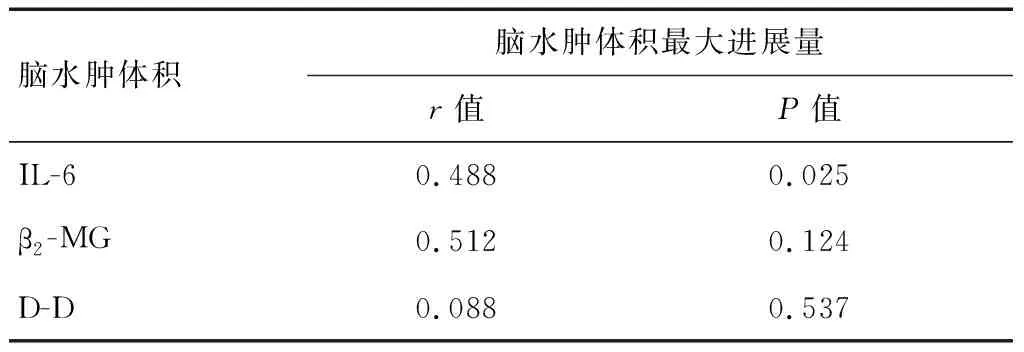
表3 颅脑损伤患者入院时血清IL-6、β2-MG、D-D水平与脑水肿体积最大进展量的相关性分析
3 讨论
脑水肿是颅脑损伤发生后神经系统的常见病变,会导致颅内压增高,引起脑移位和脑疝,是颅脑损伤患者致死和致残的主要原因[6]。目前,临床对于颅脑损伤后脑水肿的具体发病机制尚未明确,但炎症反应对与脑损伤后脑水肿的发生发展密切相关,已被临床证实[7]。
IL-6是具有广泛生物活性的重要炎症因子,其水平升高可趋化中性粒细胞募集,促进大量炎症介质释放,影响神经细胞修复,加重脑组织损伤[8]。β2-MG是细胞表面人类靶细胞抗原HLA中β链中的重要组成部位,可通过血小板、粒细胞和淋巴细胞释放,其水平变化与肾小球功能损伤、颅脑损伤等多种组织损伤密切相关[9]。D-D是反映纤维蛋白原降解的重要指标,其水平升高可反映微血栓形成,加重脑组织缺血低氧,促进脑组织缺血性改变[10]。
本研究发现,观察组患者伤后不同时间点血清IL-6、β2-MG、D-D水平均显著高于对照组,颅脑损伤患者入院时血清IL-6、β2-MG、D-D水平均与入院当日检测的脑水肿体积显著正相关,入院时血清IL-6、β2-MG水平还与入院后3 d、5 d检测的脑水肿体积显著正相关,提示IL-6、β2-MG、D-D水平可在一定程度上反映颅脑损伤患者的脑水肿体积,且与患者的脑水肿严重程度密切相关。分析其原因可能是:(1)炎症因子可通过增加血脑屏障通透性、诱发星形胶质细胞神经肿胀等方式,促进脑水肿的发生[11];(2)患者发生脑水肿时,机体会产生一系列应激反应,导致下丘脑-垂体-肾上腺轴功能障碍,引发神经-内分泌系统的异常变化,使肾素、抗利尿激素分泌增多,肾小球滤过率下降,从而使β2-MG水平升高[12-13];(3)正常生理状态下人体血液中凝血与抗凝系统处于动态平衡,当这种平衡被破坏后会激活凝血系统,使纤溶系统功能亢进,机体体内处于高凝状态[14],颅脑损伤患者由于血脑屏障被破坏、组织因子大量释放、血小板活性增加等原因,会使外源性凝血因子被激活,凝血功能出现异常;此外,大量外源性凝血因子进入脑组织后,内源性凝血途径也被激活,形成级联反应,加重凝血功能异常[15]。
本研究还发现,颅脑损伤患者入院时血清IL-6水平与水肿体积最大进展量显著正相关,进一步提示,与β2-MG、D-D相比,血清IL-6与脑水肿严重程度关系更密切,或可作为评估脑水肿病情进展的重要参考指标之一。此外,IL-6、β2-MG、D-D检测方法快速方便,还可弥补传统影像学检查的不足,为临床颅脑损伤患者脑水肿的诊疗提供参考依据。
综上所述,颅脑损伤患者血清IL-6、β2-MG、D-D水平可反映其病理生理过程,与脑水肿体积密切相关,可反映脑水肿病情的严重程度。
