TTC36蛋白在缺氧复氧诱导的肝脏缺血再灌注损伤中的表达
2021-08-12聂芳李可王媛许颖
聂芳,李可,王媛,许颖
(1.成都医学院临床医学院第一附属医院检验科; 2.成都医学院临床医学院;3.成都医学院检验医学院,四川 成都 610500)
肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)指肝脏组织器官由于多种原因导致缺血,造成细胞组织器官的损伤,而缺血之后进行再灌注,细胞组织器官相关功能仍无法恢复,并且使其损伤更为严重,这也是肝脏切除和肝移植手术、低血容性休克、毒性肝损伤、静脉阻塞性病变等疾病过程中最常见的病理生理现象[1]。HIRI 可导致10%早期肝脏移植后器官衰竭、45%器官损伤和急慢性组织排异现象[2-3]。然而,目前仍然缺乏对于HIRI的有效监测指标和防治措施。TTC36是一个新发现的具有3个连续C端四肽重复(tetratricopeptide repeat,TPR)结构域的蛋白分子, Liu等[4]报道通过 TPR 结构域与热休克蛋白70(HSP70)的C端相互作用发挥分子伴侣的功能,Jiang等[5]报道TTC36作为抑癌基因参与调控肝癌细胞的凋亡,Xie等[6]报道TTC36参与4-羟苯基丙酮酸双加氧酶(4-hydroxyphenylpyruvic acid dioxygenase,HPD)的降解导致酪氨酸血症和神经损伤。本实验拟研究TTC36在缺氧复氧诱导的肝细胞损伤中的动态变化规律,为进一步深入探讨TTC36在肝脏缺血再灌注损伤中的作用奠定基础。
1 材料与方法
1.1 材料
人正常肝细胞LO2由华西科技园肿瘤分子靶向治疗研究室夏洪伟博士惠赠;TTC36鼠源性单克隆抗体由深圳市龙华区人民医院检验科刘运洪博士惠赠;辣根过氧化物酶标记的羊抗鼠二抗购自北京中杉金桥生物技术有限公司;0.25%乙二胺四乙酸(EDTA)的胰酶、胎牛血清、高糖Dulbecco改良的Eagle培养基(DMEM)培养基、磷酸缓冲盐溶液(PBS)(Gibco公司);乳酸脱氢酶 (LDH)、谷丙转氨酶(ALT )、谷草转氨酶 (AST )试剂(四川迈克生物科技股份有限公司,配套仪器为日立全自动生化分析仪7060);无糖DMEM培养基、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、丙二醛(MDA)试剂盒(北京索莱宝科技有限公司);ST8R型高速冷冻离心机(赛默飞世尔公司);HR40-IIA2型生物安全柜(青岛海尔特种电器有限公司);GENbag厌氧产气袋(梅里埃公司);SM-150A超声细胞破碎仪(南京舜玛仪器设备有限公司);ST-360型酶标仪(上海科华生物公司);Trans-Blot转印槽(美国Bio-Rad 公司);UVP凝胶成像分析仪(美国UVP公司)。
1.2 方法
1.2.1 LO2肝细胞复苏、传代、保种 肝脏LO2细胞复苏,将其转入10 cm2细胞培养皿中,再用含10% 胎牛血清(FBS)的DMEM培养基,在37 ℃、5% CO2、95%湿度条件下无菌培养。当细胞贴壁长满后,弃去培养基,以PBS洗涤细胞,传代,取对数生长期的细胞用于后续实验。
1.2.2 缺氧复氧诱导实验 (1)细胞分组分盘:弃去培养皿内的培养液,用 PBS 洗两次后弃去,加入 0.25%胰酶置于培养箱内消化2 min;在离心机中 800 g离心力,离心5 min。后弃去上清液;离心沉淀中加入完全培养液,并以无菌吸管轻轻反复吹打使细胞分散成单细胞悬液;将细胞悬液均分加入培养皿,实验分为对照组N组(正常条件下培养);A3组、A6组、A9组(在缺氧环境下分别培养3、6、9 h之后进行复氧2 h);R0组、R2组、R4组、R6组(在最适缺氧时间6 h后复氧0、2、4、6 h)。(2)缺氧复氧细胞模型建立:当细胞长到对数生长期时,将实验组培养基更换为无糖无血清培养液,实验组均放入GENbag厌氧产气袋中(GENbag厌氧产气袋,型号:45534)可在1 h左右提供残余氧浓度低于1%,和CO2浓度大约20%,在脱氧过程中不产生压差及温度变化),置于37 ℃二氧化碳培养箱中继续培养,分别缺氧培养6 h后,弃去厌氧袋,培养基更换为之前含10%FBS的完全培养基,放入二氧化碳培养箱中继续培养2、4、6 h后收集细胞。对照组在正常条件下培养、换液,无缺氧复氧处理。(3)台盼蓝染色检测细胞活力:各组细胞消化后吸取0.1 mL细胞悬液经过台盼蓝染色5 min后,取一滴置于高倍显微镜下计数,死细胞着浅蓝色并膨大无光泽,或细胞不着色并保持正常形态,有光泽。细胞活力(%)=未染色的细胞数/观察到细胞总数×100%。(4)细胞总蛋白的提取:实验组和对照组在不同缺氧复氧时间后,开始收集细胞总蛋白。LO2细胞吸走细胞上清液,PBS 缓冲液清洗两遍细胞后,加入800 uL蛋白裂解液,超声波破碎(功率20%或200 V,超声3 s,间隔10 s,重复30次),12 000 rpm 4 ℃离心10 min,取上清液,置冰上待测。
1.2.3 检测肝功能损伤酶学指标ALT、AST的含量 收集缺氧复氧处理前后的细胞上清液,在7060型日立全自动生化分析仪上进行检测,记录各组数据。
1.2.4 检测肝损伤标志蛋白SOD、GSH、MDA的活性含量 将提取好的各组的细胞总蛋白参照Solarbio试剂盒说明书经过相应处理后,在酶标仪上检测吸光度,并按照试剂盒说明书上的公式进行计算,计算出SOD、GSH和MDA 三种蛋白质活性含量。
1.2.5 蛋白印迹法检测细胞TTC36蛋白水平 提取好的总蛋白加loading buffer后煮沸10 min变性处理,然后进行聚丙烯酰胺凝胶电泳分离蛋白,电转移至聚偏氟乙烯[poly(1,1-difluoroethylene),PVDF]膜上。封闭后,一抗孵育过夜,再用二抗体偶联物孵育,化学发光试剂(electrochemiluminescence,ECL)显迹,在UVP凝胶成像分析仪中采集图像并进行灰度比值分析。
1.3 统计学分析
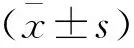
2 结果
2.1 肝缺血再灌注损伤细胞模型的建立
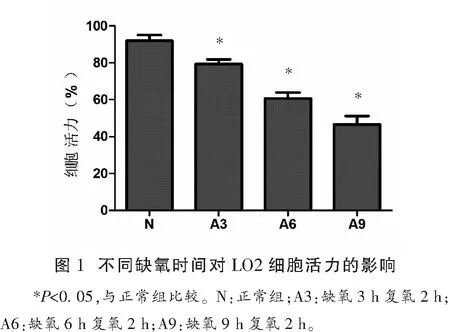
选取最适宜的缺氧条件:LO2细胞在Genbag厌氧袋中培养0.5~1 h,厌氧指示条由蓝色逐渐变为无色,说明此时氧气浓度<0.1%(有氧环境下为蓝色,无氧环境下为无色),说明缺氧环境已建立。缺氧培养3、6、9 h复氧2 h后,A3、A6、A9组细胞活力较正常组有显著性差异(P<0.05),见图1。通过镜下观察LO2细胞缺氧复氧损伤后的形态学变化,正常组细胞生长良好,大部分细胞贴壁扩展,呈梭形,细胞密度高。随缺氧时间增加,贴壁细胞数目减少,细胞密度降低,细胞间间隙增大,部分细胞可见明显的结构破坏,镜下出现更多的细胞碎片或脱落漂浮的细胞,提示LO2细胞损伤程度随缺氧时间的延长而加重,细胞存活率下降,证明厌氧袋/厌氧罐法能够建立有效的细胞缺氧复氧损伤模型,可以有效地模拟肝缺血再灌注损伤,后续实验中选取缺氧6 h后分别复氧0、2、4、6 h收集细胞及细胞外液进行检测分析。
2.2 肝缺血再灌注损伤细胞模型的验证
2.2.1 构建的缺氧复氧模型LO2细胞外液中的肝损伤标志物ALT、AST含量变化 与正常组比较,R0、R4组ALT、AST活性增高(P<0.05);与R0组(ALT=10.3±3.2 U/L、AST=15.4±3.1 U/L)比较,R2组ALT(25.4±2.5 U/L)、AST(39.2±3.4 U/L)表达水平更高(P<0.05),提示肝细胞复氧后比缺氧时损伤更严重了;随着复氧时间延长,R6组(ALT=10.2±3.6 U/L、AST=18.8±5.0 U/L)逐渐降低恢复正常(P>0.05)。见表1。
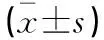
表1 缺氧复氧模型LO2细胞外液中ALT、AST含量变化
2.2.2 构建的缺氧复氧模型LO2细胞中MDA、GSH、SOD活性变化 与正常组比较,R0(1.46±0.313 nmol/mg)、R4组(1.49±0.327 nmol/mg)细胞MDA活性含量较正常组(1.43±0.123 nmol/mg)升高(P<0.05),而GSH(R0=4.26±1.463 μg/mg、R4=4.22±0.738 μg/mg)和SOD(R0=342±34 U/g、R4=325±63 U/g)活性含量下降(P<0.05);与R0组比较,R2组MDA(1.52±0.294 nmol/mg)活性含量更高(P<0.05),GSH(3.92±0.829 μg/mg)和SOD(268±48 U/g)活性含量更低,同样提示肝细胞复氧后比缺氧时损伤更严重;随着复氧时间延长,R6组(MDA=1.45±0.285 nmol/mg、GSH=4.43±1.137μg/mg、SOD=389±84 U/g)逐渐恢复正常(P>0.05)。见表2。
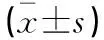
表2 缺氧复氧模型LO2细胞中MDA、GSH、SOD活性变化
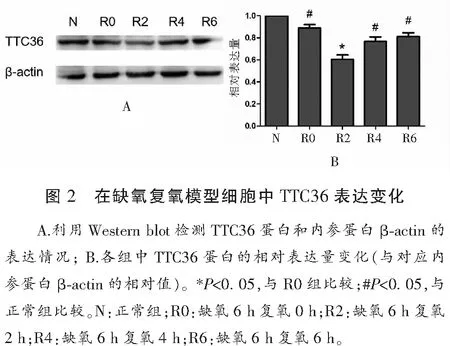
2.3 LO2细胞构建的缺氧复氧模型细胞中TTC36表达差异
LO2细胞缺氧6 h后分别复氧0 h、2 h、4 h、6 h,提取细胞蛋白,通过Western Blot 检测TTC36的表达,结果显示正常组、R0组、R2组表达逐渐降低,R4、R6组表达又逐渐增高,提示复氧1 h的细胞发生二次损伤,较缺氧未复氧时TTC36蛋白表达明显下调,随着肝功能恢复,TTC36蛋白的表达也恢复正常。见图2。
3 讨论
我国的肝脏外科是一个迄今不到50年的新崛起的领域,其中肝缺血再灌注损伤的理论研究至今仅十几年[7]。现阶段,虽然HIRI的研究范围广,但是我国对此的研究较少,迄今对该损伤诊断的仍无统一标准,主流观点认为肝缺血再灌注损伤的主要检测方法是生化和影像学指标。生化方法主要是检测传统的损伤生化标志物,包含天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、碱性磷酸酶 (alkaline phosphatase,ALP)和丙氨酸氨基转移酶(alanine aminotransferase,ALT) 等。另外,还有一些未广泛运用的新型肝损伤生物标志物,如蛋白质分子、血液生物标记、尿液中的生物标记和循环RNA等[8]。这些方法均是对于肝损伤的大范围的检测和术后评估,对于肝缺血再灌注损伤这一特定的肝脏损伤的特异性和针对性较低。传统的损伤标志物对于肝缺血再灌注损伤无法作出较准确和快速的反应[9]。因此,本研究分析TTC36蛋白在肝缺血再灌注损伤中的表达差异,从而探索HIRI的新的早期检测指标。
将细胞置于无糖无血清的DMEM培养基中,然后放置在厌氧袋里,在此环境培养后,细胞处于缺氧状态;缺氧后培养基由无糖无血清更换为正常培养基,再造成复氧环境,通过检测细胞活力和肝损伤指标反映该模型建立成功。LO2细胞经过不同缺氧时间处理,细胞活力发生改变。分别缺氧3 h 、6 h、9 h后复氧2 h,A9组可能由于缺氧时间过长已经超出了细胞的承受范围,对细胞造成了不可逆的损伤,细胞大量死亡,说明在缺氧的环境下,机体应激能力是有限的;较A9组,A6组在复氧2h后细胞死亡数减少,可能需要更长的时间才能恢复;A3组损伤轻微,细胞存活率较A6组高,肝细胞功能恢复时间较短。为研究缺氧复氧诱导的缺血再灌注损伤,选取损伤适中的缺氧时间6 h进行复氧实验,并通过检测几种肝损伤标志物ALT、AST、MDA、GSH和SOD验证此细胞模型的有效性。缺氧复氧2 h的肝细胞损伤程度要高于缺氧未复氧时,表明该模型可以模拟手术中肝缺血后恢复血供,肝脏正常生理功能并没有因此恢复,反而造成损伤加重的情况。此方法具有成模快速、结果稳定、操作简单等优点,在实际应用中可根据实验条件进行合适的选择。在机体中的缺氧再灌注损伤情况更为复杂,涉及到各种激素调节,神经调节等[10],建立细胞模型,可控制变量,研究某一特定因素,减少或避免其他因素的干扰,让实验结果的可信度、准确性更高。肝细胞缺血再灌注损伤模型的建立为缺血再灌注损伤的预防及治疗奠定了一定的临床基础。
TTC36蛋白在哺乳动物体内保守表达,并且在肝脏中TTC36可作为分子伴侣与多种蛋白协助发挥作用[11]。本研究中ALT、AST以及MDA、GSH、SOD等肝损伤指标显示,在缺氧复氧模拟的细胞模型中缺氧后细胞受到一定程度的损伤,但缺氧复氧后的细胞较缺氧未复氧时损伤严重,但随着复氧时间延长,细胞逐渐恢复正常。另外,正常组、R0组、R2组TTC36的表达逐渐降低,R4、R6组TTC36的表达又逐渐增高,但缺氧复氧后的细胞较缺氧未复氧时TTC36蛋白表达明显下调,随着肝功能恢复,TTC36蛋白的表达也恢复正常。
综上所述,TTC36蛋白在缺氧复氧诱导的肝缺血再灌注损伤过程中表现出明显差异,其表达量的变化能够较好地反映细胞缺氧性损伤-再灌注损伤-细胞损伤后修复这一动态变化过程。因此, TTC36的表达水平可以反映机体肝缺血再灌注损伤程度的早期判断和预后情况,也预示着TTC36有望成为肝缺血再灌注损伤一个新的早期监测指标和预后指标。
