利用GFP基因的黄瓜T-DNA插入突变体构建与快速鉴定
2021-08-11冯路路王雪艳王团团陈劲枫
冯路路 王雪艳 夏 磊 王团团 李 季,* 陈劲枫
(1南京农业大学园艺学院,作物遗传与种质创新国家重点实验室,江苏 南京 210095;2江苏沿江地区农业科学研究所,江苏 南通 226541)
黄瓜(CucumissativusL.)是一种重要的蔬菜作物,其栽培历史悠久[1]。近年来,随着黄瓜基因组测序的完成及基因工程技术的不断发展,越来越多的重要功能基因被定位并克隆出来,发现新基因和发掘基因功能已经成为黄瓜功能基因组学研究的重要任务[2]。突变体是研究基因功能最直接、最有效的试验材料之一,相较于野生型植株,突变体往往仅在某一个基因位点发生变化,避免了其他位点的干扰[3],对基因功能研究具有重要价值。由于黄瓜的遗传基础较为狭窄[4],自然变异的频率很低,因此,人为创制突变体进行基因功能研究已成为必然。
突变体的创制途径主要包括物理诱变、化学诱变及插入突变等,近年来的基因编辑技术作为一种定向创制突变体的方法已广泛应用于番茄(SolanumlyeopersicumMill.)[5]、水稻(OryzasativaL.)[6]及拟南芥(Arabidopsisthaliana)[7]中,黄瓜中也有相应报道。其中,插入突变具有研究无表型基因、易获得突变位点、易于进行反向遗传学研究等诸多优点[8],是一种较为适合创制植物突变体的方法。随着农杆菌介导的转基因技术不断发展,T-DNA插入破坏基因广泛应用于功能基因组学研究[9]。目前,利用T-DNA插入创制突变体的方法已经成功应用于构建拟南芥[10]和水稻[11]突变体库,并对相关突变体的突变基因功能进行了分析,明确了花青素[12]、穗形态[13]以及叶片夹角[14]等农艺性状相关的重要基因。前人多是利用甲基磺酸乙酯(ethyl methane sulphonat, EMS)来创制黄瓜突变体,如王晶等[15]利用EMS诱变获得了有关株型、叶片、花器官以及果实性状的黄瓜突变体;薛红霞等[16]利用EMS诱变得到了叶型、叶色、果实长度、株型等多个类型的黄瓜突变体。在葫芦科插入突变体创制方面,任海英等[17]利用T-DNA插入突变得到一个蔓枯病抗性明显增强的甜瓜突变体edr2。李蕾等[18]将T-DNA插入应用于黄瓜突变体构建中,并利用PCR和斑点杂交技术对T-DNA插入突变体进行了验证。Hu等[19]通过基因编辑技术敲除了黄瓜中的CsWIP1基因,该基因的突变使黄瓜植株由雌雄同株转变为全雌株,并在转基因后代中筛选得到非转基因的纯合突变体Cswip1。
利用T-DNA插入的方法创制突变体往往需要高效的遗传转化体系。Trulson等[20]早在1986年就首次成功获得黄瓜转基因材料,在过去三十多年中,研究者对黄瓜的遗传转化方案进行了基因型[21]、外植体[22]、选择标记[23]等多方面的优化,但目前的黄瓜遗传转化体系依旧存在着转化效率低、转基因遗传稳定性差等问题。本研究在南京农业大学葫芦科作物遗传与种质创新实验室已经建立的农杆菌介导的黄瓜子叶节遗传转化体系的基础上,从农杆菌活力、共培养温度等方面进行进一步优化,以绿色荧光蛋白(green fluorescent protein, GFP)报告基因为插入基因,利用TAIL-PCR进行T-DNA插入突变体的T-DNA侧翼序列进行扩增,确定T-DNA的插入位点,对插入基因的功能进行初步解析,以期得到更高效的遗传转化体系,为黄瓜功能基因组学研究提供一定的技术和材料基础。
1 材料与方法
1.1 材料与试剂
用于遗传转化的黄瓜材料为南京农业大学葫芦科作物遗传与种质创新实验室保存的长春密刺高代自交系CCMC。农杆菌菌株C58、表达载体pGreen0029均由南京农业大学葫芦科作物遗传与种质创新实验室提供。DNA提取试剂盒购自Omega Bio-Tek_安诺伦(北京)生物科技有限公司,Genome Walking Kit试剂盒购自宝日医生物技术(北京)有限公司。植物组培材料在南京农业大学葫芦科作物遗传与种质创新实验室组织培养室中培养,培养条件为温度25℃,光周期16 h/8 h (昼/夜)。再生植株在人工气候箱中培养,培养条件为温度28℃/25℃ (昼/夜),光周期18 h/6 h (昼/夜),相对湿度70%~75%。
1.2 试验方法
1.2.1 农杆菌介导的黄瓜子叶节法转化方法 以CCMC为受体材料,选取饱满的种子进行消毒,接种到无菌培养基上。待种子生长至下胚轴直立子叶未张开的状态,将植株生长点剔除后,保留1/3子叶和2 mm下胚轴的子叶节作为转化外植体接种于预培养基[MS + 6-苄基腺嘌呤(6-benzylaminopurine,6-BA)1.5 mg·L-1) + 脱落酸(abscisic acid,ABA)0.2 mg·L-1]上,黑暗条件下培养1 d。
挑取携带植物表达载体pGreen0029的农杆菌单菌落进行活化培养,之后将其制备成OD600为0.5的侵染液。将经预培养的外植体置于农杆菌重悬液中侵染20 min,然后将侵染完成的外植体置于共培养基(MS + 6-BA 1.5 mg·L-1+ ABA 0.2 mg·L-1+乙酰丁香酮(acetosyringone, AS)100 μmol·L-1]上黑暗培养3 d后转到选择培养基[MS + 6-BA 1.5 mg·L-1+ ABA 0.2 mg·L-1+ Kan(卡那霉素)100 mg·L-1+ 特美汀(timentin, TM)200 mg·L-1]上继续培养。
1.2.2 农杆菌生长曲线的测定 取刚活化好的菌液400 μL加入50 mL配置好的液体YEB培养基中在28℃重新摇菌,在24 h内每隔2 h吸取10 μL不同稀释程度的菌液接种于配置好的YEB固体培养基中,28℃倒置避光培养30 h,然后对培养基上长出的农杆菌单菌落进行计数,根据稀释倍数得到各个时间段单位菌液中的活细菌数量并测定其OD600值,并制作农杆菌的生长曲线。
1.2.3 共培养温度处理对转化效率的影响 农杆菌侵染操作方法同1.2.1,将侵染完成的外植体接种于共培养基上分别在18、23、28、33℃条件下黑暗培养3 d,然后转接至选择培养基上培养15 d后对外植体进行荧光观察,统计不同温度条件下的外植体的再生率以及转化率,重复3次。
1.2.4 利用GFP报告基因筛选转化外植体 以pGreen0029载体为转化载体,该载体的T-DNA插入序列为绿色荧光蛋白基因GFP的表达单元,因此当T-DNA成功插入到植物宿主细胞中时,GFP可以作为报告基因,在外植体分化培养15 d左右进行荧光观察,将外植体置于MVX10宏观变倍体式荧光显微镜下(日本Olympus公司),在GFP通道(460~550 nm)下对外植体进行荧光观察。未转化的外植体由于叶绿体自发荧光而显现为红色,被转化的外植体由于会表达GFP则显现为绿色。为了准确评估转化事件,将整体表达GFP信号的愈伤组织或再生芽认定为阳性愈伤或阳性芽,愈伤组织或再生芽上仅分散有GFP表达细胞的不能认定为阳性愈伤或阳性芽。
1.2.5 利用GFP报告基因鉴定转化植株 将筛选得到的外植体经过分化、伸长、生根后进行驯化,待植株生长健壮后取转化植株的叶片、卷须、花芽以及根系等部位置于MVX10宏观变倍体式荧光显微镜下,在GFP通道(460~550 nm)下进行GFP信号的表达观察。并将转化植株置于植物活体成像系统中,对转化植株整体的GFP荧光表达情况进行观察鉴定。
1.2.6 TAIL-PCR克隆T-DNA侧翼序列 DNA试剂盒[安诺伦(北京)生物科技有限公司]提取已经驯化的一株T-DNA插入黄瓜突变体和野生型黄瓜幼嫩叶片的总DNA,具体步骤参考产品说明书。利用Premier 5.0软件在T-DNA右边界设计3个巢式引物SP1、SP2和SP3(表1),引物AP1、AP2是由Genome Walking Kit试剂盒[宝日医生物技术(北京)有限公司]提供的经过特别设计的退火温度较低的兼并引物。按照试剂盒说明对黄瓜T-DNA插入突变体的T-DNA侧翼序列进行扩增,将第三轮PCR产物经凝胶电泳鉴定后送往南京擎科生物科技有限公司进行测序,测序结果在葫芦科作物基因组数据库(http://cucurbitgenomics.org/)网站进行序列比对分析。根据得到的插入位点,在T-DNA载体序列中设计特异性引物M-F,在插入位点旁临的基因组序列中设计特异性引物M-R,利用这对特异性引物对突变体进行鉴定。
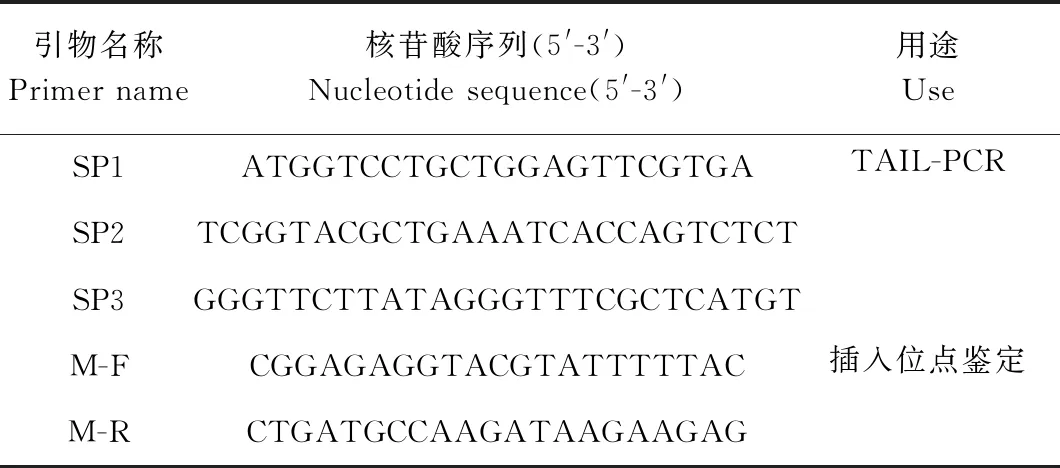
表1 试验所用引物序列
2 结果与分析
2.1 黄瓜遗传转化体系优化
在农杆菌介导的黄瓜遗传转化的体系中,农杆菌自身活力是影响侵染成功率的关键因素。细菌培养增殖有四个时期:迟缓期、对数期、稳定期和衰亡期,处于对数期的细菌具有更好的活力[24]。农杆菌活力鉴定通常采用OD值法,但该方法测定的菌液浓度同时包含了活菌和死亡菌,不能准确地反映农杆菌的真实活力,本研究通过测定农杆菌活化培养过程中不同时间点单位菌液中的活菌数目(CFU·mL-1),制作农杆菌生长曲线。由图1可知,农杆菌活化8~20 h,菌群处于对数生长期;20 h之后,虽然OD值仍在上升, 但活菌统计显示菌群已进入衰亡期。综合菌群活力和菌体数量,本研究认为农杆菌活化培养12~18 h时,菌液具有最佳的活力。
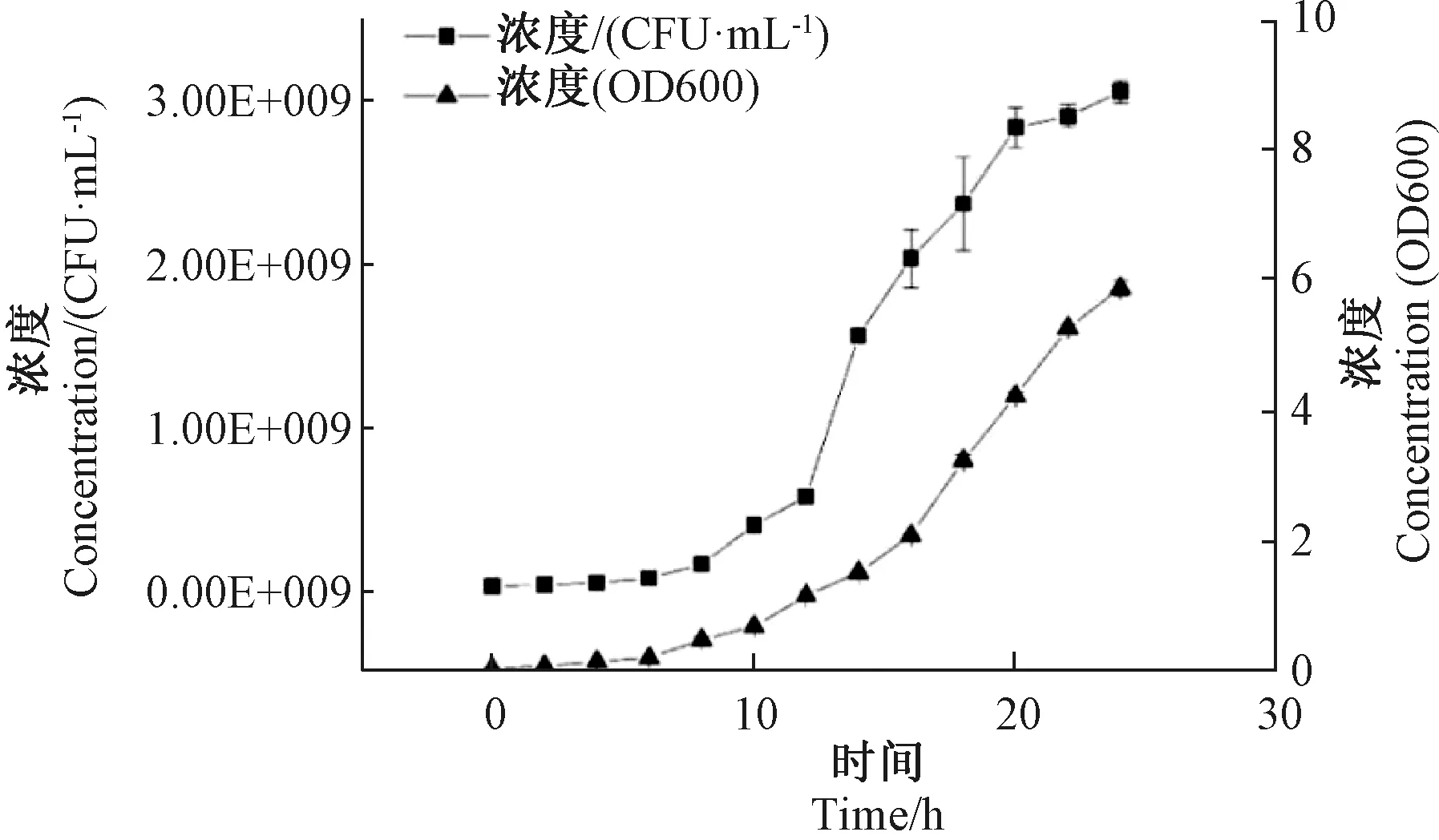
图1 农杆菌生长曲线图
共培养阶段是农杆菌完成对植物细胞侵染的时期,共培养阶段的温度、时间、培养基成分以及pH值都是影响转化效率的关键因素[25]。本研究对不同共培养温度处理转化外植体2周后统计其再生率和阳性诱导率,由表2可知,只有共培养温度为33℃时外植体再生率最低,仅为21.29%,显著低于其他温度条件下培养的外植体,说明共培养阶段高温会抑制外植体的分化。28℃是最适宜农杆菌生长的温度,但阳性诱导率的统计结果显示,当共培养温度为23℃时阳性诱导率最高为2.26%,显著高于28℃下的转化率。综合外植体的再生率和阳性诱导率,本研究认为23℃是最适的共培养温度。
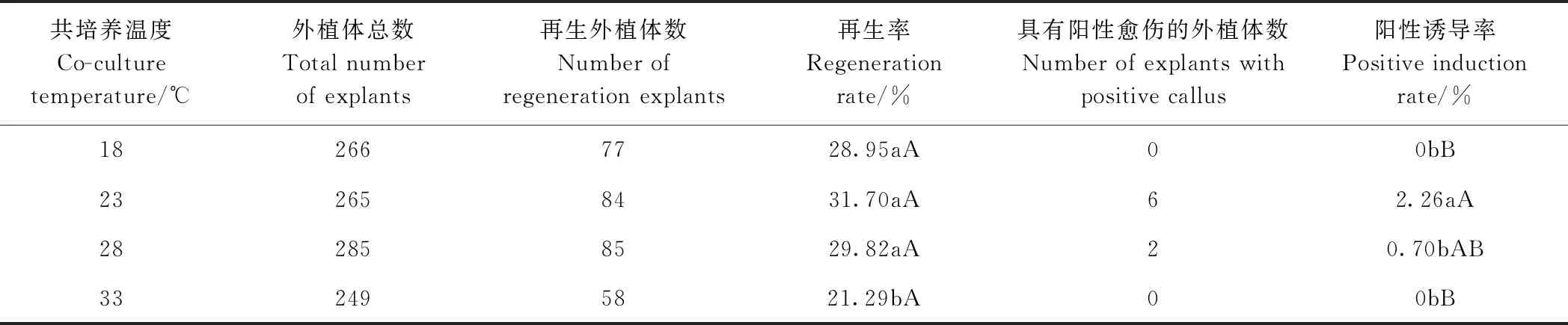
表2 共培养温度对黄瓜子叶节转化的影响
2.2 利用绿色荧光蛋白GFP的突变体快速鉴定
在外植体侵染完成后分化培养2周,统计外植体的分化率并进行GFP荧光观察。观察结果显示,绿色荧光在不同类型的组织中均有表达。白色且质地松散的非胚性愈伤组织中,GFP信号较弱,仅在愈伤表面呈松散分布(图2-A、E);在绿色的质地较为致密的愈伤组织中,GFP信号较为集中地分布在愈伤突起部位(图2-B、F),这类愈伤再生率较高;在再生芽中,荧光信号分布也有不同表现,例如在嵌合体的再生芽中,成功转化的组织部位可以清晰检测到荧光信号,而未转化部位无荧光信号(图2-C、G)。相比之下,由转化细胞发育而来的阳性再生芽,其各个组织部位均能检测到较强的荧光信号(图2-D、H)。在通过体式荧光显微镜的快速鉴定后,将具有较强荧光信号的胚性愈伤组织或再生芽的外植体继续继代培养,同时切去各荧光组织部位周围的无荧光再生芽。
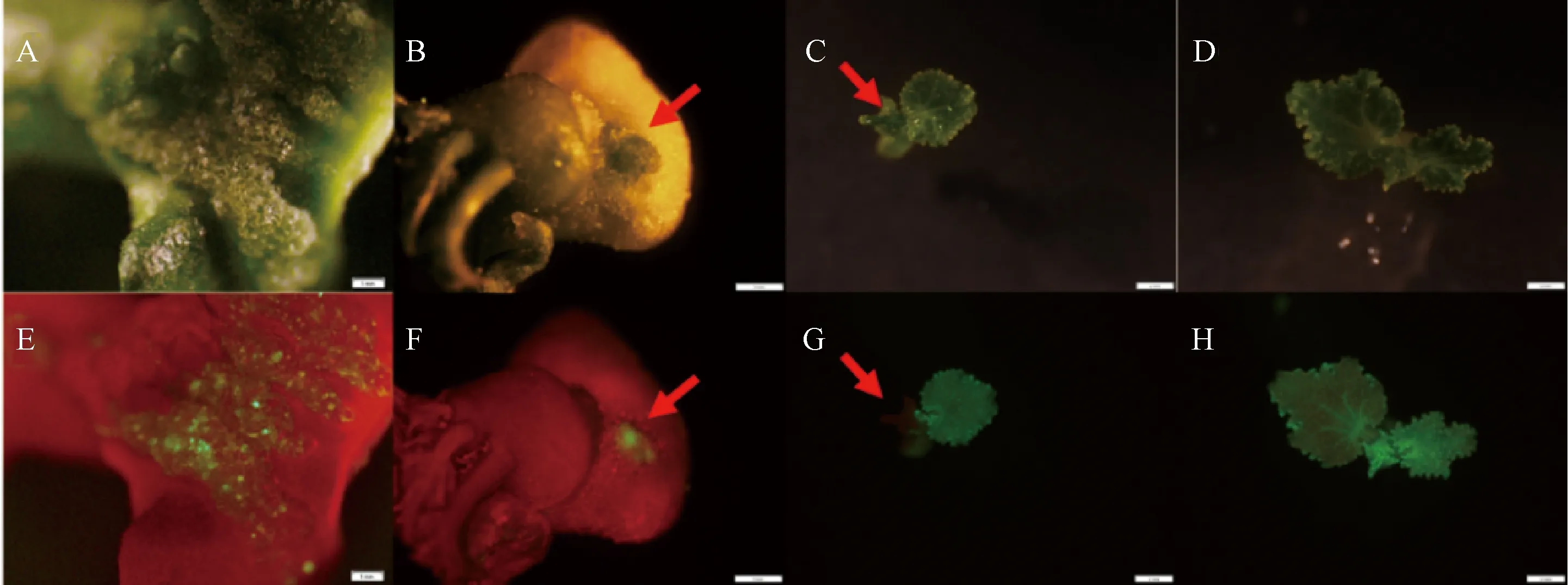
注:A、B、C和D分别是明场下的具有非胚性愈伤的外植体,具有胚性愈伤的外植体,转基因嵌合体,具有阳性芽的外植体;E、F、G和H分别是具有非胚性愈伤的外植体,具有胚性愈伤的外植体, 转基因嵌合体,具有阳性芽的外植体。
利用优化后的遗传转化体系创制T-DNA插入突变体,通过GFP荧光表达的筛选,最终从2 978个黄瓜转化子叶节外植体中得到3株GFP阳性植株,遗传转化率为1.00‰。将筛选得到的阳性外植体进行驯化,待植株生长健壮后对植株的叶片、花芽、卷须以及根系等部位进行GFP信号表达观察,发现这些组织部位均有GFP信号的表达(图3)。利用活体成像系统对整个植株进行GFP荧光表达观察,发现转化植株整体均有不同程度的GFP荧光信号,其中,转化植株的叶脉和生长点等组织部位荧光信号最强,为700 cps(counts per second);嫩叶和卷须等组织部位荧光信号强度次之,为400 cps;衰老叶片和叶片边缘等组织部位荧光信号强度最弱,为50 cps(图4)。
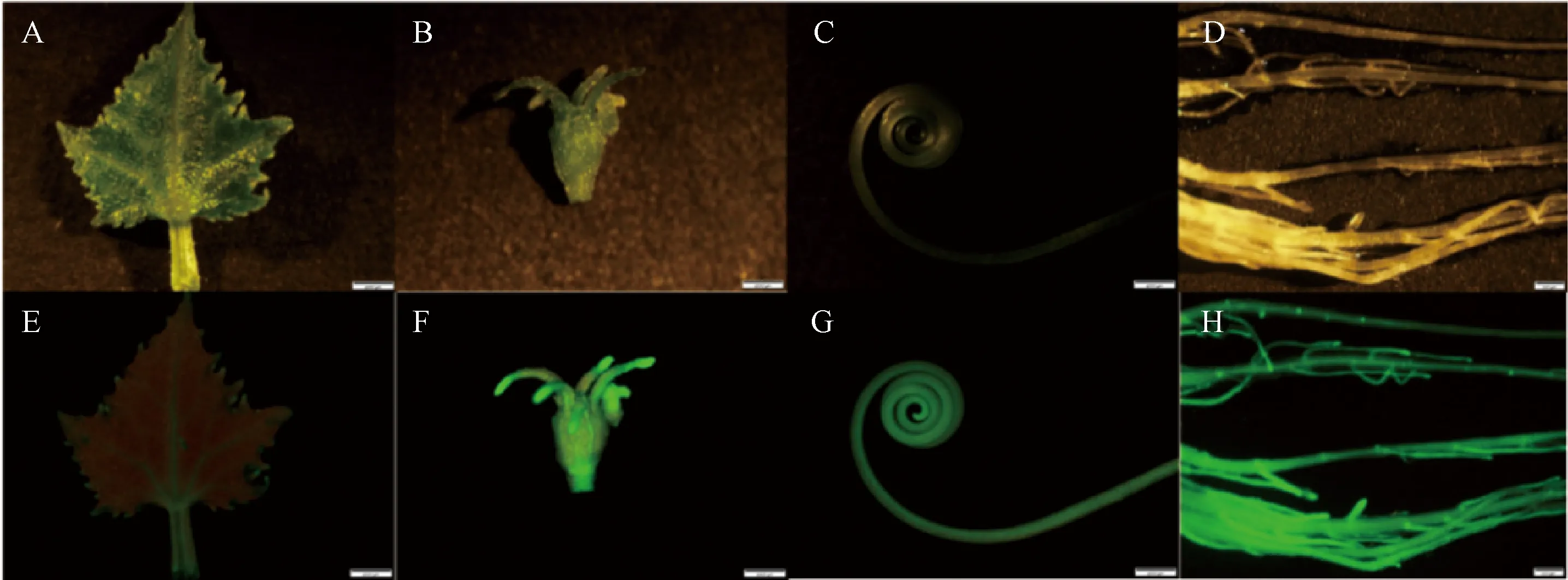
注:A、B、C和D分别是明场下转基因植株的叶片、花芽、卷须和根系;E、 F、G和H分别是转基因植株的叶片、花芽、卷须和根系。
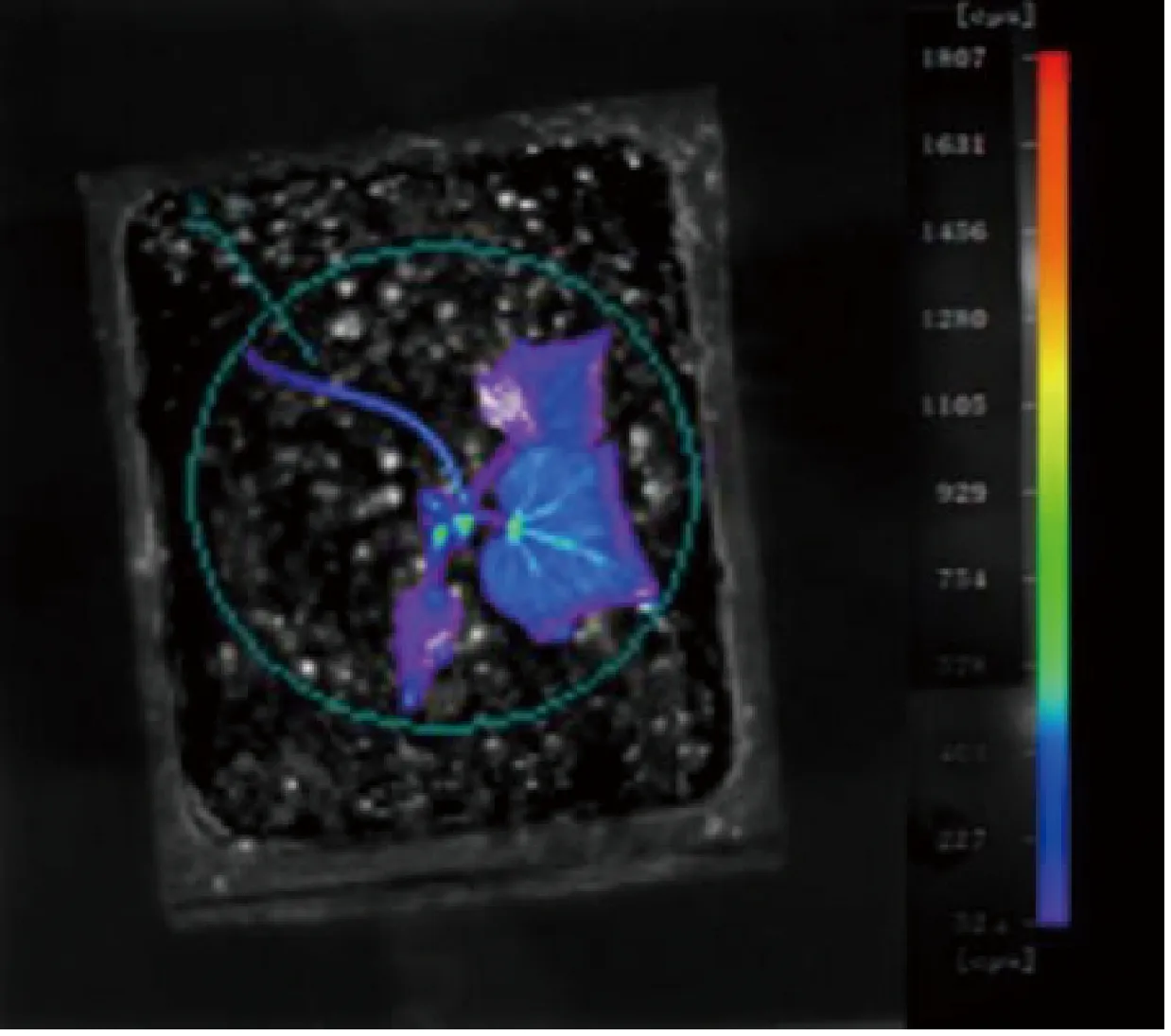
注:右侧光标显示生物发光强度值范围为 (紫色端) 50~1 800 cps (红色端)。
2.3 突变体插入位点的分子鉴定
以未转化长春密刺植株(图5-A)为对照,对T0突变体T-DNA-PG-1(图5-B)的株型、雄花、雌花以及叶片形态等性状进行比较观察,结果显示,T0植株与野生型植株相比无明显差异。为检测T-DNA插入突变体中T-DNA的插入位置,本研究采用TAIL-PCR对T-DNA插入突变体进行T-DNA的侧翼序列扩增,分别利用Genome Walking Kit试剂盒中的简并引物AP1、AP2和自行设计的序列特异性引物SP1、SP2、SP3对已经驯化的1株T-DNA插入突变体的基因组DNA进行3轮PCR扩增,在使用简并引物AP1的第三轮PCR扩增结果中得到了一段大于2 000 bp的DNA片段(图6-B),然后将该第三轮PCR产物测序,得到736 bp的准确DNA序列。利用DNAMAN软件将测序结果与载体序列进行比对,发现测序结果前160 bp的DNA序列中有112 bp的DNA序列与载体序列一致,然后将测序结果在葫芦科作物基因组数据库(http://cucurbitgenomics.org/)网站进行序列比对,测序结果中位于193~704之间共512 bp的DNA片段与黄瓜基因组第一条染色体的20 011 698~20 011 187的DNA片段100%匹配,因此,初步将T-DNA插入突变体的T-DNA插入位置定位于第1条染色体上CsaV3_1G032940基因的第10个外显子中,推测该基因是一类蛋白激酶。

注:A: 野生型植株;B: 突变体T-DNA-PG-1。
为了进一步验证TAIL-PCR的鉴定结果,在T-DNA载体上设计特异性引物M-F,距离T-DNA右边界1 149 bp。然后在基因组中设计特异性引物M-R,距离T-DNA右边界插入位点401 bp(图6-A)。利用设计的这一对引物对黄瓜野生型植株和T-DNA插入突变体植株的DNA进行扩增。在黄瓜T-DNA插入突变体植株的DNA中,由于有T-DNA载体插入,可以扩增出预期约1 550 bp的片段;而在野生型植株的DNA中,由于未插入T-DNA载体,不能扩增出预期大小的DNA片段(图6-C)。将得到的PCR产物进行测序,测序结果显示PCR扩增序列和预期的序列结果基本一致,进一步确定了T-DNA插入突变体的T-DNA插入位置。
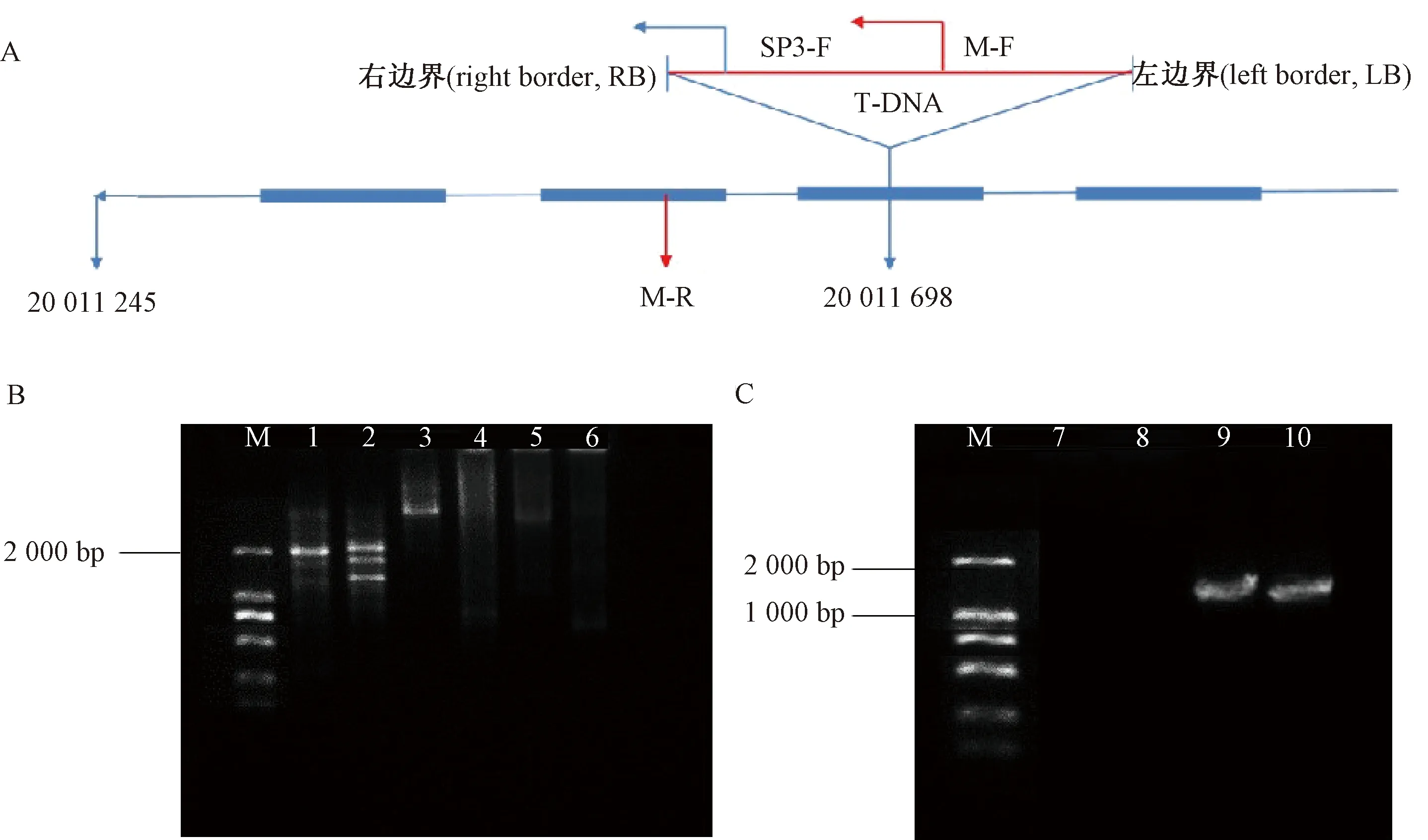
注:A: T-DNA在第一条染色体的插入位点;B: TAIL-PCR扩增转基因植株的侧翼序列;C: T-DNA插入位点的验证。M: DNA maker;1~3: 兼并引物AP1的第1、2、3轮TAIL-PCR扩增;4~6: 兼并引物AP2的第1、2、3轮TAIL-PCR扩增;7: 水;8: 野生型植株; 9、10: 转基因植株。
3 讨论
报告基因具有可靠、便捷和灵敏度高等优点,是一种较为适合鉴定转基因植株的方法,目前β-葡萄糖苷酸酶基因(β-glucuronidase,GUS)和GFP是黄瓜遗传转化体系中应用最为普遍的报告基因。GUS是一种广泛应用于转基因快速检测的报告基因[26],但GUS无法进行活体检测,在外植体再生阶段时只能对再生芽进行破坏性的检测。相比之下,利用GFP荧光观察可以活体鉴定转基因材料,且操作简单观测结果准确,能有效减少假阳性的问题。Priyadarshani等[27]利用GFP报告基因对菠萝进行遗传转化使转基因菠萝的筛选变得简单、无损;Jung等[28]利用GFP监测技术检测辣椒早期发育阶段的转基因,提高辣椒遗传转化效率;Hu等[19]利用GFP报告基因在外植体发育早期对黄瓜转基因植株进行鉴定,在共培养3 d之后就能检测到微弱的荧光信号。因此,利用GFP作为报告基因在外植体发育早期就可以进行筛选鉴定,更为简便快捷。本研究以GFP作为报告基因,在转化外植体分化2周后进行荧光观察鉴定阳性转化事件,避免了大量再生芽的驯化、DNA提取及PCR检测等工作,并利用GFP报告基因对成熟的阳性植株各组织部位进行观察鉴定,极大提高了转基因植株的筛选效率。
共培养阶段是农杆菌对植物细胞完成侵染的关键时期,共培养温度对T-DNA的转移有着明显影响。农杆菌的最适生长温度为28℃,但农杆菌的最适生长温度不一定是农杆菌具备最强侵染效力的温度。Fullner等[29]研究认为,T-DNA转移的最适温度为19℃,最利于T-DNA复合物的组装和转移。此外,vir基因的诱导和外源DNA片段的整合及稳定表达应在25℃,温度高于32℃就有可能影响其活性[30]。本研究通过设置不同的共培养温度进行黄瓜的遗传转化,发现当共培养温度处于23℃时,外植体的分化率和阳性诱导率都优于其他组。
利用T-DNA插入创制突变体的一个显著优点就是能够快速得到插入位点的T-DNA侧翼序列[31],为突变基因的定位节省了大量时间。侧翼序列的扩增包括TAIL-PCR、质粒拯救、PCR步移以及反向PCR等多种方法,其中TAIL-PCR操作简便、特异性高、灵敏度高,PCR产物可以直接用于测序,被广泛应用于各类插入突变体库侧翼序列的分离[32]。本研究利用TAIL-PCR成功分离得到黄瓜T-DNA插入突变体的T-DNA侧翼序列,通过对黄瓜基因组进行序列比对,确定T-DNA片段插入到CsaV3_1G032940基因(BHP)的外显子中,该基因在拟南芥中的同源基因为AT4G18950,与植物介导蓝光依赖性气孔开放有关[33],但目前在正常栽培条件下,该基因的T-DNA插入突变体与野生型表型无明显差异,在今后的研究中会对该基因在突变体中的表达以及该突变体在蓝光条件处理下的表型鉴定进行深入研究。
4 结论
本研究确定了农杆菌C58的菌液最佳取样时期为摇菌后12~18 h,农杆菌侵染的最佳共培养温度为23℃,并利用GFP报告基因显著提升了转化植株的筛选效率,同时通过TAIL-PCR成功克隆得到突变体的T-DNA侧翼序列,进一步确定了突变体的插入位点,此方法能有效应用于黄瓜的遗传转化中,并为黄瓜及葫芦科其他作物的相关研究提供了参考。但侵染效率过低仍是限制转化效率的最主要原因,后续研究将进一步从黄瓜基因型筛选、转化载体的选择、共培养处理方式等方面开展转化体系优化,同时开展黄瓜花粉管通道法、花粉磁转染等转化技术的探索。
