基于SERS的三种食源性致病菌的快速检测
2021-08-11黄栋玮王甜甜谷贵章张进杰徐大伦杨文鸽
黄栋玮 王甜甜 谷贵章 张进杰,* 徐大伦 杨文鸽
(1 宁波大学食品与药学学院, 浙江 宁波 315000;2 湖州市食品药品检验研究院, 浙江 湖州 313000)
食品在加工和贮运过程中因大肠杆菌(Escherichiacoli)、肠炎沙门氏菌(Salmonellaenteritidis)和单核增生李斯特氏菌(Listeriamonocytogenes)等食源性致病菌污染造成的食品事件时有发生[1-3],因此在公共卫生和食品安全的防控过程中,快速又高效的致病菌检测至关重要[4]。迄今为止,食源性致病菌的检测主要采用传统平板计数法、免疫学方法[5-7]和分子生物学方法[8-11],这些方法耗时耗力且不便于现场检测[12-15]。因此有必要探索有效、灵敏、快速的方法来检测与鉴定食源性致病菌[16-17]。
表面增强拉曼光谱(surface-enhanced raman spectroscopy, SERS)通过将分子吸附在粗糙金属或金属溶胶颗粒上,从而得到比普通拉曼光谱更强的信号,其强度增加多个数量级,可以提供生物样品的特征指纹光谱。SERS增强效应主要归因于纳米金属结构表面的电磁场效应[18-19]。基于各种细菌细胞成分组成的独特信息,SERS可以展示其特征峰,因此该技术可以用于鉴别特殊致病菌[20-21]。研究表明,通过不同大小金属纳米颗粒与细菌混合可获得细菌的SERS效果[22-23],如金纳米颗粒(gold nanoparticles,Au NPs)、银纳米颗粒(silver nanoparticles,Ag NPs)[24]等可作为SERS增强基底,使这些无需特殊标记物检测的SERS检测方法更方便快捷。
纳米颗粒(nano particles,NPs)团聚体重复性差,而且其大小、形状和几何结构不易控制,导致纳米颗粒与分析物的有效结合度不高,在一定程度上降低了分析检测的有效性和可靠性。为克服上述问题,研究者通过表面修饰合成了金属纳米颗粒,使其具有独特的催化、电学和光学特性。Au NPs具有分散性好、稳定性高及生物兼容性好的优点[25],Ag NPs的SERS增强效果好,但易被氧化,稳定性差[26],而 Au@Ag NPs则能结合以上两者的优点,更好地吸附待测分子从而获得较优的SERS信号[27]。但目前鲜见关于Au@Ag NPs对大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌进行定性分析的SERS方法报道。本研究基于Au@Ag NPs的无标记SERS技术完成大肠杆菌、肠炎沙门氏菌和单核增生李斯特的鉴定检测,结合主成分分析(principal component analysis,PCA)、层次聚类分析(hierarchical cluster analysis,HCA)进行3种食源性微生物的分类,旨在利用Au@Ag NPs作为基底检测区分3种食源性致病菌,为快速检测食源性病原体提供理论支持。
1 材料与方法
1.1 材料与试剂
氯金酸(HAuCl4·3H2O,98%)、抗坏血酸(C6H8O6,99%),美国 Sigma 公司;柠檬酸钠(Na3C6H5O7·2H2O,98%)、硝酸银(AgNO3,99.9%),上海阿拉丁生化科技股份有限公司。
大肠杆菌(Escherichiacoli,ATCC 25922),浙江省中心疾病预防控制中心;单核增生李斯特菌(Listeriamonocytogenes,CICC 10982)和肠炎沙门氏菌(Salmonellaenteritidis,CICC 21540),中国工业微生物菌种保藏管理中心。
1.2 仪器与设备
XploRA ONE高灵敏度拉曼光谱仪,上海HORIBA Scientific公司; H-7650透射电子显微镜,日本日立公司;D-7PC紫外-可见分光光度计,南京菲勒仪器有限公司;Eppendorf AG 22331高速冷冻离心机,德国艾本德公司,Winner802纳米激光粒度仪,济南微纳颗粒仪器股份有限公司。
1.3 试验方法
1.3.1 Au@Ag NPs溶液制备 参考李盼等[28]的方法分两步合成Au@Ag NPs。第一步合成Au NPs作为种子:100 mL去离子水中加入515 μL 2%的 HAuCl4·3H2O,磁力搅拌加热到沸腾后加入1 mL 1%的Na3C6H5O7·2H2O溶液,继续沸腾加热30 min。溶液由无色变为澄清的紫红色即代表金纳米颗粒形成。第二步合成Au@Ag NPs:取10 mL上述制备好的Au种子,加入1.5 mL 0.1 mol·L-1抗坏血酸溶液,在磁力搅拌条件下加入3.5 mL 1 mmol·L-1的AgNO3溶液,将AgNO3中的Ag+由抗坏血酸还原成Ag,包裹在Au核表面,反应过程中持续还原生长成Ag壳,AgNO3加样结束后溶液变为橘黄色,继续搅拌30 min,得到Au@Ag NPs。
1.3.2 细菌样品制备 取-80℃储存的大肠杆菌、单核增生李斯特菌和肠炎沙门氏菌分别于脑心浸液肉汤(brain heart infusion broth,BHI)中培养过夜(37℃,100 r·min-1),得到的菌液浓度分别约为108、107和107CFU·mL-1。分别取10 mL菌液离心(4℃,4 500 r·min-1, 10 min)去上清液。将细菌沉淀用无菌水洗涤3次,再离心后将沉淀均匀分散在10 mL Au@Ag NPs中。之后将菌液与Au@Ag NPs涡漩混合获得均匀的混合物,静置3~5 min,使Au@Ag NPs和细菌相互吸附。
1.3.3 SERS检测样品制备 取3 μL细菌沉淀与Au@Ag NPs溶液的混合样品滴到石英载玻片上,在样品干燥前使用 LabSpec 6.0软件开始数据采集。样品检测过程中参数设置不变,每个样品检测重复3次,保证数据的准确性。
1.3.4 拉曼光谱检测参数 检测样品前需要先用硅片以520.00 cm-1处的拉曼特征峰为基准进行校正。SERS采集的激光波长为785 nm,激光强度100%,10×目镜,采集时间4 s,累计次数5次,光谱范围200~2 000 cm-1。
1.3.5 Au@AgNPs的分析方法 将上述制备好的Au@Ag NPs稀释一倍后取1 mL放入比色皿中,在波长300~800 nm内进行紫外光谱收集;将基底溶液放入粒度仪干净的料斗中,利用Stokes-Einstein方程计算颗粒粒径及其分布。
1.4 数据分析
使用Origin 9.0软件(OriginaLab公司,美国)对光谱图和数据图进行处理。
2 结果与分析
2.1 Au@Ag NPs的表征
Au@Ag NPs 颗粒的大小和分散性对SERS检测有一定的影响,采用紫外分光光度计和粒度仪表征得到Au@Ag NPs的主要吸收峰位置以及纳米颗粒的粒径分布。由图1-A可知,Au@Ag NPs在396 nm和492 nm处存在吸收峰。由图1-B可知,Au@Ag NPs的平均直径为54±3 nm,且颗粒均匀。Ag NPs对细菌有良好的拉曼增强效应,但Ag NPs稳定性相对较弱[29]。本试验合成得到的Au@Ag NPs比Ag NPs具有更好的稳定性和分散性。因此,理论上本试验合成的Au@Ag NPs可以均匀附着在微生物表面,起到拉曼光谱增强作用。

图1 Au@Ag NPs的紫外吸收光谱(A)和粒径分布(B)
利用透射电子显微镜对Au@Ag NPs及其与细菌偶联后的效果进行表征。由图2-A可知,Au@Ag NPs的核-壳结构特征明显,Au核周围均匀的包裹着Ag壳;由图2-B、C、D可知,纳米颗粒分别与3种微生物混合后,纳米颗粒可以吸附并富集于细菌表面,表明Au@Ag NPs与3种细菌都有较好的偶联效果。因此可以判定Au@Ag NPs适宜用于大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌的SERS检测。

注:合成Au@Ag NPs的TEM图像(A);用Au@Ag NPs包被的大肠杆菌(B)、肠炎沙门氏菌(C)和单核增生李斯特菌(D)的TEM图像。
2.2 食源性致病菌的SERS图谱与结构分析
对细菌与Au@Ag NPs偶联的复合物进行SERS检测,结果如图3所示。在无Au@Ag NPs偶联的情况下,3种细菌的拉曼光谱图未出现任何显著特征峰型(图3-A),而经过Au@Ag NPs偶联的大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌均显示出增强效应的拉曼光谱图,且3种不同细菌的拉曼信号谱峰图之间差异明显(图3-B)。因此,借助Au@Ag NPs与细菌偶联,采用拉曼光谱仪来检测和区分这3种食源性致病菌是可行的。
不同种属微生物之间的细胞表面化学成分组成不同,由图3-B可知,以Au@Ag NPs 为基底,与致病菌耦合,结果显示3种食源性致病菌的拉曼响应谱峰间存在差异。大肠杆菌的主要拉曼特征峰在431、554、689、925、1 073、1 136、1 384、1 502 cm-1处。结合表1中已报道的拉曼光谱位移分配结果,554 cm-1处的拉曼特征峰表示蛋白质的S-S拉伸,925和1 384 cm-1分别是碳水化合物和蛋白质的COO-拉伸;肠炎沙门氏菌的拉曼光谱特征峰位移主要有555、644、726、1 135、 1 389 cm-1, 其中 555 cm-1是蛋白质的S-S拉伸,644 cm-1是氨基酸的C-S伸展,1 135 cm-1是蛋白质的C-N和C-C拉伸,1 389 cm-1属于蛋白质的COO-拉伸;单核增生李斯特菌的主要特征峰是485、556、825、1 026、 1 135、1 382、1 500、1 574 cm-1,其中485 cm-1、556 cm-1属于碳水化合物的特征峰,1 026 cm-1为多糖的C-C环呼吸,1 135 cm-1是呼吸环的存在以及COC的拉伸。由于使用了不同的检测方法,所以这3种致病菌的 SERS指纹图谱与表1中文献报道有所偏差。另外,图3-B 显示3种致病菌的拉曼光谱在555、1 135和1 384 cm-1附近均有响应,是由于蛋白质的C-C、S-S、C-N以及C-O等不同键位的拉伸而具有相似特征峰,但同浓度不同种类微生物条件下的SERS响应峰强度不同;单核增生李斯特菌在1 574 cm-1处具有大肠杆菌和肠炎沙门氏菌均无的特征峰。由此可见,基于Au@Ag NPs基底的偶联效果与拉曼增强效应,可以根据3种微生物的拉曼指纹图谱差异,对上述3种致病菌进行有效检测与区分。

表1 已报道文献中3种食源性病原体的SERS光谱的拉曼位移分配[4,6,15]

图3 3种食源性致病菌原液的SERS图谱(A)以及3种食源性致病菌与Au@Ag NPs 偶联后的SERS图谱(B)
2.3 SERS光谱的重复性试验
为了检验Au@Ag NPs应用于大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌检测的稳定性,制作了5个不同批次的Au@Ag NPs,分别对3种致病菌进行SERS检测。本次试验的大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌的浓度经验证分别为108、107和107CFU·mL-1。由图4可知,偶联5个不同批次的Au@Ag NPs的SERS光谱具有高度的重现性,且大肠杆菌在554 cm-1处的拉曼峰值相对标准偏差(relative standard deviation,RSD)为4.15%,肠炎沙门氏菌在1 384 cm-1处的拉曼峰值RSD为5.86%,单核增生李斯特菌在1 384 cm-1处的拉曼峰值RSD为6.44%。Au@Ag NPs良好的重现性为食源性致病菌的快速SERS检测提供了强有力的支持。
2.4 PCA和HCA分析
考虑到基于相似的振动光谱难以对微生物进行分类和鉴定,采用PCA、HCA分析本研究从细菌样品中获得的SERS图谱。PCA可以在很大程度上降低复杂多变量数据的主成分维数,将复杂的多维空间数据转变为直观可见的分布散点图,客观地捕获相似光谱之间最小光谱差异,判别不同种类之间关系,同时分析比较其相似性。HCA是对研究对象进行先聚类再判断分析,判断研究对象种群之间的相似性与差异性。利用2.3中3种不同致病菌SERS光谱数据进行PCA分析,使用欧式距离 (euclidean distance) 和RStudio构建HCA树状图,评估基于Au@Ag NPs增强基底的3种致病菌SERS图谱的差异性。
PCA分析结果见图5-A,PC1、PC2和PC3的方差贡献率分别为58.39%、20.21%和13.87%,累积贡献率达92.47%。且PCA分析可以很明显地将致病菌归为3类,每种致病菌都能分别与其他2种区分开。大肠杆菌与肠炎沙门氏菌、单核增生李斯特菌分离度较大。HCA分析结果如图5-B,可以看出结果主要分为3个簇,每簇之间各自聚类无交叉干扰。3种致病菌在聚类距离5处可以清晰地被分为3个聚类,肠炎沙门氏菌和单核增生李斯特菌在聚类距离为8处被聚为一类,相对于大肠杆菌,肠炎沙门氏菌与单核增生李斯特菌的SERS特征拉曼光谱较相似,但整体上,3种致病菌的SERS图谱可以通过PCA和HCA进行有效区分。
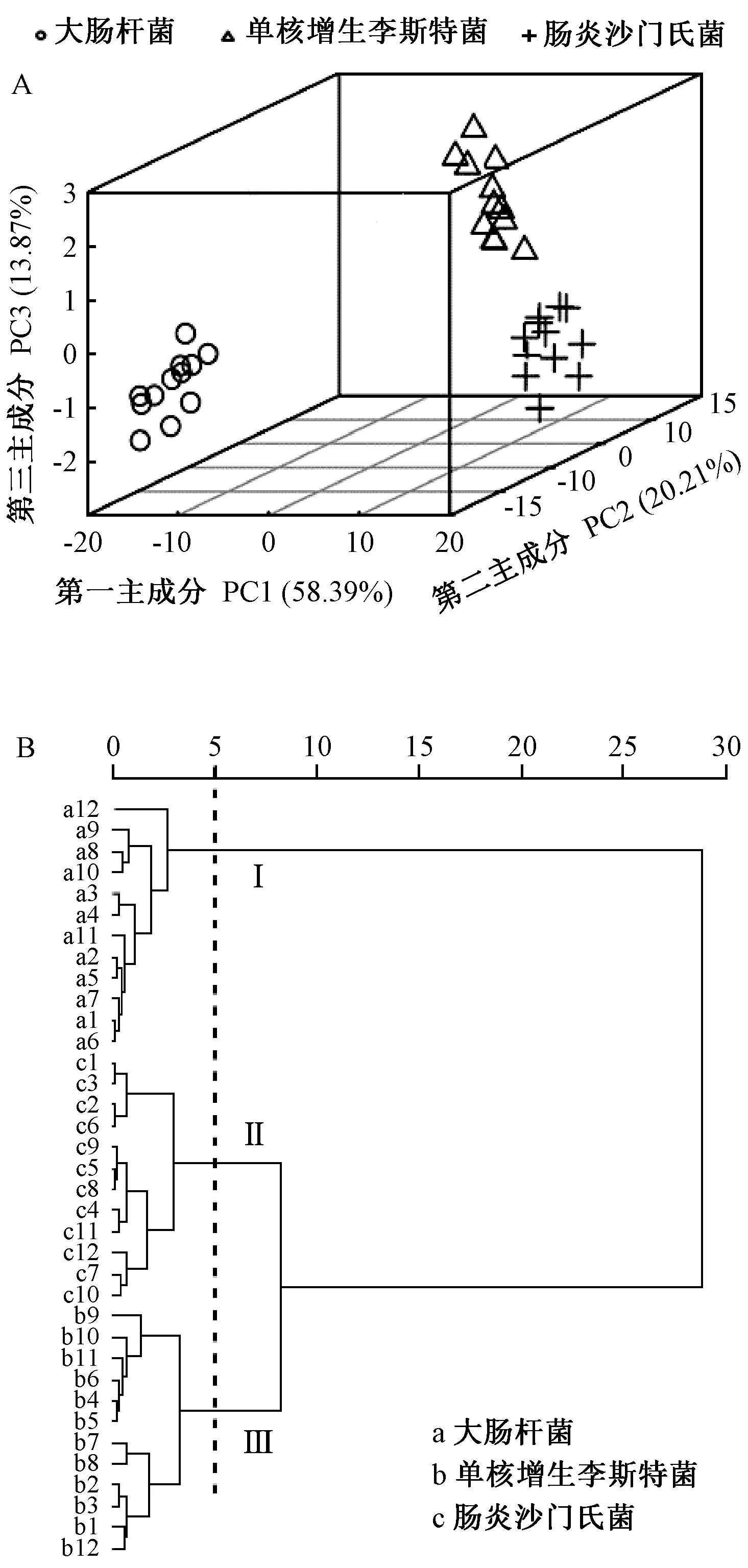
图5 3种食源性致病菌指纹图谱的主成分分析(A)和聚类分析树状图(B)
3 讨论
SERS受不同激光波长、被检物质、增强基底及其之间相互作用的影响,其中基底的增强活性和良好的重现性至关重要。最常用的SERS基底是Au NPs 和Ag NPs[30-32]。其中Au NPs作为增强基底的SERS分析虽然操作简单、检测快速,但其在检测过程中的灵敏度不及Ag NPs[33-35],Ag NPs合成虽简单易操作,但在储存期间容易聚沉影响检测。本研究以合成的Au@Ag NPs作为拉曼增强基底,组合了Au NPs和Ag NPs的优势,针对3种病原微生物,Au@Ag NPs的拉曼增强效果好,重复性和稳定性好。
基于SERS检测病原微生物已经有一些报道,曹伟丽等[36]用合成的SiO2-Au@Ag NPs与大肠杆菌简单混合培养后进行检测,其检测限为105CFU·mL-1;梁爱惠等[37]利用银纳米棒作增强基底,维多利亚蓝B作为染色剂检测大肠杆菌,检测效果略差于曹伟丽等[36]的检测结果;苏永波等[38]利用微波法制备的银纳米溶胶检测大肠杆菌,其SERS结果可以很好地显示大肠杆菌的特征拉曼指纹图谱。因为食源性病原微生物的体积比纳米颗粒大2~3个数量级,且纳米颗粒的大小、组成成分和微生物的附着效果以及微生物表面的物质组成,都会影响SERS的检测效果。本研究制备的Au@Ag NPs与大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌能进行有效耦合,产生各自的特征拉曼光谱,再结合PCA和HCA对特征拉曼光谱进行分析,结果显示能对大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌进行有效的区分。
4 结论
本试验采用两步法合成的Au@Ag NPs基底增强效果好,稳定性高。Au@Ag NPs可以均匀地吸附在大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌的周围;基于 Au@Ag NPs的表面增强作用,拉曼光谱法可以检测到浓度为107~108CFU·mL-1的大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌。PCA和HCA能将大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌的拉曼光谱进行有效区分。因此将Au@Ag NPs作为增强基底,可以采用SERS对大肠杆菌、肠炎沙门氏菌和单核增生李斯特菌进行定性检测。本研究结果为食品微生物安全风险控制及检测提供了一定的理论依据。
