甲磺酸阿帕替尼联合IMRT治疗局部晚期胰腺癌的疗效及对CA19-9、细胞免疫功能的影响
2021-08-11孙岩岩徐晓燕
王 珏,孙岩岩,徐晓燕,韩 震,李 卉
内蒙古自治区人民医院肿瘤内科,内蒙古呼和浩特 010017
2017年美国癌症数据显示,美国胰腺癌的病死率位居恶性肿瘤第4位[1]。2016年中国癌症中心统计数据也显示,胰腺癌发病率呈快速上升趋势[2]。胰腺癌恶性程度高,根治性切除(R0)是最有效的方法,但对于局部晚期胰腺癌患者,手术切除应用受限,同步放化疗成为主要的治疗方法[3-5]。甲磺酸阿帕替尼(简称阿帕替尼)是一类小分子抗血管生成剂,可通过选择性阻断血管内皮生长因子(VEGF)/血管内皮生长因子受体(VEGFR)-2信号通路发挥抗肿瘤作用,已获批用于晚期胃癌或胃食管癌结合部腺癌的二线及以上治疗[6]。前期机制研究证实,阿帕替尼可有效抑制胰腺癌AsPC-1细胞的增殖、迁移,并诱导其凋亡[7]。目前,临床医师对胰腺癌的用药经验尚不丰富,国内外开展类似的研究较少。鉴于此,本研究拟开展阿帕替尼联合调强放疗(IMRT)的探索性研究,以初步了解阿帕替尼与IMRT联合治疗局部晚期胰腺癌患者的有效性和安全性,现报道如下。
1 资料与方法
1.1一般资料 选择2018年6月至2019年6月本院收治的60例局部晚期胰腺癌患者作为研究对象,采用随机数字表法分为观察组和对照组,每组30例。纳入标准:(1)年龄≥18岁,男女不限;(2)经病理学确诊的局部晚期胰腺癌;(3)不能进行手术治疗的局部晚期、复发或一线化疗失败的胰腺癌(接受过含吉西他滨的方案);(4)研究者判断继续化疗不可耐受的患者;(5)美国东部协作肿瘤组(ECOG)体能状况(PS)评分0~1分;(6)预计生存期≥3个月。排除标准:(1)已证实对研究药物过敏者;(2)凝血功能异常,有出血倾向者;(3)伴远处转移的患者;(4)接受过VEGFR抑制剂者。患者均知情同意,本研究经医院伦理委员会审查通过。两组患者的性别、年龄、体质量指数(BMI)、发病部位等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
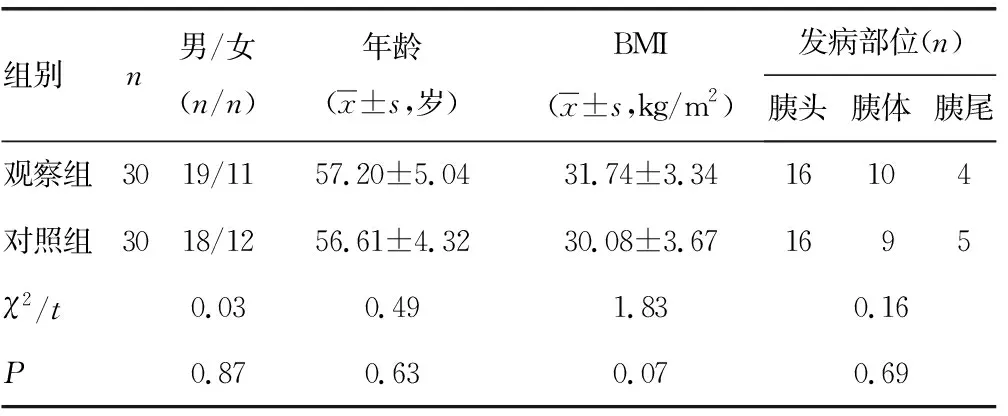
表1 两组患者一般资料比较
1.2方法 对照组:给予IMRT,总剂量60 Gy(30次)。观察组:给予IMRT,总剂量同对照组。从放疗的第1天午餐后30 min 口服阿帕替尼片(恒瑞医药,国药准字H20140103)500 mg,1 次/天,至少服用4周。放疗操作:所有患者均采用热塑体膜固定。患者取仰卧位,双手抱肘置于前额,在治疗体位下进行CT定位扫描,呼气位,扫描范围自膈顶上2 cm至第4椎体下缘。扫描层厚为0.5 厘米/层。将定位图像输送到Pinnacle9.6计划系统进行图像重建,由医师勾画靶区和重要器官如肝、十二指肠、小肠、肾脏、胃和脊髓。采用共面照射和多叶光栏技术,尽量避开十二指肠、小肠、肾脏、胃等重要脏器。采用剂量体积直方图、云图等确定最佳的治疗计划,90%的等剂量曲线包绕计划靶区(PTV),采用医科达直线加速器6MV-X 线照射,2 Gy/fx,5瓦特/次,计划总剂量为60 Gy(30次)。直径较大肿瘤首先给予40 Gy/20 fx,复查后再采用缩野推量放疗至60 Gy。
1.3观察指标 (1)采用全自动电化学发光免疫分析仪于检测两组患者治疗前及治疗后4周血清糖类抗原(CA)19-9水平。(2)采用流式细胞仪检测两组患者治疗前及治疗后4周的CD3+、CD4+、CD8+等免疫功能指标水平变化情况。(3)比较两组患者的疗效。(4)比较两组患者的不良反应发生情况。
1.4判定标准
1.4.1疗效评价 治疗后4周对患者进行X线、增强CT和(或)MRI检查。由同一位影像科医师根据实体瘤疗效反应的评价标准(RECIST)进行判断,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。有效率=(CR例数+PR例数)/总例数×100%,疾病控制率=(CR例数+PR例数+SD例数)/总例数×100%。
1.4.2不良反应评价 根据美国国立癌症研究所的抗癌药物不良反应判断标准(CTCAE)V3.0[8]对不良反应进行评价。
2 结 果
2.1两组患者的疗效比较 观察组的有效率略高于对照组,差异无统计学意义(P>0.05),观察组的疾病控制率明显高于对照组,差异有统计学意义(P<0.05)。见表2。
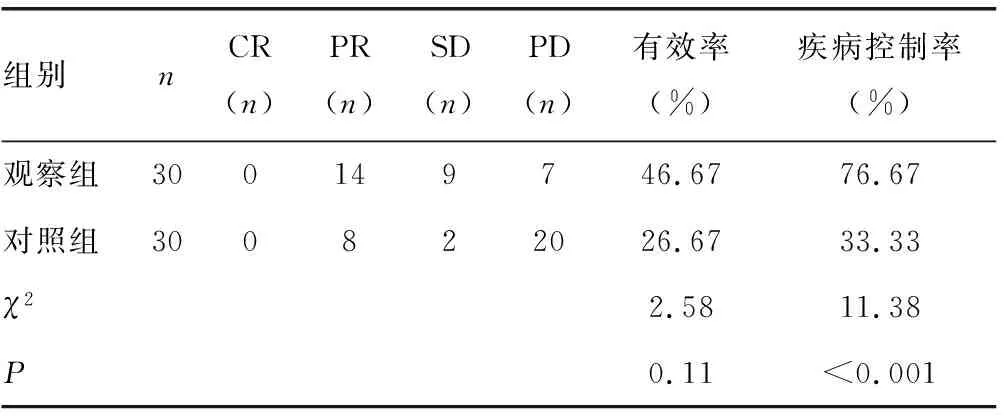
表2 两组患者的疗效比较
2.2两组患者治疗前后血清CA19-9水平比较 治疗前两组患者的血清CA19-9水平比较,差异无统计学意义(P>0.05),治疗后4周两组患者CA19-9水平下降,且观察组明显低于对照组,差异均有统计学意义(P<0.05)。见表3。
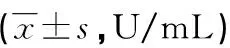
表3 两组患者治疗前后血清CA19-9水平比较
2.3两组患者的免疫功能比较 治疗后4周观察组的CD3+、CD4+、CD4+/CD8+水平较治疗前明显上升,而CD8+水平明显下降,差异均有统计学意义(P<0.05);对照组的CD3+、CD4+、CD4+/CD8+水平略有上升,但明显低于观察组(P<0.05),CD8+水平略有下降,但明显高于观察组(P<0.05)。见表4。
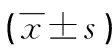
表4 两组患者的免疫功能比较
2.4两组患者的不良反应发生情况比较 两组患者白细胞减少、血小板减少、恶性呕吐、高血压、蛋白尿等不良反应发生率比较,差异无统计学意义(P>0.05)。见表5。

表5 两组患者的不良反应发生情况比较[n(%)]
3 讨 论
胰腺癌是消化系统常见肿瘤,恶性程度高,无法手术切除的局部晚期胰腺癌患者人数约占初诊患者的1/3,中位生存期仅为9个月[9]。胰腺癌对一线化疗药物并不十分敏感,因此放疗是大多数进展期胰腺癌患者的主要治疗手段[10]。随着人们对肿瘤发生、发展和转移过程中分子生物学、分子病理学研究的深入,分子靶向治疗逐渐成为继手术、化疗、放疗后的一种新的治疗手段[11]。晚期肿瘤患者对阿帕替尼的耐受性良好,阿帕替尼联合放疗治疗晚期肺癌、胃癌的研究均已展开[12-13]。目前,国内外较少开展阿帕替尼联合IMRT治疗局部晚期胰腺癌的研究。对于发病率高、恶性程度高、进展快、预后差的胰腺癌,单靠任何一种治疗手段均不能取得满意的效果,多种治疗手段的联合应用是治疗发展的必然趋势。
本研究发现,阿帕替尼联合IMRT可明显改善患者的疾病控制率(P<0.05)。这说明阿帕替尼联合IMRT可使局部晚期胰腺癌患者获益。IMRT减少了放射性不良反应的发生,故近年来逐渐应用于局部晚期胰腺癌的治疗[14]。但在实际应用中,IMRT治疗的患者存在腹痛症状明显、饮食差等问题,故其最大剂量仍未达成共识。阿帕替尼可抑制VEGFR酪氨酸激酶活性,阻断VEGF结合后的信号传导,导致肿瘤血管生成抑制,从而增强胰腺癌对高剂量放疗的敏感性,故观察组的疾病控制率更佳[15]。此外,笔者也观察到对照组的有效率略低于观察组,但差异无统计学意义(P>0.05),这可能与样本量较少有关。
CA19-9是一种酸性糖蛋白,其水平变化远早于影像学结果与临床症状,故早在1979年就已被研究用于胰腺癌的诊断。既往研究证实,血清CA19-9水平的高低是患者的重要预后因素[16]。本研究发现,治疗后4周,两组患者的CA19-9水平均下降,且观察组明显低于对照组,证实帕替尼联合IMRT能有改善患者血清CA19-9水平,对局部晚期胰腺癌患者的预后可能具有积极促进作用。此外,本研究也探讨了患者免疫功能的变化,结果发现,治疗后4周,两组患者的免疫功能均有所改善,且阿帕替尼联合IMRT治疗的患者免疫功能更强。阿帕替尼的抗肿瘤血管生成作用能够改善肿瘤微环境,特别是T淋巴细胞的比例和功能,从而改善患者的免疫功能[17]。
最后,本研究关注并分析了阿帕替尼联合IMRT的安全性,结果证实两组患者的血液学毒性相似,但观察组的高血压、蛋白尿和手足皮肤反应发生率稍高,这主要与阿帕替尼的抗血管生成作用有关[18]。研究过程中未出现新的不良反应,证实阿帕替尼联合IMRT治疗局部晚期胰腺癌患者不会增加不良反应的发生风险,安全可靠。
综上所述,阿帕替尼联合IMRT治疗局部晚期胰腺癌患者可改善患者免疫功能,提升疗效,且安全可靠,值得进一步探讨、研究。
