弓形虫SAG1重组抗体制备及抗原表位鉴定
2021-08-10庄浩瀚潘灵韬姚晨倩陈学秋阳毅敏赵明秀杜爱芳
庄浩瀚,潘灵韬,姚晨倩,陈学秋,阳毅敏,赵明秀,林 蜜,杨 怡,杜爱芳
(浙江大学 动物科学学院 浙江大学动物预防医学研究所 浙江省动物预防医学重点实验室,浙江 杭州 310058)
弓形虫是一种专性寄生于宿主的单细胞寄生虫。其可以感染包括人类在内的几乎所有温血动物,是典型的人畜共患寄生虫[1]。人和动物通过食用未煮熟的食物或者被弓形虫卵囊污染的水而被弓形虫感染。据2019年的报道估计,全世界动物的弓形虫血清阳性率约为25%[2]。弓形虫也是一种机会性致病寄生虫,在免疫力低下的人群中,如(人免疫缺陷病毒HIV)感染者,接受肿瘤化疗的患者,脏器移植患者等,弓形虫感染会直接致死。而且,弓形虫还能通过母婴传播,导致流产、死胎或者新生儿畸形[3]。磺胺嘧啶和乙嘧啶是目前治疗弓形虫病的药物,但只能抑制弓形虫增殖,并不能彻底根除弓形虫[4]。商业化的疫苗暂时只有1个Toxovax,然而仅限于绵羊养殖预防[5]。
弓形虫生物学功能研究是弓形虫病预防治疗的基础。免疫印迹和免疫荧光等试验是研究弓形虫蛋白功能所必须的,这些试验高度依赖于特异有效的抗体。市场化的抗体绝大部分都是针对人源蛋白设计的,无法保证适用于弓形虫蛋白的研究。因此,制备弓形虫蛋白特异性抗体对科学研究来说是不可或缺的。多克隆抗体和单克隆杂交瘤抗体技术已经被广泛运用于抗体制备,然而多克隆抗体,有可能缺乏批次间的可重复性,而单克隆杂交瘤细胞培养过程有污染或者基因突变的可能,导致抗体分泌失效。重组抗体由真核细胞表达已知序列信息的抗体重链和轻链而形成,可以避免多克隆抗体的批次不稳定性和杂交瘤单克隆抗体失效的问题,从而被科研工作者所青睐[6]。目前,弓形虫蛋白抗体大多是多克隆或杂交瘤单克隆抗体,而重组抗体比较少见。本研究利用单个质粒表达抗体重链和轻链,制备了弓形虫SAG1重组抗体,试验结果表明该重组抗体特异性高、批次间可重复性强,而且可重新编辑加入荧光基团,适用于免疫印迹和免疫荧光试验。本研究采用的重组抗体制备方法可为其他蛋白的抗体制备提供借鉴。
1 材料与方法
1.1 虫株、细胞株、感受态细胞及质粒弓形虫RH虫株、Vero细胞、HEK293T细胞、小鼠骨髓瘤细胞SP2/0、TOP10感受态细胞、BL21感受态细胞、pET-32a和pCMV-EGFP表达载体为本实验室保存;重组抗体表达质粒购于Addgene(ID:28217)。
1.2 RNA提取、逆转录试验、凝胶回收和质粒提取弓形虫以及杂交瘤的RNA提取采用Thermo公司TRIzol(15596018)通用提取方法,逆转录过程使用TOYOBO公司逆转录试剂盒ReverTra Ace(FSK-101)。凝胶回收和质粒提取使用杭州尚亚生物公司试剂盒(DR0101250/DR0201250)。具体操作详见试剂和试剂盒说明书。
1.3 SAG1重组蛋白表达纯化及小鼠免疫PCR克隆弓形虫SAG1蛋白序列(45~198 aa),引物详见表1(酶切位点和保护碱基以下划线标注)。将PCR产物和pET-32a质粒用EcoRⅠ和HindⅢ双酶切(TaKaRa,D1040/D1060),切胶回收后通过T4连接酶连接(TaKaRa,D2011),转化BL21感受态细胞后,挑取阳性克隆测序验证连接成功。用Isopropyl β-D-1-thiogalactopyranoside(IPTG)(生工生物,A100487)诱导阳性克隆表达重组蛋白,随后用镍柱纯化蛋白(常州天地人和,SA005),并用BCA试剂盒(杭州弗德生物,FD2001)进行蛋白定量。小鼠免疫过程依照本实验室优化的方法进行[7]。
1.4 杂交瘤融合和筛选免疫后的小鼠于眼眶采血收集少量血液,37℃放置1 h后,4℃、3 000×g离心10 min,收集血清。以SAG1重组蛋白为抗原,通过酶联免疫吸附测定(ELISA)和免疫印迹试验验证血清中抗体的特异性。随后脱颈处死免疫小鼠,获取脾脏细胞与小鼠骨髓瘤细胞进行融合,融合筛选过程参考文献所述[8]。
1.5 克隆杂交瘤的重链和轻链PCR克隆杂交瘤的重链和轻链,引物为文献[9]所用兼并引物。抗体的重链和轻链的恒定区序列已经存在于重组抗体表达质粒,试验过程中,将抗体的重链和轻链的可变区克隆到重组抗体表达质粒, 酶切体系使用AscⅠ和NotⅠ限制性内切酶(NEB,R0558/R3189)。构建过程如图4A所示,具体过程详见参考文献[9]。
1.6 重组抗体表达和验证将重组抗体表达质粒转化TOP10感受态细胞,菌落PCR验证阳性克隆,将阳性克隆扩大培养,抽提质粒。随后,利用Thermo公司的Lipofectamin 2000转染试剂(116-68019)将质粒转染HEK293T细胞,转染24 h后,收集细胞上清,以弓形虫的全虫蛋白为抗原进行免疫印迹试验,同时固定弓形虫细胞,进行免疫荧光试验验证重组抗体的特异性。
1.7 重组抗体抗原表位鉴定利用pET-32a和pCMV-EGFP质粒,构建SAG1重组蛋白表达质粒,其中32A-SAG1为重组蛋白的原核表达体系,EGFP-SAG1为EGFP在C端融合SAG1短肽的真核表达体系。引物详见表1(酶切位点和保护碱基以下划线标注)。将32A-SAG1表达质粒转化BL21感受态细胞,并用IPTG诱导蛋白表达,同时将EGFP-SAG1表达质粒用Lipofectamin 2000转染试剂转染HEK293T细胞,质粒转染细胞24 h后收集细胞样品裂解备用,以32A-SAG1表达菌和EGFP-SAG1重组蛋白表达细胞为蛋白样品,以转染重组抗体质粒的HEK293T细胞培养上清为一抗进行免疫印迹试验。质粒构建引物详见表1。

表1 引物序列信息
2 结果
2.1 SAG1(45~198 aa)重组蛋白原核表达质粒构建以弓形虫的cDNA为模板,通过PCR克隆弓形虫的SAG1蛋白的基因片段序列,获得PCR产物,将PCR产物和pET-32a质粒进行酶切,获得PCR酶切产物约500 bp(图1A)和质粒酶切产物约5 000 bp(图1B),将2个产物用T4连接酶在16℃连接4 h,随后转化BL21感受态细胞,涂布于氨苄LB培养板,在37℃培养箱培养过夜。
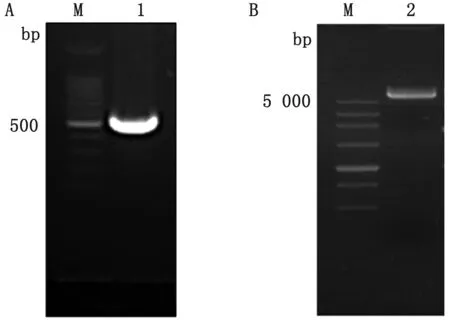
A.SAG1蛋白(45~198 aa)基因片段PCR酶切产物凝胶电泳结果(M.DL100 DNA Marker,1.SAG1(45~198 aa)PCR酶切产物);B.pET-32a质粒酶切产物凝胶电泳结果(M.DL5000 DNA Marker,2.pET-32a质粒酶切产物)
2.2 SAG1(45~198 aa)重组蛋白诱导表达挑取氨苄LB培养板上的克隆,由杭州尚亚生物公司测序验证插入序列。随后将阳性克隆在LB液体培养基中培养到D值约为0.6,加入0.5 mmol/L IPTG培养6 h,诱导蛋白表达。诱导好的大肠杆菌4℃、12 000×g离心10 min,用含10 mmol/L 咪唑的 PBS溶液重悬沉淀后,超声裂解30 min,将裂解产物4℃、12 000×g离心10 min,上清用0.22 μm过滤器过滤后,加入镍柱,4℃孵育2 h后,分别用10,50,100,200,400 mmol/L 咪唑进行洗脱。SDS-PAGE结果显示得到纯化后的蛋白(图2)。用BCA蛋白浓度测定试剂盒测定纯化后的蛋白,按每只小鼠20 μg重组蛋白的剂量免疫BALB/c小鼠。

M.蛋白质相对分子质量Marker;1.10 mmol/L咪唑;2~4.50 mmol/L咪唑;5~7.100 mmol/L咪唑;8~10.200 mmol/L咪唑;11~14.400 mmol/L咪唑
2.3 SAG1杂交瘤构建将免疫好的BALB/c小鼠进行眼眶采血,用免疫印迹验证血清可以识别SAG1(45~198 aa)重组蛋白后,对小鼠进行脱颈处死,取脾脏在200目细胞筛上研磨获取脾脏细胞,与小鼠骨髓瘤细胞SP2/0进行融合,用有限稀释法将融合的细胞培养在96孔板里,在含有次黄嘌呤、氨基喋呤和胸腺嘧啶的培养基(HAT)中进行选择性培养。1周后取培养上清进行ELISA和免疫印迹试验。结果显示克隆1C7可以在ELISA试验(图3A)和免疫印迹试验(图3B)中识别SAG1(45~198 aa)重组蛋白。将克隆1C7杂交瘤扩大培养进行后续试验。

A.杂交瘤克隆ELISA试验结果;B.杂交瘤克隆1C7培养上清免疫印迹结果; M.蛋白质相对分子质量 Marker;1.克隆1C7培养上清免疫印迹
2.4 SAG1重组抗体表达质粒构建将1C7克隆杂交瘤进行RNA提取和逆转录试验,用兼并引物将抗体的重链可变区和轻链可变区克隆到重组抗体表达质粒28217,质粒构建策略如图4A所示,试验对28217质粒进行了改造,在重链恒定区的C端加入mCherry片段,方便后续的细胞转染试验。重链可变区、轻链可变区、linker片段以及融合片段的PCR产物如图4B所示,将融合片段PCR产物和改造的28217质粒用AscⅠ和NotⅠ进行双酶切,用T4连接酶连接,转化TOP10感受态细胞,涂布于氨苄LB培养板上培养。由于杂交瘤自身携带1条异常轻链序列,我们用菌落PCR将大肠杆菌克隆进行区分,正常轻链引物能在全部克隆中扩增到500 bp左右的PCR产物(图4C),异常轻链引物能在部分克隆中扩增到500 bp左右的PCR产物(图4D),将异常轻链引物可扩增到条带的克隆被排除,无扩增条带的克隆被保存,扩大培养,提取质粒。

A.质粒构建策略图;B.重链可变区、轻链可变区、linker片段以及融合片段的PCR产物凝胶电泳结果(M.DL5000 DNA Marker,1.重链可变区PCR产物,2.轻链可变区PCR产物,3.linker片段PCR产物,4.1~3融合片段PCR产物);C.正常轻链PCR产物凝胶电泳结果(M1.DL100 DNA Marker,5~28.菌落PCR由正常轻链可变区引物扩增的PCR产物);D.异常轻链PCR产物凝胶电泳结果(29~52.菌落PCR由异常轻链可变区引物扩增的PCR产物)
2.5 SAG1重组抗体验证阳性克隆质粒抽提后,以1 μg质粒加上3 μL转染试剂的比例转染HEK293T细胞,由于重组抗体表达质粒带有mCherry基团,转染效率可以通过荧光显微镜直接观察(图5A)。我们随机选择了7个阳性克隆的重组抗体表达质粒进行细胞转染,转染24 h后,收取细胞培养上清,以弓形虫全虫蛋白做免疫印迹试验,结果显示7个克隆中,有6个克隆能够识别约为35 kDa 大小的蛋白(图5B)。同时,免疫荧光试验显示,通过甲醇固定后,重组抗体定位在弓形虫细胞外围,符合SAG1的定位情况(图5C)。由于重组抗体重链C端连有mCherry基团可以直接发出荧光,试验过程并不需要荧光二抗的参与。
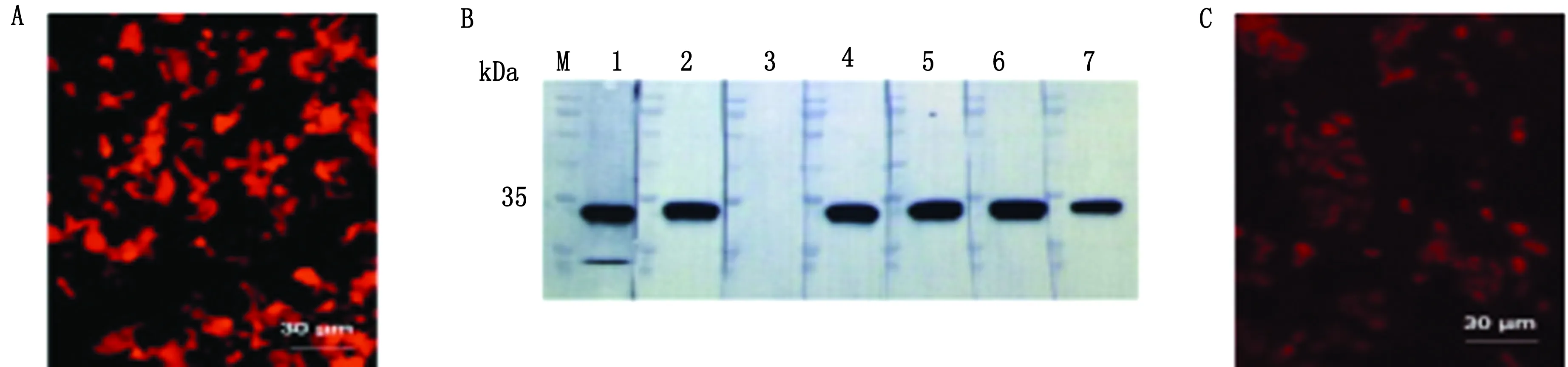
A.重组抗体质粒转染HEK293T细胞免疫荧光结果;B.转染重组抗体质粒HEK293T细胞培养上清免疫印迹结果(M.蛋白质相对分子质量Marker,1~7.7个重组抗体质粒克隆的免疫印迹结果);C.转染重组抗体质粒HEK293T细胞培养上清的弓形虫免疫荧光结果
2.6 重组抗体抗原表位鉴定利用pET-32a和pCMV-EGFP质粒,构建SAG1重组蛋白表达质粒,首先,将重组蛋白45~198 aa分为3个片段构建到pET-32a质粒进行表达(图6A),结果显示只有45~98 aa能够被重组抗体识别;其次,将45~98 aa 再分为3个片段构建到pCMV-EGFP质粒进行表达(图6B),结果显示只有81~98 aa能够被识别;再次,将81~98 aa分为15个片段构建到pCMV-EGFP质粒进行表达(图6C),明确重组抗体识别抗原N和C端位置分别为84和90 aa; 最后通过抗原N和C端各缩短1个氨基酸(图6D),确认重组抗体的抗原表位为SAG1(84~90 aa)的7个氨基酸。
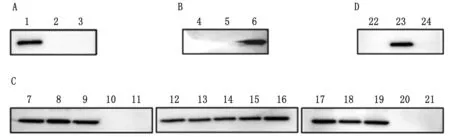
A.重组蛋白(45~198 aa)[1~3.32a-SAG1(45~98 aa)、32a-SAG1(99~144 aa)、32a-SAG1(145~198 aa)];B.重组蛋白(45~98 aa)[4~6.EGFP-SAG1(45~62 aa)、EGFP-SAG1(63~80 aa)、EGFP-SAG1(81~98 aa)];C.重组蛋白(81~98 aa)[7~11.EGFP-SAG1(82~98 aa)、EGFP-SAG1(83~98 aa)、EGFP-SAG1(84~98 aa)、EGFP-SAG1(85~98 aa)、EGFP-SAG1(86~98 aa),12~16.EGFP-SAG1(81~97 aa)、EGFP-SAG1(81~96 aa)、EGFP-SAG1(81~95 aa)、EGFP-SAG1(81~94 aa)、EGFP-SAG1(81~93 aa),17~21.EGFP-SAG1(81~92 aa)、EGFP-SAG1(81~91 aa)、EGFP-SAG1(81~90 aa)、EGFP-SAG1(81~89 aa)、EGFP-SAG1(81~88 aa)];D.重组蛋白(84~90 aa)[22~24.EGFP-SAG1(85~90 aa)、EGFP-SAG1(84~90 aa)、EGFP-SAG1(84~89 aa)]
3 讨论
多克隆抗体来源于动物血清,尽管可以通过纯化IgG来尽量减少其他组分的影响,但并不能排除非特异IgG的影响,所以依然具有较高的非特异性,而且也无法用于一些需要明确具体抗原表位信息的试验,比如夹心法ELISA试验,需要识别同一个抗原上2个不同表位的抗体。因此多克隆抗体非特异性概率较高,应用局限性较大。单克隆杂交瘤细胞,理论上分泌的抗体只能识别1个抗原表位,然而,有研究表明超过30%的单克隆杂交瘤细胞会额外分泌多余的抗体重链和轻链,由于抗体是由2条重链和2条轻链结合而成,任何多余的重链和轻链都会造成抗体组成的多样化,由此造成单克隆抗体的品质下降或者引起非特异性。造成杂交瘤细胞分泌多余抗体重链和轻链的原因可能有:(1)杂交瘤筛选失误,多个杂交瘤集合被误以为只有1个杂交瘤;(2)骨髓瘤细胞融合了多个脾脏细胞;(3)脾脏细胞在体外融合和筛选过程中对抗体表达序列进行重新排列等[10]。重组抗体由表达重链和轻链的质粒转染真核细胞表达而来,表达重链和轻链的序列信息都是明确的,生产抗体的真核细胞不会产生多余的重链和轻链。而且质粒相较于杂交瘤,不存在细胞污染无法复苏等缺点,可以长期稳定保存,随取随用。因此,重组抗体具有极高的特异性和稳定性。
本试验制备了弓形虫SAG1杂交瘤细胞,通过兼并引物进行PCR将SAG1的重链和轻链克隆到重组抗体表达质粒,并在重链的C端插入mCherry荧光基团,使得重组抗体不仅可以应用于免疫印迹试验,还可以在免疫荧光试验中直接标记弓形虫。本试验制备重组抗体的方法简便有效,过程无需大型仪器,能够在基础试验平台开展,适用于绝大多数实验室。
弓形虫感染诊断目前大部分依靠酶联免疫吸附检测方法(ELISA),该方法主要使用弓形虫表面抗原蛋白(SAG)或者排泄分泌物蛋白(ESA)来检测弓形虫感染后产生的抗体[11-12],但是该方法不适用于新生儿感染和免疫缺陷或抑制患者(艾滋病毒HIV患者和器官移植患者),因为新生儿免疫系统发育尚未成熟,难以形成弓形虫抗体,而免疫缺陷患者的免疫系统遭到破坏,抗体生成系统紊乱。在这2种情况下,运用弓形虫特异抗体,比如SAG1抗体,可以通过免疫印迹或者dot-ELISA方法对患者进行诊断[13]。不同亚型弓形虫的SAG1蛋白相对保守,虽然SAG1蛋白只占弓形虫全部蛋白的3%左右,但是弓形虫感染动物产生的血清中有大概50%的抗体识别SAG1[14],因此,SAG1是诊断弓形虫感染的良好指标。本试验鉴定了SAG1重组抗体识别的抗原表位,明确的表位信息使得该重组抗体有望成为弓形虫诊断研发的候选工具抗体。
