单增李斯特菌内化素家族蛋白的研究进展
2021-08-10陈绵绵程昌勇宋厚辉
蓝 莹,陈绵绵,程昌勇,宋厚辉
(浙江农林大学 动物科技学院 动物医学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室 动物健康互联网检测技术浙江省工程实验室,浙江 杭州 311300)
1 单增李斯特菌概述
单核细胞增多性李斯特菌(Listeriamonocytogenes),简称单增李斯特菌,是一种重要的食源性病原微生物,广泛分布于自然界中,包括土壤和水源等环境[1]。单增李斯特菌可以穿过胃肠道屏障进入血液,引起胃肠炎、败血症和脑膜炎等病症,孕妇感染时,单增李斯特菌可以穿过胎盘屏障从而导致流产、早产以及胎儿畸形[2-3]。全世界范围内多次发生人感染单增李斯特菌而死亡的案例,该菌感染后死亡率可以达到30%[4]。近10年来,在我国22个省份的759个案例中死亡率达到18%,在新生儿中的致死率更高达73%[5]。因此,单增李斯特菌致病机制的研究对于该病原的防制具有重要意义。
2 单增李斯特菌感染机制
单增李斯特菌能够感染多种宿主,包括人、小鼠、兔子和鸟类等多种生物[6]。单增李斯特菌能够感染吞噬细胞和非吞噬细胞,并在细胞内增殖。单增李斯特菌感染吞噬细胞时,吞噬细胞被激活,而后通过“Trojan horse”效应将细菌送到不同的组织和器官[7-8]。单增李斯特菌感染宿主非吞噬细胞时,毒力主要受PrfA调控,也会受到SigB调控的影响[9]。单增李斯特菌主要毒力基因(prfA-plcA-hly-ActA-plcB)组成的毒力岛(LIPI-I)[10]和内化素A、内化素B(InlA、InlB)感染宿主非吞噬细胞时发挥着主要作用[11]。单增李斯特菌利用其表面蛋白InlA和InlB分别与宿主细胞表面的E-钙黏蛋白(E-cadherin)和肝细胞生长因子(Met)黏附结合后通过胞吞方式侵入宿主细胞[12]。进入宿主细胞的细菌被细胞膜包裹形成吞噬体,此时细菌分泌溶血素LLO,并协同磷脂酶A(PlcA)和磷脂酶B(PlcB)溶解吞噬泡,成功逃逸到细胞质[13]。单增李斯特菌在胞质内利用细胞营养进行增殖,同时表面蛋白ActA募集肌动蛋白丝actin形成“彗星状”尾部[14],在细胞质内运动并在细胞膜上形成突起,这使单增李斯特菌完美逃脱先天免疫从而引起邻近细胞的持续性感染[15]。
3 内化素家族蛋白分类
内化素家族蛋白在单增李斯特菌侵袭宿主非吞噬细胞的过程中发挥重要的作用[16]。除了InlA、InlB、InlC、InlP和InlK外,大部分内化素蛋白的功能尚不清楚(表1)[17]。单增李斯特菌内化素家族蛋白是一组富含亮氨酸重复区域(LRR),N端含有信号肽的蛋白质[16]。LRR是蛋白互作的多功能结合基序,存在于各种参与信号转导和细胞黏附过程的蛋白[18]。根据内化素蛋白的C末端一级结构的不同可将其分为3类:含有LPXTG结构的内化素、含有GW/WxL结构的内化素和分泌型内化素[19]。

表1 内化素家族蛋白研究进展
3.1 含有LPXTG结构的内化素含有LPXTG结构的内化素蛋白一共有19种,包括InlA、InlK、InlE、InlF、InlG、InlH、InlI、InlJ、InlL、Lmo1136、Lm-o0610、Lmo1289、Lmo0514、Lmo0331、Lmo0732、Lmo0801、Lmo0171、Lmo2396和Lmo0327(图1)。这类内化素C末端由LPXTG结构、疏水基团和带正电荷的尾部组成分选信号[16]。单增李斯特菌有2种分选酶:SrtA和SrtB,与InlA的LPXTG基序发挥作用的主要是SrtA,SrtA识别并裂解含有LPXTG基序的蛋白底物的分选信号,裂解产生的苏氨酸羧基与肽聚糖的前体脂质Ⅱ连接,再通过生物合成机制连接在细菌表面[32]。InlH/J/K也可以被StrA识别,并以共价键的形式结合于肽聚糖上,其他含有LPXTG结构的内化素目前还不清楚具体是通过什么方式固定在细胞壁上[33]。
3.2 含有GW/WxL结构的内化素含有GW/WxL结构的内化素有2种:InlB和Lmo0549(图1),这2种内化素都通过非共价键的形式结合在细菌细胞壁[34-35]。InlB有3个以甘氨酸和色氨酸为起始的含80个氨基酸重复序列的GW结构[35],GW结构与磷壁酸结合,并且磷壁酸的糖基化作用将蛋白更好地锚定于细菌细胞壁表面[36]。除了InlB,单增李斯特菌还有其他8个包含有GW结构的蛋白,其中自溶素Ami和Auto也是与细胞黏附侵袭相关的蛋白[35,37]。Lmo0549蛋白是含有WxL结构的内化素[38]。WxL结构属于Csc家族,单增李斯特菌基因组中有2组Csc基因簇,含有WxL结构的蛋白有4个,但只有Lmo0549含有LRR区并被认为是内化素家族蛋白[39]。含有WxL结构的蛋白通过与肽聚糖相互作用结合在革兰阳性菌的细胞壁上[38]。其他菌种,如粪肠球菌中,缺失含有WxL结构的内化素家族蛋白ElrA能使细菌在巨噬细胞以及小鼠模型中的定殖能力显著下降[40]。但是目前Lmo0549结构和功能尚不清楚,含有WxL结构蛋白的共性及特性还需要继续研究。
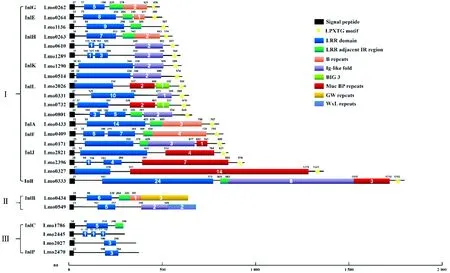
Ⅰ.含有LPXTG结构的内化素蛋白;Ⅱ.含有GW/WxL结构的内化素蛋白;Ⅲ.分泌型内化素蛋白
3.3 分泌型内化素InlC在细胞上无法锚定,是分泌型内化素的一种,其对细菌的黏附侵袭来说不是必要的,但是能够促进单增李斯特菌侵袭邻近细胞时细胞膜突起的形成以及帮助细菌逃避宿主先天免疫反应[28,41]。InlP、Lmo2027和Lmo2445也被认为是分泌型内化素(图1)。最近报道InlP对促进单增李斯特菌进入胎盘屏障有重要作用[31]。
4 内化素家族蛋白的功能
4.1 内化素家族蛋白在黏附侵袭中的作用InlA蛋白是内化素家族的重要成员,在李斯特菌黏附侵袭进入细胞过程中起着重要的作用[42],InlA是第1个被发现含有LRR序列和LPXTG结构的表面蛋白[43]。当前体蛋白在细胞质中合成之后,N端在信号肽的作用下分泌出胞外,然后信号肽被切除,而C端由于有疏水区域和带正电荷的尾部而被留在细胞膜中,这时分选基序LPXTG被分选酶共价结合到细胞壁上[44],LRR序列与宿主细胞的受体E-钙黏蛋白胞外结构域中的第16位脯氨酸特异性结合,介导细菌进入上皮细胞的内化作用(图2)[19,24-45]。E-钙黏蛋白主要在胃肠道上皮细胞中存在,比如杯状细胞[25,46]。其他钙黏蛋白,如N-钙黏蛋白被发现在许多恶性肿瘤中异常表达,对癌症的靶向治疗的提供新的认识[47]。E-钙黏蛋白作为细胞受体与InlA结合,然后脂质筏使E-钙黏蛋白聚集,胞质中E-钙黏蛋白尾部被宿主激酶Src磷酸化和泛素连接酶Hakai泛素化,从而调节肌动蛋白成核剂Arp2/3招募肌动蛋白使细胞细胞膜结构改变[48-49]。这种“触发机制”引起的吞噬泡促使单增李斯特菌通过胃肠道屏障甚至胎盘屏障[50]。研究发现李斯特菌黏附蛋白LAP能够介导细菌侵入肠道屏障,并且这可能给InlA介导细菌侵入肠道屏障的提供一个重要条件[51]。
GW型内化素InlB在单增李斯特菌的感染中也发挥着重要作用,能够帮助单增李斯特菌侵入大部分细胞,包括肝细胞和非上皮细胞[44]。GW基序以非共价键的形式作用于细菌的细胞壁从而将InlB锚定在细胞壁上。InlB能够与宿主细胞表面的糖胺聚糖(GAGs)、补体成分Clq受体(gClqR)和Met等结合并介导李斯特菌入侵宿主细胞[52-54]。InlB通过LRR区域的凹面与Met结合,引起Met瞬时磷酸化[55],招募并磷酸化接头蛋白Cbl、Gab1、Shc和CrkⅡ,然后激活PI3激酶(PI3K)[56]。接头蛋白Cbl也显示泛素连接酶活性,可促进Met泛素化,从而调节Arp2/3、肌动蛋白解聚因子cofilin、LIM激酶以及GTPase Rac1参与InlB依赖途径所需的细胞骨架重排,进而促进InlB依赖的单增李斯特菌进入靶细胞[57-58]。InlB从细菌表面脱离后,其C端GW结构与受体GAGs和gClqR相互作用,N端LRR与Met互作并导致细胞质中Met的尾部被泛素化修饰(图2),展示了细胞入侵过程中InlB的氨基和羧基末端结构域之间的协同作用[7,59]。
胎盘滋养层细胞能够表达E-钙黏蛋白和Met,因此认为InlA和InlB对细菌跨过胎盘的屏障发挥作用[60]。在胎盘组织中,PI3K不能自主激活,而InlA介导的内化作用需要PI3K活性,所以InlA需要InlB激活PI3K使单增李斯特菌进入并感染胎盘[60],但是InlA/B对细菌通过胎盘屏障的作用一直存在争议[61]。InlA能够介导单增李斯特菌入侵BeWo细胞系和人胎盘原代滋养细胞(PHTs),但是在怀孕的豚鼠和能够正常表达E-钙黏蛋白的转基因小鼠中InlA/B介导细菌侵入胎盘作用不显著[62-63]。E-钙黏蛋白在人胎盘合胞滋养细胞顶端层表面表达水平低,且母体血液对细菌有高度的抵抗力,所以细菌不能通过浸泡于母体血液的合胞滋养细胞侵入胎盘屏障[64]。而绒毛外滋养细胞能够大量表达E-钙黏蛋白,是感染的主要突破口,细菌从绒毛外滋养细胞突破,随后感染胎盘[65]。
近来发现InlF在单增李斯特菌感染细胞、组织特别是通过血脑屏障发挥关键作用。Rho-相关蛋白激酶(ROCKs)抑制剂被发现能增强细菌对细胞系的黏附侵袭和组织定殖能力,在inlF缺失情况下,其介导侵袭小鼠细胞系和小鼠器官的定殖能力下降;并且感染了不表达InlF蛋白突变菌的小鼠,其大脑定殖的细菌数量比野生菌要显著减少,但在其他脏器中无显著变化,说明InlF对细菌定殖在大脑具有特殊作用[26,66]。波形蛋白在间充质细胞和各种脑细胞表面中广泛表达,能够调节细胞黏附、细胞外迁移和细胞信号传导[67-68]。InlF能与波形蛋白互作,介导单增李斯特菌与大脑内皮细胞的黏附,给细菌感染大脑提供了必要条件,在波形蛋白缺失情况下,单增李斯特菌在大脑定殖能力显著受损[26]。这表明细胞表面波形蛋白与InlF互作对细菌在大脑定殖的重要性。除了InlF,InlA和InlB在侵入血脑屏障时也可能发挥作用,在感染人上皮脉络丛乳头状瘤(HIBCPP)和脑微血管内皮细胞系(HBMEC)时,inlA和inlB缺失株黏附侵袭能力显著下降;然而有一些内化素基因表现出相反的作用,当inlGHE基因簇中某一基因缺失时,InlB介导的细菌对HBMEC的黏附侵袭能力增强[69-71]。
4.2 内化素家族蛋白在免疫中的作用InlB与Met相互作用除了在细菌黏附侵袭中起到关键作用,还刺激宿主的PI3K、AKT、MAPK(MAP激酶)等多个信号通路的激活[72]。在小鼠巨噬细胞中,PI3K和AKT可通过IKKα激活NF-κB[73-74]。 InlB还可通过其诱导激活的PI3K/AKT通路,通过宿主IPO7(输入蛋白7)和PPM1A/PPM1B(蛋白磷酸酶1A/1B)在S25(丝氨酸25)处的去磷酸化,使SIRT2(去乙酰化酶Sirtuin 2)与染色质结合并触发组蛋白H3在赖氨酸18(H3K18)处的特异性去乙酰化(图2)[75-76]。H3K18去乙酰化使SIRT2在基因启动子上富集,并引起宿主基因转录被抑制,如在调节免疫反应中发挥作用(lef1和cxcl12)[75]。
当单增李斯特菌感染细胞时,细胞膜上TLR(Toll样受体)识别信号,再通过MyD88(骨髓分化初级响应因子88)、IRAK(IL-1R相关激酶)、TRAF6(TNF受体相关因子6) 和TAK1(TGFβ-活化激酶1)将信号传播到IκB激酶(IKKα/IKKβ)组成的NEMO(NF-κB基本调制器),激活NF-κB并将其转移到细胞核,启动促炎细胞因子和其他基因转录参与免疫反应[77]。当单增李斯特菌成功在宿主细胞内定殖时,InlC能够大量表达,帮助逃逸宿主的先天性免疫[78]。IKKα是IκB激酶复合物的1个亚基,InlC可与IKKα相互作用使IκB磷酸化减弱并延迟其降解,从而削弱NF-κB移动至细胞核和抑制NF-κB调控基因的激活,因此宿主的先天性免疫反应减弱[28](图2)。InlC第224位的赖氨酸被泛素化修饰后,能够与警报蛋白S100A9互作,S100A9蛋白是先天性免疫反应和炎症过程的关键蛋白。在小鼠试验中,接种表达被泛素化修饰的InlC突变菌后中性粒细胞产生的活性氧增加,并限制李斯特菌感染,因此泛素化修饰的InlC和与S100A9蛋白的互作可使宿主免疫应答能力增强[29]。

图2 几种内化素蛋白的作用示意图[75-77,82-83]
InlK和InlA一样是拥有LPXTG结构的表面蛋白,被StrA识别而固定在细胞壁上。在体外培养环境中InlK很少表达,但是当单增李斯特菌在体内环境时,InlK表达上调,并与穹窿蛋白MVP互作[21,79]。已知ActA能够逃避自噬感染并临近细胞[80],InlK也能帮助单增李斯特菌逃避宿主自噬,但其方式和ActA不同,在一定程度上,2种逃避自噬的方法存在协同作用[21]。当ActA和InlK在体内同时表达时,虽然InlK先招募MVP于细菌表面,但是Actin会取代MVP并聚集在细胞表面,使李斯特菌发挥ActA介导的逃避自噬作用[80]。但是当ActA蛋白缺失时,InlK和MVP互作,使MVP聚集在细菌表面,帮助细菌逃避自噬[22]。
InlH蛋白受到sigB调控,在外界应激压力作用下,InlH能在单增李斯特菌表面大量聚集[81]。InlH的失活会增加感染小鼠肝脏和脾脏中IL-6(白介素-6)的产生。但是在体外,InlH不调节巨噬细胞中IL-6的分泌。由此猜测InlH可能在其他分泌IL-6的免疫细胞中发挥作用,通过缓和炎症反应促进病原体在组织中的生存[20]。
4.3 内化素家族蛋白在细菌迁移中的作用单增李斯特菌通过InlA/B内化作用进入细胞,再以肌动蛋白为基础在细胞和组织中传播。InlC可以和哺乳动物接头蛋白Tuba互作促进单增李斯特菌在细胞间的感染[84]。Tuba是有多功能域的支架蛋白,能与其效应因子N-WASP和CDC42形成张力复合体,InlC竞争性抑制N-WASP和Tuba的羧基末端Src同源性3(SH3)结构域之间的相互作用,因此细胞连接处皮质张力减弱,单增李斯特菌突起的形成能力加强从而促进细菌在细胞间的传播[85]。InlC还能和Exo70互作,介导Exo70在细菌突起中的聚集[41]。Exo70是宿主细胞外囊复合体的组成蛋白之一,外囊复合体能够直接促进突起的延长。Exo70能在野生单增李斯特菌突起中大量聚集,但是在inlC缺失菌株的突起中显著减少,并使细菌细胞间感染能力下降[41]。
近年来发现InlP是胎盘感染的关键毒力因子。InlP能够极大地促进单增李斯特菌感染胎盘,在人原代胎盘器官培养环境和滋养细胞内inlP基因缺失菌株的生长能力减弱[31]。研究发现InlP能够和afadin相互作用,afadin和能与InlC特异性互作的Tube蛋白都是细胞间连接相关蛋白,但是与InlC促进单增李斯特菌在细胞间单层水平感染不同,InlP与afadin互作引起细菌在胎盘的垂直感染[30]。单增李斯特菌inlP缺失株不能使Actin聚集,在细胞膜上无法形成突起,因此不能感染临近的细胞,类似的情况在单增李斯特菌缺失掉InlP的LRR5 结构时可以观察到,说明InlP的LRR5结构为其与afadin相互作用的关键位点[30]。这种情况可能是InlP-afadin相互作用调节了宿主细胞基面组织的性质,或者与基底膜相互作用,这种活性促进了细菌在细胞基底膜形成以Actin为基础的突起,并垂直感染胎盘组织[30]。
4.4 内化素家族蛋白在生物被膜形成中的作用细菌生物被膜是由细菌微生物及其表达产物构成的附着于物体表面的结构,它能够更好地帮助细菌抵御环境中温度、pH值和盐离子浓度等变化带来的各种压力[86]。例如,在生物被膜中的单增李斯特菌对消毒剂和食品防腐剂等的耐受能力显著增强[87]。一些单增李斯特菌蛋白已被证实会对其生物被膜形成产生影响,如鞭毛蛋白、PrfA和InlA/B等部分内化素家族蛋白[88-89];单增李斯特菌中InlL和InlK蛋白不表达也会减弱其生物被膜的形成能力[23,90]。在生物被膜的形成过程中不同内化素发挥不同功能,在生物被膜形成初始阶段,InlA/B能够帮助单增李斯特菌在物体表面的附着,从而促进生物被膜形成[88],而InlC在成熟的生物被膜中大量表达[91]。
4.5 内化素家族蛋白在细菌运动性中的作用单增李斯特菌的运动性能促进其对宿主细胞的侵袭[92],并在小鼠模型中增加其毒力[93]。细菌的运动性由菌体表面鞭毛提供,鞭毛是分布在菌体外表面的丝状蛋白复合物,鞭毛蛋白结构基因flaA的转录与鞭毛蛋白的存在直接相关[7,16,94]。在30℃培养的inlA缺失株入侵Caco-2细胞的能力比37℃时强,说明鞭毛蛋白在侵入宿主细胞时可能起到重要作用;并且inlA/flaA双基因缺失株比inlA、flaA单基因缺失株在30和37℃时对Caco-2的侵袭能力减弱,说明 InlA和FlaA蛋白在单增李斯特菌侵袭作用中存在显著的协同作用[95]。
5 展望
单增李斯特菌内化素家族蛋白在单增李斯特菌致病性中发挥着重要的作用,但是除了InlA和InlB的致病机制已经被详尽报道外,其他内化素家族蛋白成员在单增李斯特菌致病机制中的实际发挥出的作用仍远未被了解[71]。虽然内化素的主要功能是在帮助单增李斯特菌感染宿主细胞的黏附侵袭过程中发挥作用,例如InlA和InlB;但是内化素在其他功能方面也发挥着不同的作用,比如InlK,其和InlA两者在结构上同为含有 LPXTG基序的表面蛋白,但是在细菌的致病机制中发挥的功能大不相同,前者的主要作用是帮助细菌逃避自噬,而后者主要功能为黏附侵袭。因此,我们还需要对内化素家族蛋白进行更多的探索,以期进一步了解内化素在单增李斯特菌致病性中的作用。
