双配体CuFe@MOFs材料为前驱体的催化剂的组分调控对CO2加氢制C2+醇性能的影响
2021-08-10温月丽范鹤鸣宋镕鹏张维中
张 倩 温月丽*, 王 斌 范鹤鸣 杨 晨 宋镕鹏 张维中 黄 伟*,,3
(1太原理工大学环境科学与工程学院,太原 030024)
(2省部共建煤基能源清洁高效利用国家重点实验室,太原 030024)
(3山西太原理工煤转化技术工程有限公司,太原 030024)
0 引言
人类对化石燃料的过度依赖不仅导致能源短缺,还引发了因CO2过度排放所带来的一系列环境问题[1-2]。CO2减量化、资源化利用已引起国际社会的广泛关注[3-4]。习近平总书记在2020年召开的联合国大会上也倡导通过“人工碳汇”实现“碳中和”目标。
CO2催化加氢转化为燃料或其它高附加值化学品,是固定化、资源化利用CO2的经济有效的途径,可以实现“资源—CO2—资源”的可持续循环利用,具有重要的战略意义[5-7]。相比于甲醇,加氢产物中的C2+醇合成需要同时控制CO2还原和碳链的增长[8-9],更具有挑战性。
当前制约CO2加氢合成C2+醇工业化的因素主要是催化剂催化效率低、寿命短、稳定性差等问题。在催化剂的研究中,改性费托催化剂[10-11]因原料易得、价格低廉颇受关注。其中,相比于稳定性差、醇选择性低的CuCo催化剂,CuFe双组分催化剂更具催化优势,因为其中的Fe可以同时催化逆水煤气变换(RWGS)和费托合成(FTS)反应[12],Cu 既能活化 H2又对CO非解离插入具有活性。然而,铜活性组分在高温加氢条件下容易发生迁移,引起颗粒团聚、烧结[7],导致催化剂活性和稳定性差[13],在一定程度上阻碍了CuFe基催化剂的应用。目前的研究均集中于引入载体或助剂以期提高金属的分散性、相互作用、酸碱性进而提高其催化性能[14-16],而载体、助剂的使用不仅提高了成本也增加了实验的难度和不可控因素。
金属−有机框架化合物(meta1-organic frame-works,MOFs)是以金属离子或金属簇作节点、以有机配体作连接体,通过两者间某一种或多种作用力组装成的周期性多孔结构[17]。这种结构可以将活性金属均匀分散[18],焙烧后有效地防止了活性组分的烧结团聚,同时配体也会对双活性位点的协同作用、催化剂表面酸碱性调节[19]产生一定作用。因此本课题组前期尝试了引入MOFs结构来改善催化剂的稳定性和C2+醇产物选择性,研究发现,配体在氮气气氛焙烧后可得到均匀分散的低价金属氧化物或碳化物,一定程度上避免了活性金属的烧结,但由于制备方法是将Cu浸渍到MIL-88B(Fe)结构中,没有实现2种活性金属均固定在MOFs骨架中。为了进一步将2种活性金属同时固定在MOFs材料骨架,并引入碱性配体来提高CO2的活化性能,探索MOFs材料配体组成及比例对催化剂表面活性物种分布以及其在CO2加氢制C2+醇反应中的活性关联和制约机制,我们以硝酸铜、硝酸铁为金属源,尝试通过在MIL-88B(Fe)前驱体制备过程中引入第二种配体对氨基苯甲酸(p-ABA),并通过改变对苯二甲酸(PTA)和对氨基苯甲酸的比例来调控催化剂表面Fe物种的组成,进而考察表面组成与催化活性间的关联因素。
1 实验部分
1.1 实验原料
硝酸铜(Cu(NO3)2·3H2O)、硝 酸 铁 (Fe(NO3)3·9H2O)、无水氢氧化钠(NaOH)、N,N-二甲基甲酰胺(DMF)购自天津市科密欧化学试剂有限公司;甲醇购自天津市汇杭化工科技有限公司;PTA、p-ABA购自美国Sigma-A1drich公司;蒸馏水(DI)购自太原理工大学中试基地(pH≈7);石英砂(SiO2)购自天津化学试剂三厂,以上试剂均为分析纯。H2(纯度不低于99.99%)、CO2(纯度不低于 99.99%)、N2(纯度不低于99.99%)购自太原市福江特种气体有限公司。
1.2 仪器设备
合成中所用仪器有:FA2003型电子天平(天津天马仪器厂)、DF-101S型磁力水浴锅(天津工兴电器厂)、BT100K型蠕动泵(河北保定创锐有限公司)、FYF2008型水热釜(上海志泽生物科技发展有限公司)、101-1型电热鼓风干燥箱(北京科伟永兴仪器有限公司)、TG16-WS型台式高速离心机(湖南湘仪实验室仪器开发有限公司)、SK2-4-2Q型管式炉(天津市天有利电炉有限责任公司)、DF-4A型压片机(天津港东科技发展有限公司)。
1.3 催化剂制备
将20.20 g Fe(NO3)3·9H2O、8.31 g PTA和一定量p-ABA分别溶于DMF溶液中,待分散均匀后将2种溶液混合搅拌30 min,用蠕动泵滴加到20 mL NaOH(4 mo1·L−1)溶液中,滴加完毕后溶液在室温下搅拌30 min,然后转移到100 mL内衬为聚四氟乙烯的反应釜中,100℃下水热反应24 h。冷却至室温,去掉上层清液后,依次用DMF、甲醇溶液洗涤、离心3次。将固体分离物放置烘箱在60℃干燥12 h。将所得固体(Fe基MOFs)缓慢分散到250 mL Cu(NO3)2·3H2O的甲醇溶液(mCu(NO3)2⋅3H2O∶mFe-MOF=0.15)中,室温下搅拌24 h,然后升温至90℃搅拌蒸干,继续于烘箱中60℃下干燥12 h后,在管式炉氮气气氛下650℃焙烧4 h,制得Cm∶n催化剂,m∶n为PTA和p-ABA的物质的量之比。
1.4 材料表征
X射线衍射(XRD)测试在DX-2700型X射线衍射仪(丹东方圆)上进行,采用Cu靶Kα射线(λ=0.154 184 nm),工作电流为30 mA,电压40 kV,扫描范围5°~85°,扫描速率8(°)·min−1。
H2程序升温还原(H2-TPR)测试在TP-500型吸附仪(天津先权)上进行。将50 mg催化剂升温至150℃,用氦气吹扫30 min,再降温至50℃,切换为体积分数为5% H2-95% N2的还原气吸附30 min,然后以10℃·min−1速率升温至800℃进行程序升温还原,用热导检测器(TCD)检验耗氢量。
N2吸附−脱附表征在QDS-30型物理吸附仪(美国康塔)上进行。将催化剂造粒后在真空200℃下预处理4 h,然后在液氮中采用N2吸附法测定,比表面积采用 BET(Brunauer-Emmett-Te11er)法计算,孔容、孔径采用 BJH(Barret-Joyner-Ha1enda)法计算。
扫描电子显微镜(SEM)测试在Quanta 400 FEG型场发射电子显微镜上进行,加速电压为20 kV,采用能量分布面扫描分析(EDS-mapping)来分析元素的分散性。
X射线光电子能谱(XPS)测试在ESCALAB 250型光谱仪(赛默飞世尔科技公司)上进行,A1 Kα为辐射源(hν=1 486.6 eV,12.5 kV,16 mA),真空度为p=8×10−10Pa,以结合能为 284.8 eV 的 C1s为标准进行校正。
1.5 催化剂活性评价

2 结果与讨论
2.1 结构分析
图1为制备的催化剂的XRD图。由图1a可知反应前所有催化剂均出现Fe0(PDF No.87-0721)、Cu0(PDF No.02-1225)、Fe3O4(PDF No.89-2355)、FeO(PDF No.89-0687)的特征衍射峰,但其结晶度存在差异;结合图1b发现随着p-ABA比例的增大,Fe3O4衍射峰减弱,FeO衍射峰增强,说明p-ABA的加入有利于低价态铁的形成;由图1c可知反应后催化剂物相除Cu0、Fe3O4外,在 2θ=41.2°、44.1°、47.3°位置处出现Fe5C2(PDF No.51-0997)物种的特征衍射峰;2θ=38.2°、41.1°、43.6°处出现Fe3N(PDF No.83-0877)物种的特征衍射峰,说明催化剂在反应过程中Fe物相发生了变化[20]。比例为5∶2时低价 Fe3O4、Fe5C2物种的衍射峰最强,说明这种状态下低价态铁含量最多。

图1 制备的催化剂的XRD图:(a)反应前;(b)局部放大;(c)反应后Fig.1 XRD patterns of as-prepared cata1ysts:(a)before reaction;(b)partia1 en1arged drawing;(c)after reaction
根据Scherrer公式计算了催化剂反应前后的Cu0晶粒尺寸(表1)。由表可知,反应后颗粒尺寸发生不同程度的减小,说明催化剂结构对Cu物种有较好的分散性,反应过程中没有发生团聚,而小尺寸铜晶粒拥有比较多的开放位面和边缘缺陷位点,有利于和关键反应中间产物的结合[21],促进反应的进行。
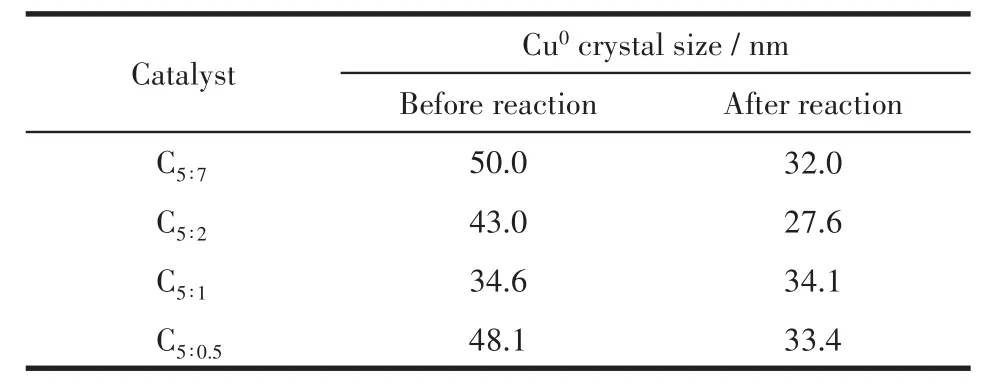
表1 制备的催化剂中Cu0晶粒尺寸Table 1 Crystal size of Cu0in as-prepared catalysts
2.2 N2吸附-脱附分析
图2为制备的催化剂反应前(a、b)后(c、d)的N2吸附−脱附等温线和孔径分布图。根据IUPAC分类,反应前后催化剂均为Ⅳ型等温线,说明催化剂在反应过程中结构没有发生变化,属于典型的介孔材料。低压区(p/p0<0.4)样品的N2吸附量逐渐增加,属于物理吸附;高压区(p/p0>0.4)出现H3型回滞环,说明没有出现限制性吸附[23]。由孔径分布图可知反应前后催化剂孔结构丰富,2~32 nm范围的孔同时存在,2~7 nm孔分布较均匀,3~4 nm孔最多,并且p-ABA用量的改变不会对其结构产生明显影响。
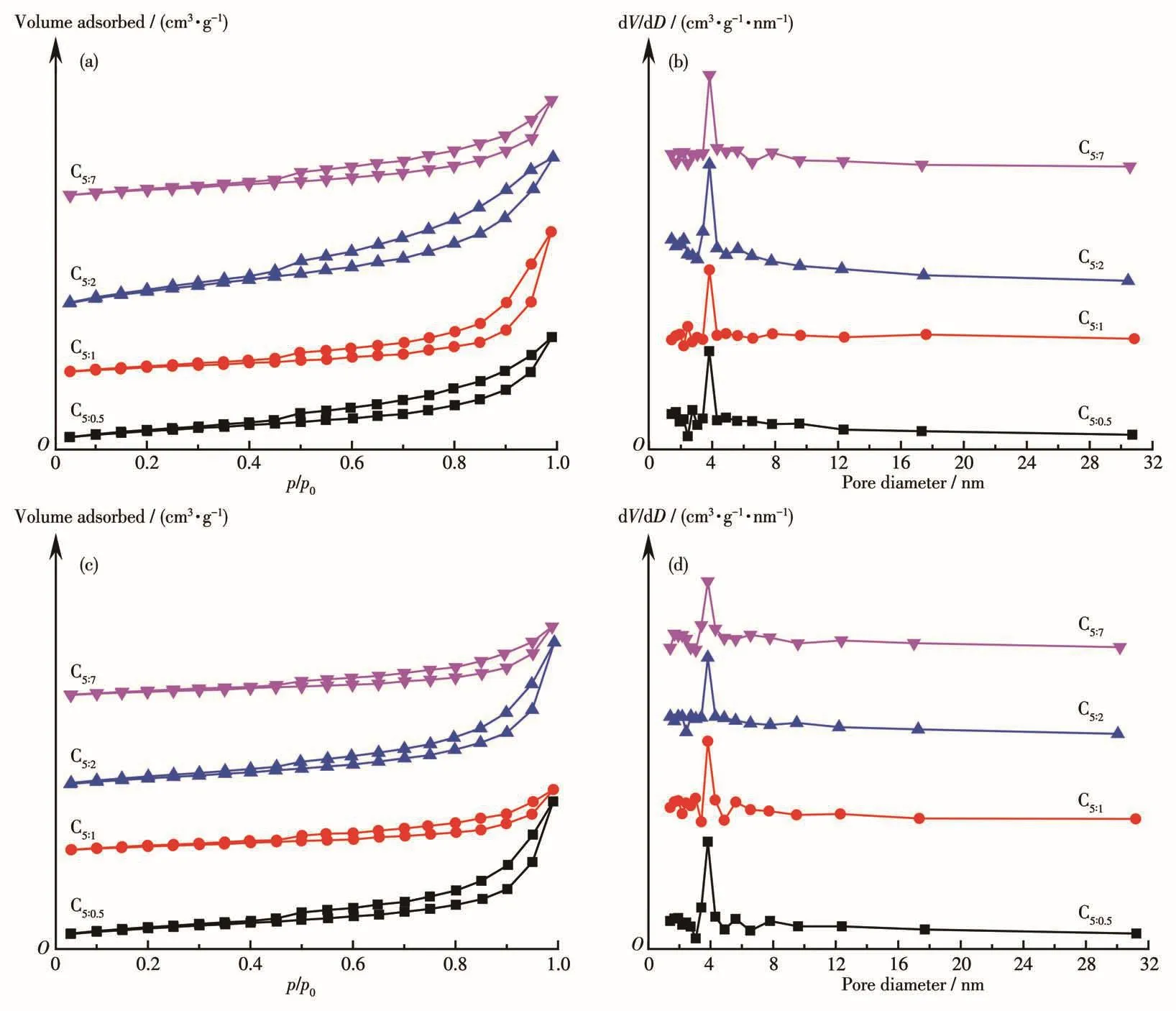
图2 制备的催化剂反应前(a、b)后(c、d)的N2吸附−脱附等温线和孔径分布图Fig.2 N2-adsorption-desorption isotherms and pore size distribution curves of as-prepared cata1ysts before(a,b)and after(c,d)reaction
表2列出了催化剂反应前后的织构参数,随着p-ABA的增加,反应前(后)各催化剂之间比表面积、孔容、孔径差异较小,说明p-ABA用量对催化剂结构性质影响较小;相比于反应前,反应后催化剂比表面积发生不同程度的减小,孔容、孔径变化较不明显,可能是反应过程中轻微积碳所致。C5∶2催化剂反应后比表面积、孔容偏大,晶粒尺寸偏小,结合SEM、EDS-Mapping分析结果可推测,此催化剂中活性组分分散均匀,没有严重的烧结、团聚现象发生,结合活性数据,这可能是其催化活性较高的原因之一。

表2 制备的催化剂反应前后的织构性质Table 2 Texture parameters of as-prepared catalysts before and after reaction
2.3 H2-TPR分析
为了进一步研究催化剂原位活化后的活性物种组成,对焙烧后催化剂进行了H2-TPR表征(图3)。可见催化剂均在190~250℃和250~650℃范围内出现2个主要的还原峰,分别归属于Cu物种(Cu2+→Cu0)、Fe物 种 (Fe3O4→FeO→Fe)的 还 原[20,22],随 着p-ABA比例的增大,Cu物种还原峰向低温发生偏移,Fe物种还原峰向高温发生移动。第一个峰的出现说明催化剂中还存在铜的氧化物,由于其含量低或者分散性较好,XRD中没有出现对应的特征衍射峰;目前关于Fe3O4、FeO的还原温度没有明确的界定,所以第二个峰归属于低价态铁的还原。H2-TPR、XRD表征结果结合二氧化碳加氢反应条件可知,催化剂在反应前经氢、氮混合气350℃还原后,真正的活性组分为Cu0、Fe3O4以及以低价态形式存在的Fe物种。
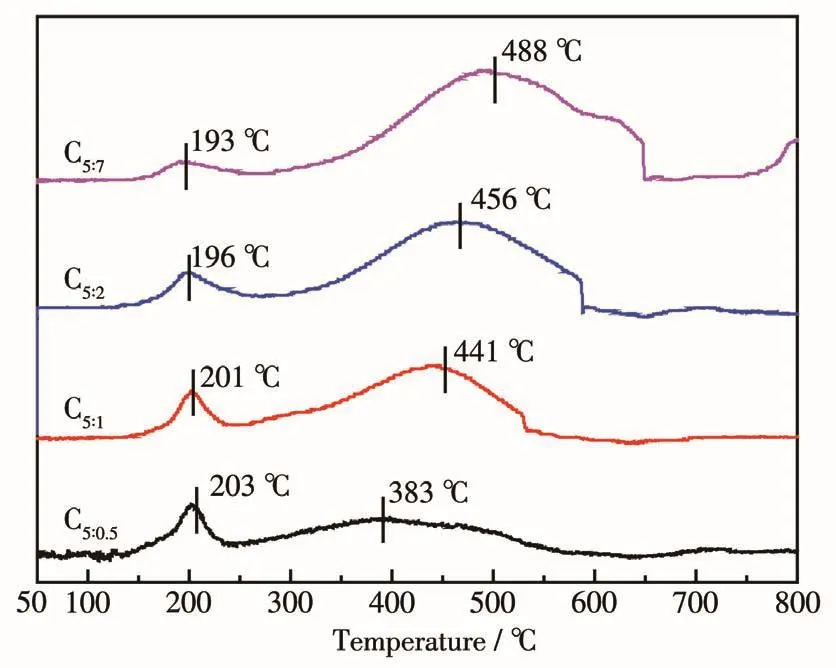
图3 制备的催化剂的H2-TPR曲线Fig.3 H2-TPR profi1es of as-prepared cata1ysts
2.4 SEM分析
为了清晰地看到催化剂表面形貌及各元素分布,对 C5∶2催化剂(反应后)做了 SEM 和 EDS-Mapping表征。如图4所示,从图a中可以看到催化剂出现均匀的片层状结构,堆叠形成丰富的孔道,结合图2b孔径分布结果可知,这可能是催化剂同时存在2~30 nm尺寸范围孔道的原因。增大放大倍数(图4b和4c),出现梭形杆状结构,这些结构更有利于活性位点的暴露,促进催化剂与原料气体充分接触。图4e(Cu)、4f(Fe)、4g(O)为 EDS-mapping元素分布图,可以看出Cu、Fe、O元素均匀分散,进一步证明了配体的引入有利于Cu、Fe组分的分散和相互作用,同时也有利于活性组分的暴露,增大与反应气的接触几率,促进催化反应的进行。

图4 催化剂C5∶2的SEM图 (a~d)和Cu、Fe、O元素分布 (e~g)Fig.4 SEM images(a~d)and e1ement distribution(e~g)of C5∶2cata1yst
2.5 XPS分析
应用XPS对催化剂反应后的组成、金属价态进行了分析。表3为催化剂各元素表面含量,除C、O、Cu、Fe主要元素外,还有微量N元素,与XRD表征结果中Fe3N物种衍射峰的出现一致。由于该系列催化剂在制备过程中配体用量较多,热解条件下分解产生的C富集于表面,导致其原子占比多达52.38%以上;随着p-ABA用量的增加,Cu、Fe金属原子占比呈现先增大后减小的火山型趋势,配体比例为5∶2时Cu、Fe位点暴露最多,分别为2.38%、3.29%,这也是C5∶2催化剂活性较好的原因之一;N元素含量随p-ABA 比例增大逐渐增多,nPTA∶np-ABA=5∶2 时达到0.77%,进一步增大用量其N元素含量变化较不明显,从活性金属表面含量和经济成本两方面考虑,配体PTA、p-ABA的最佳比例为5∶2。有文献指出Fe0[24]、Fe5C2[25-26]有利于碳链增长,Fe2+有利于 H2解离,为了探究催化剂表面Fe活性物种的存在形式,关联配体组成及配比与活性物种分布及催化剂活性间的关系,图5对反应后Fe2p XPS(a)及其分峰拟合谱图(b)进行了分析。图5a中该系列催化剂在结合能为724.4、711.2 eV处出现2个峰,并且其自旋轨道耦合(ΔE)为13.2 eV,这些特征参数对应于Fe3O4物种中的Fe3+和Fe2+[27];在718.2 eV附近没有出现卫星峰,说明反应后催化剂中不存在Fe2O3[28],与 XRD表征结果相一致,表明Fe被还原为低价态物种。为了计算不同形式的Fe含量,对Fe2p进行了分峰拟合,结合能712.5、710.7、707.5 eV处的峰分别归属于Fe3+、Fe2+、Fe0或Fe5C2[29-31],从计算结果(表 4)可以发现随着p-ABA用量的增加,Fe3+占比先减小后增大,Fe2+及低价态铁(Fe2+、Fe0和 Fe5C2总和)占比先增大后减小,nPTA∶np-ABA=5∶2 时低价态铁的原子占比最大,为71.27%,说明催化剂C5∶2中Fe主要以低价形式存在,与XRD表征结果(图1b)一致。结合活性数据发现,低价态Fe含量高有利于醇类尤其是C2+醇的生成,这与本课题组前期的研究结果相一致[32]。同时通过对C1s XPS谱图(图6)的分析发现,反应后催化剂均出现4个峰,结合能位于289.5 eV的峰归属于C=O键,285.6 eV处的峰归属于C—C键,低结合能284.8、284.1 eV处的峰分别归属于表面无定形碳物种和 FeCx物种[33-34],结合 XRD、Fe2p XPS 结果可知,FeCx物种在催化剂中主要以Fe5C2形式存在。
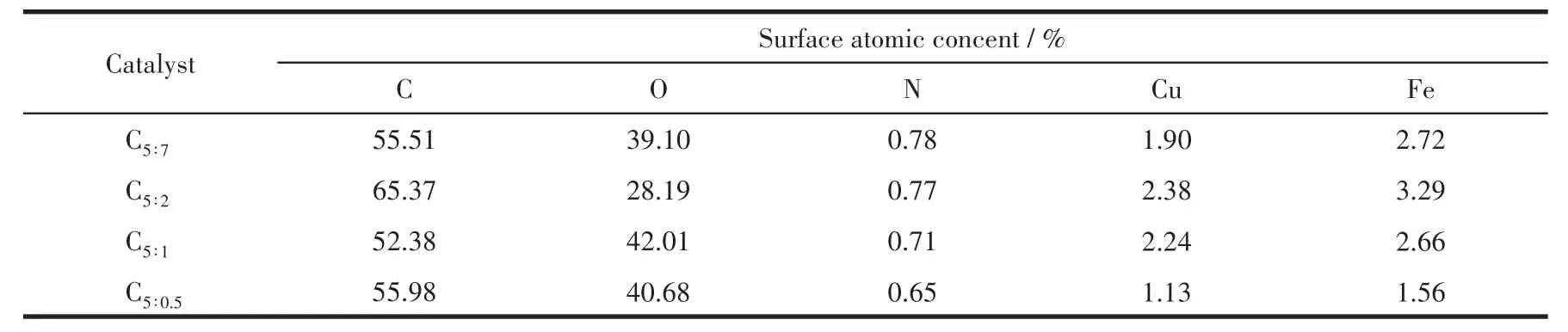
表3 基于XPS的所制备催化剂中各元素组成及含量Table 3 Elemental analysis results of as-prepared catalysts derived from XPS

图5 制备的催化剂反应后的Fe2p XPS谱图Fig.5 Fe2p XPS spectra of as-prepared cata1ysts after reaction
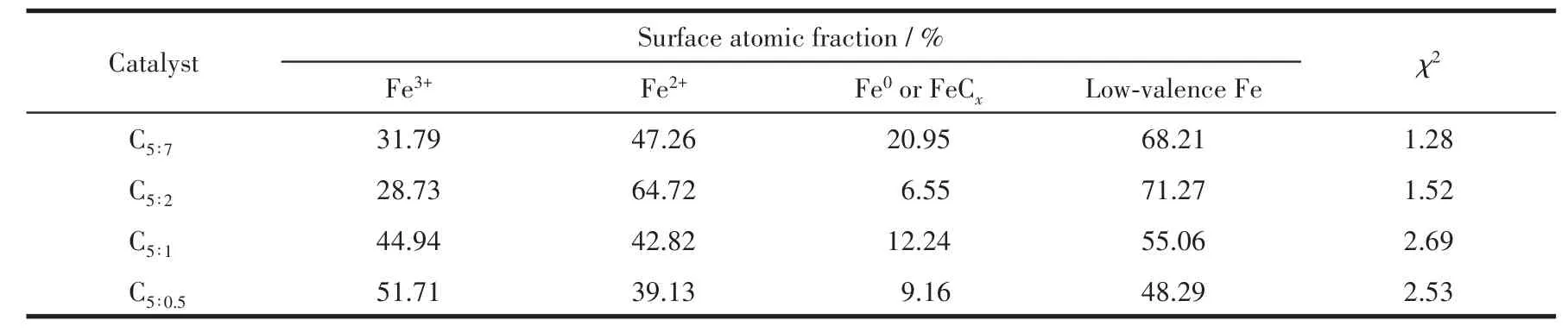
表4 制备的催化剂反应后样品表面Fe物种组成及占比Table 4 Composition and proportion of Fe species in the surface of as-prepared catalysts after reaction

图6 制备的催化剂反应后的C1s XPS谱图Fig.6 C1s XPS spectra of as-prepared cata1ysts after reaction
2.6 催化剂活性分析
表5列出了制备的催化剂用于CO2加氢反应的活性评价数据。可见,反应产物以CO、烃类为主,约占总产物的70.0%。随着p-ABA用量的增加,CO2转化率不断增大,说明氮掺杂有利于促进CO2的吸附、活化,可能是由于掺杂的N会与活性金属、CO2发生相互作用,从而降低CO2解离的活化能[35-36];同时CO选择性先减小后增大,总醇选择性先增大后减小,与低价态铁的含量的变化趋势(表4)一致,当配体PTA和p-ABA的比为5∶2时,催化剂表面低价态铁含量最高,总醇(ROH)选择性最大,CO选择性最小,说明低价态铁的存在能够抑制RWGS反应,有利于反应向生成醇的方向进行,此时C2+醇(C2+OH)的时空收率(STY)达到峰值45.49 mg·mL−1·h−1。
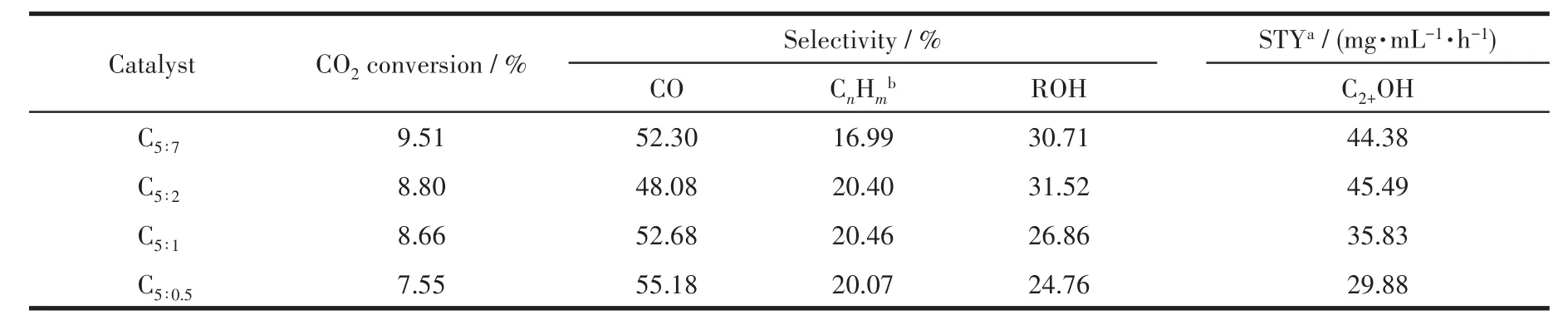
表5 制备的催化剂的催化性能Table 5 Catalytic performance of as-prepared catalysts
表6展示了产物中各种醇的选择性及在总醇中的分布。由表可以看出,随着p-ABA用量的增加,甲醇、丙醇选择性相对较小且呈现波动式变化,说明氮含量的变化对其没有明显作用规律;而此时乙醇选择性先增大后减小,与总醇选择性变化趋势保持一致。根据各类醇在总醇中的分布可知,产物醇中主要以乙醇为主,可能归因于催化剂结构的限域作用,当最可几孔径为3~4 nm时,乙醇的物质的量分数最高,而较大的孔径则倾向于生成乙醇偶联产物丁醇。随着p-ABA用量的增加,丁醇选择性明显变大,当2种配体的比例为5∶7时最大,此时Fe5C2占比最多,Fe5C2被认为能促进C—C偶联,有利于碳链增长[25,37-38],这可能是丁醇选择性增大的原因。

表6 制备的催化剂催化作用下醇产物中各类醇分布Table 6 Alcohol distributions in total alcohol catalyzed by as-prepared catalysts
在总醇中,甲醇的物质的量分数较低,C2+醇总物质的量分数都达到了92.0%以上,其中乙醇占主要部分。图7对低价态铁占比与总醇选择性(a)、低价态铁占比与C2+醇选择性(b)进行了线性拟合,R2分别达到0.999 8、0.998 8,呈现较好的相关性,说明低价态铁有利于CO2加氢合成C2+醇,关于其反应机理有待进一步研究。综上所述,分散性较优的催化剂结构有利于低价态铁的形成,进而促进了CO2加氢制C2+醇,2种配体比例为5∶2时低价态铁占比最高,催化效果最佳,CO2转化率为8.80%,总醇选择性为31.52%,其中C2+醇物质的量分数达到94.70%。表7对不同CuFe基催化剂用于CO2加氢制C2+醇的催化性能进行了对比,可以发现与多组分催化剂相比,以MOFs为前驱体制备的CuFe双组分催化剂用于CO2加氢制C2+醇时,催化性能较优,反应条件相对温和,GHSV较高,产物醇中C2+醇物质的量分数较高。

图7 低价态铁含量与总醇选择性(a)及C2+醇选择性(b)关系图Fig.7 Re1ationships between content of 1ow-va1ence iron and se1ectivity of ROH(a)and C2+OH(b)
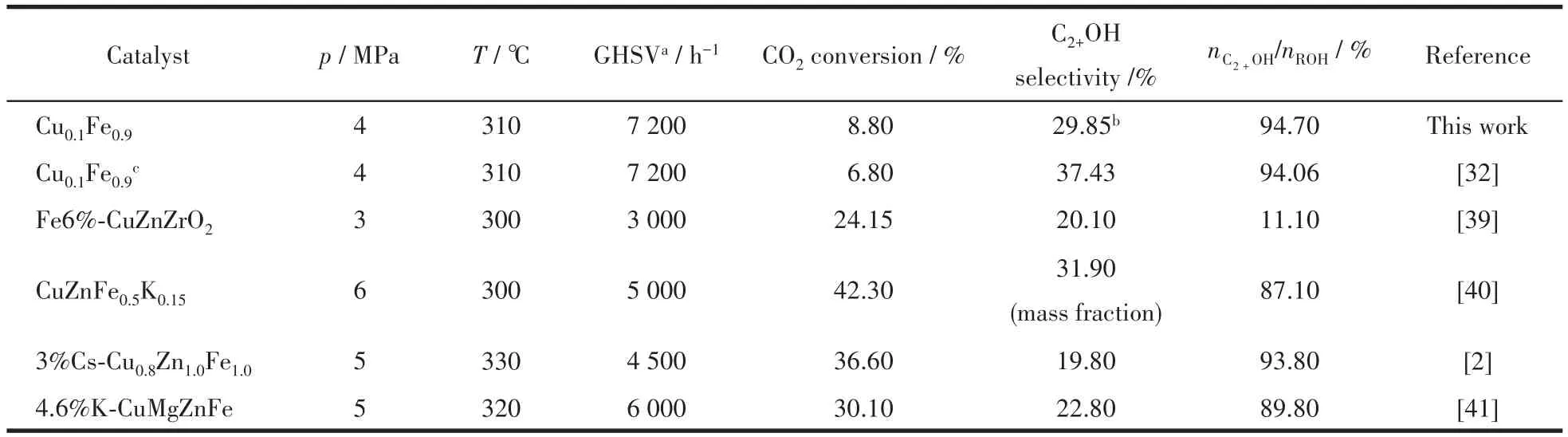
表7 CuFe催化剂用于CO2加氢制C2+醇的催化性能Table 7 Catalytic performance of CuFe catalyst for CO2hydrogenation to C2+alcohol
3 结论
以双配体CuFe@MOFs材料为前驱体制备的催化剂用于CO2加氢制C2+醇,通过实验研究得出以下结论:
(1)SEM、EDS-mapping表征发现,采用水热浸渍法、氮气焙烧气氛制备的CuFe基催化剂活性组分分散均匀,避免了高温加氢条件下Cu组分团聚、烧结现象的发生。
(2)由XPS数据可知,调节2种配体(对苯二甲酸、对氨基苯甲酸)的比例可以调控催化剂中低价态铁的分布,进而对CO2加氢合成C2+醇的催化性能产生影响。当对苯二甲酸和对氨基苯甲酸比例为5∶2时,催化剂中低价态铁占比最高,对C2+醇的生成最有利。
(3)铜铁组分良好的分散性是合成醇的关键,低价态铁的存在对反应产物的碳链增长起重要作用。
