秋石斛花青素提取液成分分析及其体外抗氧化活性和刺激性研究
2021-08-10吕晓帆周新红王莹吴亚妮
吕晓帆,周新红,王莹,吴亚妮
秋石斛花青素提取液成分分析及其体外抗氧化活性和刺激性研究
吕晓帆,周新红,王莹,吴亚妮*
(上海交通大学设计学院,上海 200240)
为了解热带兰秋石斛花青素的功能, 用超声波辅助提取法提取秋石斛‘三亚阳光’(‘Sanya Sunny’)的花青素,用UPLC-QTOF-MS技术对其花青素提取液进行成分分析, 并对其抗氧化活性进行了评价,采用家兔皮肤刺激和眼刺激实验对提取物的安全性进行了研究。结果表明,从花青素提取物中共检测出15个花青素成分,如苷元有飞燕草素、矢车菊素、锦葵素、矮牵牛素和芍药素等;提取物体外抗氧化活性较强,相同浓度下花青素提取物的DPPH·清除能力和总抗氧化能力均强于抗坏血酸;0.25~1.0 g/L的花青素提取物对家兔眼和皮肤均无刺激性。这说明‘三亚阳光’秋石斛除观赏价值外,在医药、食品和化妆品等领域也有广阔的应用空间。
秋石斛;花青素;抗氧化性;安全性实验
秋石斛()又称蝴蝶石斛,为兰科(Orchidaceae)石斛属常绿附生草本植物,是热带洋兰重要的切花和盆花之一。蝴蝶石斛原生种多分布于大洋洲的澳大利亚、新西兰和巴布亚新几内亚等国,杂交种多是由原产于新几内亚的热带原生种蝴蝶石斛为亲本育成[1]。21世纪初,中国开始从泰国、新加坡等国引进并大规模栽培,多见于三亚、昆明一带[2]。目前国内外关于蝴蝶石斛的研究较少,并且大多集中于栽培技术以及花色表现与基因表达方面,关于其提取物功效以及安全性的研究则极其少见。
花青素是构成植物花瓣和果实的主要色素之一,常见于花瓣、果实组织的表皮细胞与下表皮层,属于酚类物质中的类黄酮。大量研究表明,花青素具有较好的抗氧化、抗炎、抗肿瘤、抗衰老等功效,对于慢性疾病的治疗和预防、降低心血管疾病的发病率、糖尿病和肥胖症的预防等方面都有积极的作用,在医药行业、食品行业以及化妆品行业等都有较为广阔的应用空间[3–5]。
本研究主要对秋石斛‘三亚阳光’(‘Sanya Sunny’)花瓣花青素提取物进行分析和评价。通过UPLC-QTOF-MS分析其主要花青素成分,通过DPPH自由基和FRAP自由基试验评价其体外抗氧化活性,通过家兔皮肤刺激和眼刺激试验评价其安全性,以期对秋石斛‘三亚阳光’的深度开发和应用提供理论和数据支持。
1 材料和方法
1.1 材料和试剂
材料 健康秋石斛‘三亚阳光’(‘Sanya Sunny’)花瓣,由海南博大兰华科技有限公司提供。
试剂 分析纯矢车菊素-3--葡萄糖苷(麦克林生化科技有限公司),分析纯醋酸钠、硫酸亚铁(北京百灵威生物科技有限公司),分析纯盐酸、乙酸、三氯化铁、无水乙醇(国药集团化学试剂有限公司),三吡啶三吖嗪(tripyridyl-triazine, TPTZ;上海华英化工有限公司),1-二苯基-2-三硝基苯肼(1,1-diphenyl- 2-picrylhydrazyl, DPPH, 源叶生物科技有限公司), 抗坏血酸[维生素C, 阿法埃沙(中国)化学有限公司]。
仪器 UV-5500紫外可见分光光度计(上海元析仪器),AR224CN分析天平(奥赛德仪器), JY92- ⅡN超声波细胞粉碎机(宁波新芝生物科技股份有限公司),H1850离心机(湘仪离心机仪器有限公司);Acquity I-class超高效液相色谱,VION离子淌度四极杆飞行时间质谱联用仪(上海沃特世科技有限公司)。
1.2 花青素提取液的成分分析
样品制备 取0.5 g秋石斛新鲜花瓣用液氮研磨,装入10 mL离心管中,加5 mL含有70%甲醇的0.1%盐酸水溶液,涡旋30 s,放入4℃冰箱冷藏24 h后,采用超声波提取30 min (超声频率75 Hz), 所得溶液在13 200×离心10 min,取上清液1 mL进样,利用UPLC-QTOF-MS技术进行分析。
色谱条件 色谱柱: BEH C18(100 mm×2.1 mm, 1.7m),(配备预柱);柱温:45℃;流速:0.4 mL/min;流动相A:0.1%甲酸水;流动相B:0.1%甲酸乙腈(1/1);洗针液:H2O/ACN (10/90);进样体积:1L。依次用0~3 min, 95% A; 3~10 min, 80% A; 10~ 12 min, 0% A; 12~15 min, 5% A梯度洗脱。
质谱条件 采集模式:MSE (低能量/高能量切换扫描);离子模式:电喷雾正离子/负离子分别扫描;毛细管电压:2 kV (positive)、2 kV (negative);锥孔电压:40 V;雾化气温度:450℃;雾化气流量: 900 L/h;锥孔反吹气(Cone gas):50 L/h;离子源温度(Source temp):115℃;扫描范围:/50~1 000; 扫描速度:0.2 s;碰撞能量:6 eV/20~45 eV;在线锁定质量(在线校正Lockmass):250 pg/L亮氨酸脑啡肽持续进样,流速:10L/min;采集间隔(sample time):0.5 s;采集时间:0.5 s;碰撞能量:6 eV。
1.3 总花青素提取
矢车菊素标准曲线制备 参照Hui等[6]的方法,在弱光下称取矢车菊素对照样品至50 mL容量瓶中,用0.1%盐酸水溶液和95%乙醇水溶液(1∶1)溶解、定容制成不同浓度的矢车菊素对照品溶液,在最大吸收波长518 nm下测吸光度,并绘制标准曲线。
总花青素的提取 采用超声波辅助提取法。取新鲜秋石斛花瓣,60℃烘箱烘干至恒重,粉碎后过60目筛,称取0.05 g干粉加入2.5 mL提取剂进行超声提取,超声时间30 min,功率55 W。之后在9 000×下离心10 min,取上清液,稀释10倍后在518 nm处测定吸光度值A,根据标准曲线计算总花青素的含量,重复3次。
1.4 总抗氧化能力的测定
参考Yang等[7]的FRAP方法绘制标准曲线和测定。量取0.1 mL样品溶液置于10 mL离心管中, 加入3 mL FRAP工作液,再加入去离子水至4 mL, 混合均匀,精确反应5 min,以去离子水为参比, 测量593 nm波长处的吸光度,并根据标准曲线计算抗氧化活性,以抗坏血酸为阳性对照,重复3次。
1.5 DPPH∙自由基的清除能力测定
参照Cheng等[8]的方法,取2 mL 0.5 mmol/L的DPPH溶液与1 mL各浓度样品提取液、70%乙醇水溶液混合,精确反应10 min,测量波长517 nm处的吸光度值1。以抗坏血酸作为阳性对照,2.0 mL DPPH溶液+2.0 mL 70%乙醇水溶液的吸光度值0, 1.0 mL样品溶液+3.0 mL 70%乙醇水溶液的吸光度值2。DPPH∙清除率K1=[1-(1-2)/0]×100%。
1.6 花青素提取液刺激性分析
皮肤刺激性评价 参考Qian等[9]的方法稍作修改。雄性家兔分为4组,每组3只。在给药前24 h, 在家兔背部两侧对称各剪出两块2.5 cm× 2.5 cm的皮肤,剃净兔毛,左侧两块用无菌刺血针作“井”字形划痕。用盐酸乙醇溶液稀释后得1.0、0.5、0.25 g/L的秋石斛花青素提取液,取提取液0.2 mL, 涂抹完整皮肤和破损皮肤各1块。涂药后纱布覆盖,用无刺激胶布固定。用药24 h后用温水清洗掉受试物,分别于1、24、48、72 h后在同一自然光线下观察和记录用药部位出现红斑和水肿的情况。出现红斑情况划分为5级,即无红斑、勉强可见、明显红斑、严重红斑和紫红色红斑并有焦痂形成,分别赋予0~4分;出现水肿情况也划分为5级,即无水肿、勉强可见、皮肤隆起(边缘高出周围皮肤)、水肿隆起约1 mm和水肿隆起大于1 mm且范围扩大,分别赋予0~4分。根据皮肤刺激反应评分标准进行评分并计算积分,积分值=(Σ1红斑+Σ2水肿)/动物总数, 0~0.5分为无刺激性;0.6~2.0分为轻度刺激性; 2.1~ 6.0分为中度刺激性;6.1~8.0分为强刺激性。依据皮肤刺激强度评价提取物对皮肤的刺激强度。
眼刺激性评价 参照Zhang等[10]的方法稍作修改。家兔分为4组,每组3只,取各浓度花青素提取液各0.1 mL,滴入家兔一侧眼睛的结膜囊中, 上下眼睑被动闭合1 s;另一侧眼睛不滴,24 h内也不冲洗,作为对照。滴入受试物1、24、48、72 h以及4和7 d后检查家兔眼睛,若72 h未出现刺激反应可终止实验。若有累积角膜或者眼的其他刺激作用, 并且7 d内不恢复,则需要延长观察时间以确定该损伤是否可逆。按照眼损伤的评分标准(表1)记录眼刺激反应的积分,积分值=(Σ1角膜+Σ2虹膜+Σ3结膜充血+ Σ4结膜水肿+Σ5结膜分泌物)/动物总数[9]。0~3分为无刺激性; 4~8分为轻度刺激性;9~12分为中度刺激性; 13~ 16分为重度刺激性。
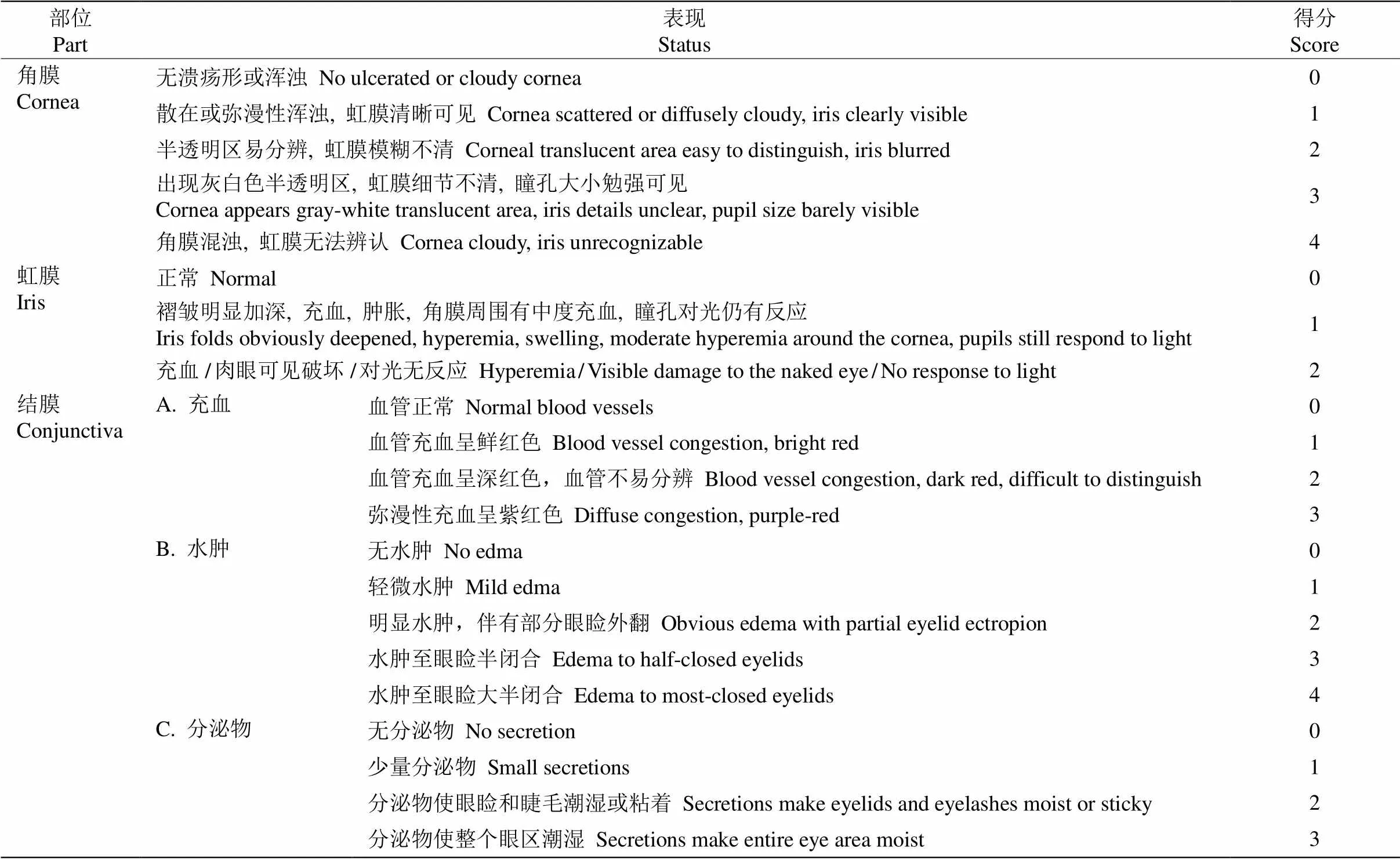
表1 眼损害的评分标准
2 结果和分析
2.1 花青素提取液的成分分析
花青素是酸性化合物,采用乙腈-0.1%甲酸水溶液作为洗脱流动相,用TOF/MS全扫描检测,正离子扫描模式,用UNIFI质谱软件分析确定每个离子峰的质谱裂解规律,对比相关文献和标准品进行化合物鉴定。结果从秋石斛兰花青素提取液中共检测出15个花青素成分,苷元有飞燕草素、矢车菊素、锦葵素、矮牵牛素和芍药素(表2,图1)。
2.2 体外抗氧化活性
2.2.1 总抗氧化能力
获得的硫酸亚铁标准曲线的拟合方程为=0.0053+0.0948,相关系数2=0.999,表明线性关系良好,线性范围为0~160mol/L。从图2可见,以抗坏血酸(Vc)为阳性对照,在一定浓度范围内, Vc与秋石斛花青素提取液的总抗氧化能力(FRAP)均随浓度上升而增强,且呈现出一定的线性趋势, 但花青素的FRAP明显高于同浓度的Vc。
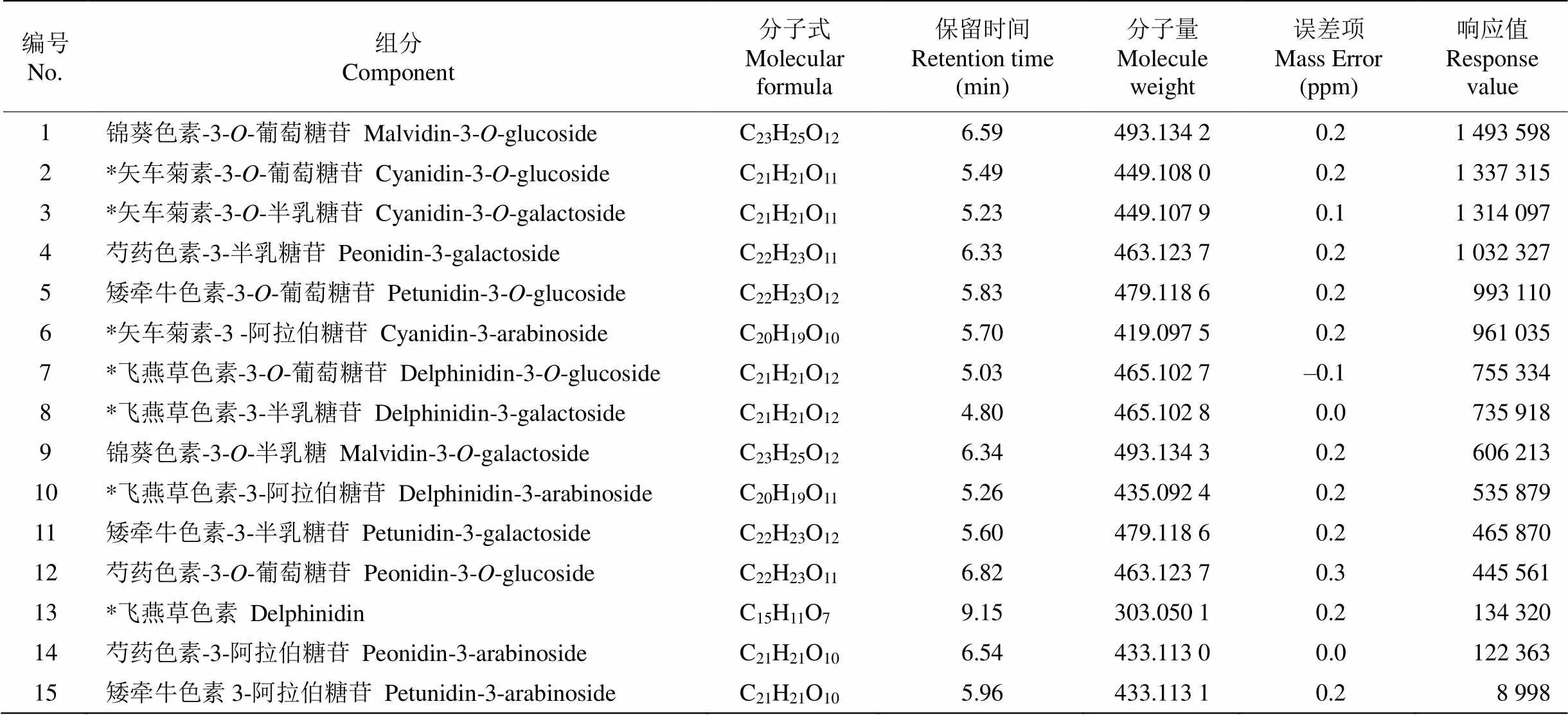
表2 秋石斛的花青素类成分
*: 与标准品比对鉴定得出。
*: Compared with the standard identification.
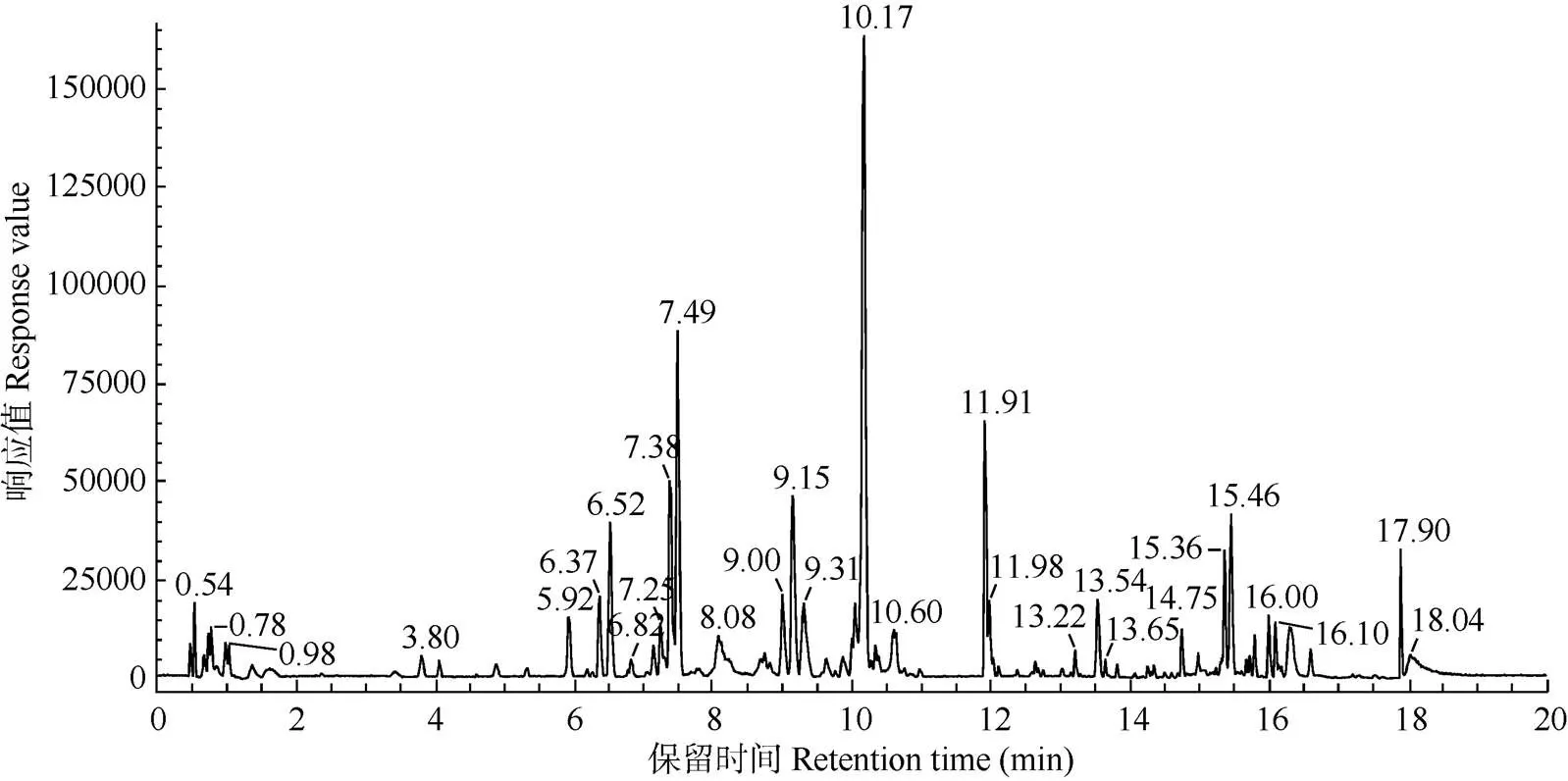
图1 秋石斛的花青素提取液总离子流图
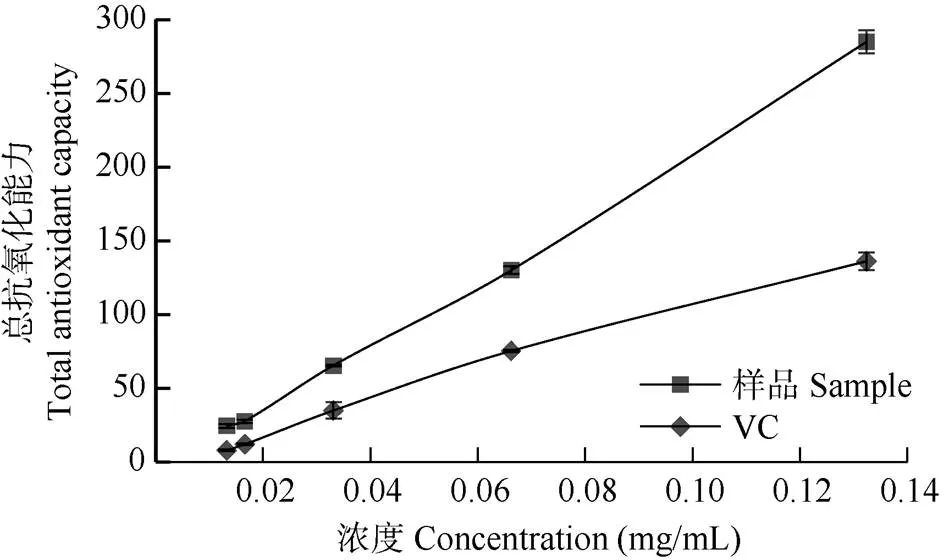
图2 秋石斛兰花青素提取液的总抗氧化能力
2.2.2 DPPH·的清除能力
从图3可见,在一定浓度范围内,抗坏血酸与秋石斛花青素对DPPH·清除率均随浓度的升高而增大,在0.02~0.06 g/L时二者曲线呈现一定的线性趋势,后期斜率下降,表明此时抗氧化剂浓度的增高对清除率的影响降低。当浓度大于0.12 g/L时, 二者对DPPH·的清除率均达到96%。秋石斛花青素和抗坏血酸对DPPH·的半数最大清除浓度(IC50)分别是0.027和0.034 g/L,说明秋石斛花青素对DPPH·自由基有较强的清除能力。
2.3 花青素提取液的安全性分析
2.3.1 皮肤刺激性
从表3可见,小于1.0 g/L的花青素提取液对家兔的正常皮肤和破损皮肤均没有刺激性。花青素提取液涂抹1 h后,部分家兔皮肤出现勉强可见的红斑,正常皮肤对照组在1 h后未见红斑和水肿,但在24 h后出现红斑,可能是家兔的个体差异导致刺激反应的延迟。48 h后所有家兔皮肤均恢复正常。
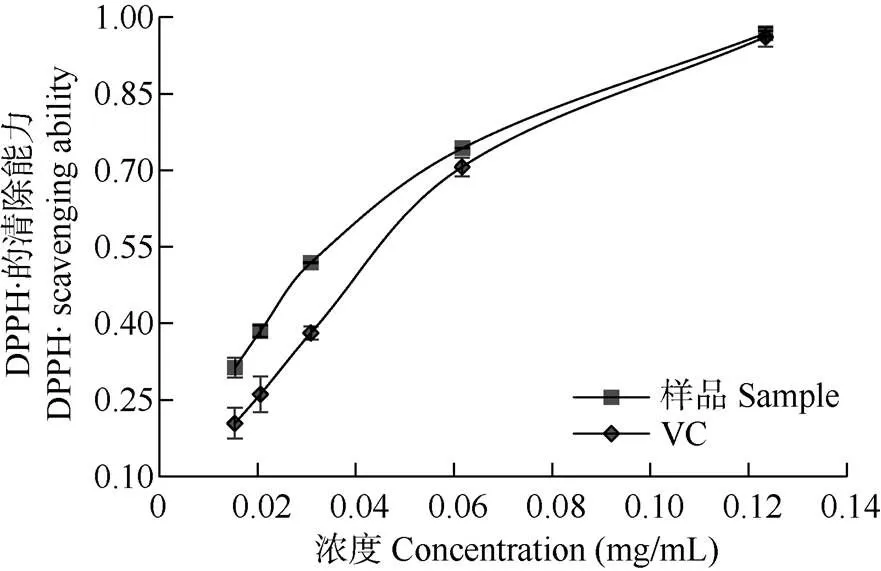
图3 秋石斛兰花青素提取液对DPPH·的清除能力
2.3.2 眼刺激性
从表4可见,低于1.0 g/L的花青素提取液对家兔眼睛无刺激性,而1.0 g/L提取液的刺激性较大。72 h后,所有家兔的眼睛均能恢复。
3 结论和讨论
本研究选取广泛应用于切花、盆栽的重要热带兰秋石斛‘三亚阳光’品种,提取并分析了其花瓣花青素成分,并对其体外抗氧化性和刺激性进行了研究。目前对秋石斛花青素组成的研究很少。20世纪80年代,Kanchit采用高效液相色谱方法研究了秋石斛属28种植物及杂交后代的类黄酮苷元组成,花瓣中含有矢车菊素和芍药花素、天竺葵素[11];李崇晖等[12]用HPLC-MS技术分析了6个蝴蝶石斛兰品种的花青素成分,以矢车菊素苷元为主。本试验中检测出4个以飞燕草素为苷元的花青素苷,此前尚未在蝴蝶石斛兰中检出, 这可能是品种和检测技术不同造成的, UPLC的灵敏度和分离能力均高于HPLC。
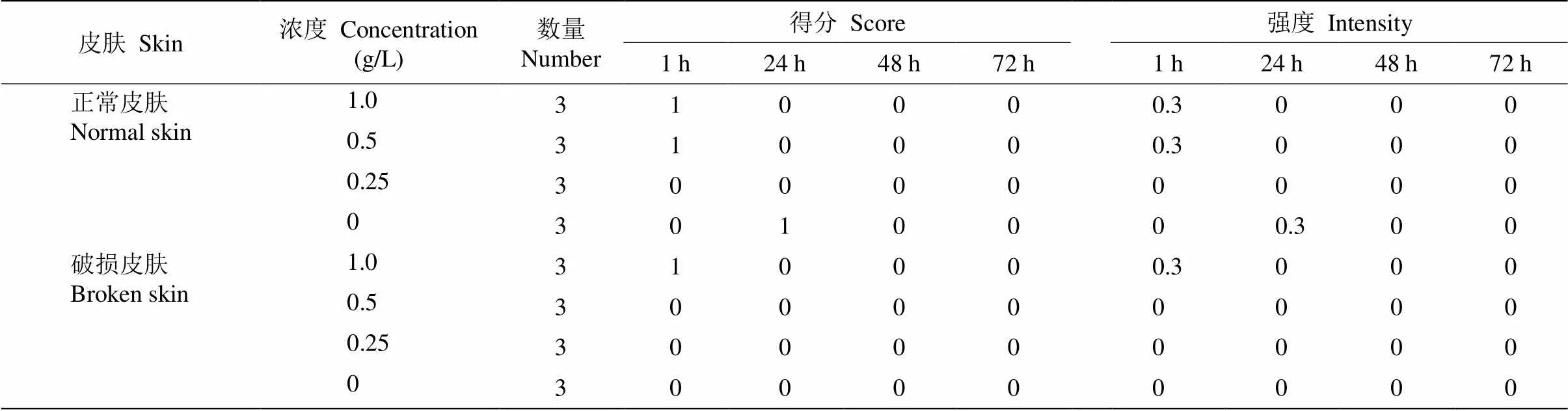
表3 秋石斛兰花青素提取液的皮肤刺激反应
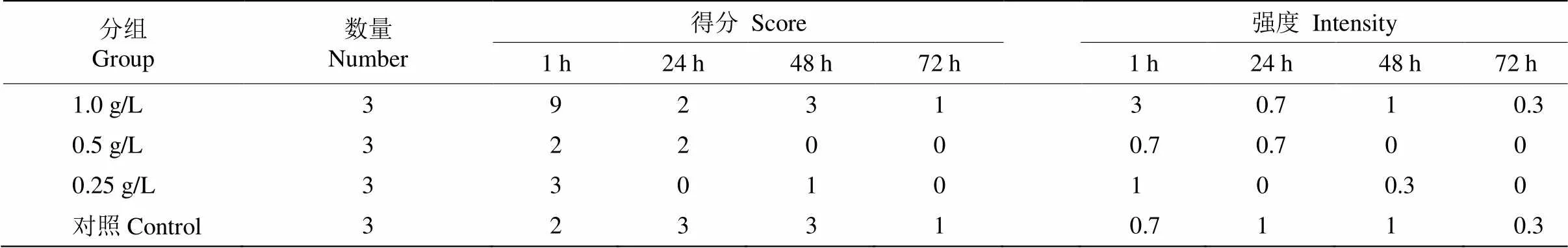
表4 眼刺激反应实验结果
本研究结果表明,在花青素提取物中共检出15个花青素成分,苷元为飞燕草素、矢车菊素、芍药素、矮牵牛素和锦葵素,此前在大马士革玫瑰()、蓝莓()、杜鹃花()等的花青素提取液中有检出以飞燕草色素为苷元的花色素[13–15],但并未在秋石斛中检出,可能是品种间的差异以及检测技术灵敏度的强弱不同导致的。飞燕草色素是一种天然的抗氧化剂,且具有治疗炎性疼痛的临床潜力[16–17],也有研究表明飞燕草色素可减少阿尔兹海默症模型大鼠海马区淀粉样蛋白斑块的形成,有辅助治疗阿尔兹海默症等认知障碍疾病的潜力[18]。
不同抗氧化剂发挥作用的机制不同,但通常包括自由基清除、减缓或抑制脂质氧化等[19–20],总抗氧化能力以及对DPPH·的清除能力常用于评价植物提取物的抗氧化性[21]。本研究表明秋石斛‘三亚阳光’花青素提取物具有良好的抗氧化效果,花青素提取物浓度为0.13 g/L时,FRAP值达到了285mol/L, 而同浓度的抗坏血酸则是136mol/L。花青素提取物和抗坏血酸清除DPPH·的IC50值分别是0.027和0.034 g/L,花青素提取物的DPPH∙自由基的清除能力强于同浓度的抗坏血酸。
安全性是评价提取物能否进行后续开发利用的重要评判标准,而刺激性是安全性的重要指标之一。刺激性通常包括对皮肤和眼睛的刺激。本研究结果表明,低于1.0 g/L的花青素提取液对家兔皮肤和眼睛均没有刺激性。按照美国CIR的植物提取物安全评价决策树[22],秋石斛一般是用于切花和盆花,也被广泛应用于餐桌花中,但是,对于其提取物的表征还不够完善,以后对其进行安全评价时应进一步完善。此外,本试验中花青素提取物浓度最高为1.0 g/L,以后可探讨对眼和皮肤无刺激反应的最高使用剂量。
秋石斛‘三亚阳光’作为一种广泛应用于盆栽和切花的热带兰品种,在医药、食品、化妆品等领域也都具有潜在的应用价值。兰科石斛属的种类繁多,但石斛作为一种重要的中药材,自然繁殖难, 生长周期长,远不能满足目前的市场需求,所以从石斛属的植物中筛选出更多的药用品种是解决目前石斛资源短缺的方法之一[23–26]。本研究为秋石斛的深度开发提供了理论依据和数据支撑,以期秋石斛‘三亚阳光’能够在更广泛的领域实现更大的价值。
[1] WU R H, LI Z J, WANG Y.varieties and their greenhouse cultivation [J]. Agric Eng Technol, 2007(1): 34–35.
武荣花, 李振坚, 王雁. 秋石斛品种及其温室栽培 [J]. 农业工程技术(温室园艺), 2007(1): 34–35.
[2] HUANG Z M, LIN Q L, YU H M. A study on the industrial breeding technology of[J]J Putian Univ, 2002, 9(3): 22–26. doi: 10.3969/j.issn.1672-4143.2002.03.007.
黄志明, 林庆良, 佘慧敏. 蝴蝶石斛兰工厂化育苗技术的研究 [J]. 莆田学院学报, 2002, 9(3): 22–26. doi: 10.3969/j.issn.1672-4143.2002. 03.007.
[3] JIAO L, LI Y W. Progress of blueberry anthocyanin extraction methods [J]. Beijing Agric, 2011(3): 10–11. doi: 10.3969/j.issn.1000-6966.2011. 03.006.
焦龙, 李玉伟. 蓝莓果实中花青素提取方法的研究进展 [J]. 北京农业, 2011(3): 10–11. doi: 10.3969/j.issn.1000-6966.2011.03.006.
[4] MA Y, WANG D, ZHANG C, et al. Clinical observation of antho- cyanins soft drink on asthenopia relief [J]. J Chin Inst Food Sci Technol, 2015, 15(8): 42–46. doi: 10.16429/j.1009-7848.2015.08.007.
马越, 王丹, 张超, 等. 花青素饮料缓解视疲劳作用的人体试验观察 [J]. 中国食品学报, 2015, 15(8): 42–46. doi: 10.16429/j.1009-7848. 2015.08.007.
[5] ZHUO Y G, LIU R H, GU F S, et al. The factors influencing antho- cyanins stability and progress on application research [J]. Guangdong Chem Ind, 2018, 45(24): 70–72. doi: 10.3969/j.issn.1007-1865.2018. 24.037.
卓毓光, 刘儒华, 古福生, 等. 花青素稳定性影响因素与应用研究进展 [J]. 广东化工, 2018, 45(24): 70–72. doi: 10.3969/j.issn.1007- 1865.2018.24.037.
[6] HUI J, CUI X M, FU Y, et al. Ultrasonic method for extracting anthocyanins from purple sweet potato [J]. J Liaoning Univ (Nat Sci), 2015, 42(1): 74–78. doi: 10.3969/j.issn.1000-5846.2015.01.013.
回晶, 崔学敏, 付杨, 等. 紫薯花青素超声提取工艺研究 [J]. 辽宁大学学报(自然科学版), 2015, 42(1): 74–78. doi: 10.3969/j.issn.1000- 5846.2015.01.013.
[7] YANG L W, YANG H P, QUE S, et al. Comparative analysis of the antioxidant activity of the different components from[J]. Food Res Dev, 2016, 37(15): 208–210. doi: 10.3969/j.issn. 1005-6521.2016.15.048.
杨丽维, 杨红澎, 确生, 等. 桑黄不同组分抗氧化活性的比较分析 [J]. 食品研究与开发, 2016, 37(15): 208–210. doi: 10.3969/j.issn. 1005-6521.2016.15.048.
[8] CHENG P, WU J, HE X Y, et al. Study on the antioxidant activity and the change of monthly periodicity of flavonoids in[J]. Nat Prod Res Dev, 2020, 32(4): 576–581,651. doi: 10.16333/j.1001- 6880.2020.4.005.
程鹏, 邬洁, 何先元, 等. 木芙蓉叶黄酮成分抗氧化及月周期规律研究 [J]. 天然产物研究与开发, 2020, 32(4): 576–581,651. doi: 10. 16333/j.1001-6880.2020.4.005.
[9] QIAN J, CHEN J S, WEN L, et al. Anti-demodecidosis activity and skin safety ofL. leaves extract[J]. Infect Dis Inform, 2017, 30(6): 355–357. doi: 10.3969/j.issn.1007-8134.2017.06. 010.
钱江, 陈锦珊, 文磊, 等. 麻风树叶提取物体外抗蠕形螨活性及皮肤安全性的实验研究 [J]. 传染病信息, 2017, 30(6): 355–357. doi: 10.3969/j.issn.1007-8134.2017.06.010.
[10] ZHANG Z, LI X P, YANG F, et al. Stimulation test of two kinds of polysaccharides on rabbit eyes [J]. J Trad Chin Vet Med, 2016, 35(1): 35–37.
张哲, 李新圃, 杨峰, 等. 两种多糖对家兔眼刺激性试验 [J]. 中兽医医药杂志, 2016, 35(1): 35–37.
[11] Thammasiri K. Flower pigments in yellowspecies and hybrids [D]. Honolulu, HI, USA: University of Hawaii, 1984: 63– 68.
[12] Li C H, Ren Y, Huang S R, et al. Floral colors of phalaenopsis typeand their flavonoid composition [J]. Acta Hort Sin, 2013, 40(1): 107–116.
李崇晖, 任羽, 黄素荣, 等. 蝴蝶石斛兰花色表型及类黄酮成分分析 [J]. 园艺学报, 2013, 40(1): 107–116.
[13] LIU L, CHEN L, LI H, et al. Dertermination of anthocyanidin compo- sition and content fromat different flowering periods by HPLC [J]. J Sichuan For Sci Technol, 2020, 41(4): 58–63. doi: 10.12172/202004260003.
刘雷, 陈黎, 李华, 等. 高效液相色谱法测定不同开花时期大马士革Ⅲ玫瑰()花青素种类及含量 [J]. 四川林业科技, 2020, 41(4): 58–63. doi: 10.12172/202004260003.
[14] JIAO X Y, TIAN J L, SI X, et al. Research development of blueberry anthocyanin [J]. China Fruit Veg, 2020, 40(5): 26–31. doi: 10.19590/j. cnki.1008-1038.2020.05.005.
矫馨瑶, 田金龙, 司旭, 等. 蓝莓花青素的研究进展 [J]. 中国果菜, 2020, 40(5): 26–31. doi: 10.19590/j.cnki.1008-1038.2020.05.005.
[15] WANG Y, ZHANG G H, HE J S, et al. Research progress offlower color [J]. World For Res, 2020, 33(5): 19–24. doi: 10. 13348/j.cnki.sjlyyj.2020.0028.y.
王禹, 张广辉, 赫京生, 等. 杜鹃花色研究进展 [J]. 世界林业研究, 2020, 33(5): 19–24. doi: 10.13348/j.cnki.sjlyyj.2020.0028.y.
[16] XU J J, ZHANG Y W, REN G F, et al. Inhibitory effect of delphinidin on oxidative stress induced by H2O2in HepG2 cells [J]. Oxid Med Cell Longev, 2020, 2020: 4694760.
[17] SAUER R S, KRUMMENACHER I, BANKOGLU E E, et al. Stabili- zation of delphinidin in complex with sulfobutylether--cyclodextrin allows for antinociception in inflammatory pain [M]// Antioxidants & Redox Signaling. Larchmont, NY: Mary Ann Liebert, Inc., 2020.
[18] HEYSIEATTALAB S, SADEGHI L. Effects of delphinidin on patho- physiological signs of nucleus basalis of meynert lesioned rats as animal model of alzheimer disease [J]. Neurochem Res, 2020, 45(7): 1636–1646. doi: 10.1007/s11064-020-03027-w.
[19] LIN B M, ZHENG K B, ZHANG S, et al. Studies on antioxidant and-glucosidase inhibitory activities of ethanol extracts from peels and seeds of jaboticaba at different maturities [J]. J Trop Subtrop Bot, 2018, 26(3): 233–240. doi: 10.11926/jtsb.3831.
林宝妹, 郑开斌, 张帅, 等. 不同成熟度树葡萄果实醇提取物抗氧化和抑制-葡萄糖苷酶活性研究[J]. 热带亚热带植物学报, 2018, 26(3): 233–240. doi: 10.11926/jtsb.3831.
[20] CHENG Z Y, RE J, YAN G T, et al. Quantitative elucidation of the molecular mechanisms of hydroxyl radical quenching reactivity of phenolic compounds [J]. Bioorg Chem, 2003, 31(2): 149–162. doi: 10. 1016/s0045-2068(03)00027-0.
[21] ZHANG M. Evaluation of several methods of antioxidant testing[D]. Xi’an: Shaanxi Normal University, 2010: 1–12.
张明. 几种体外抗氧化检测方法的评价研究 [D]. 西安: 陕西师范大学, 2010: 1–12.
[22] Liu Y H, JU Y. Construction of safety risk assessment system for cosmetic plant extracts [J]. Beijing Daily Chem Ind, 2016(2): 21–25.
刘宇红, 琚瑶. 化妆品植物提取物安全风险评估体系建设 [J]. 北京日化, 2016(2): 21–25.
[23] ZOU C Y, LIU Y. Research advances inresearch in China [J]. J Anhui Agric Sci, 2010, 38(12): 6164–6166,6223. doi: 10.3969/j. issn.0517-6611.2010.12.035.
邹成勇, 刘燕. 我国石斛属植物研究进展 [J]. 安徽农业科学, 2010, 38(12): 6164–6166,6223. doi: 10.3969/j.issn.0517-6611.2010.12.035.
[24] ZHU H, HUANG X C, YANG H G, et al. Research progress of polysaccharides from[J]. Her Med, 2007(12): 1476–1479. doi: 10.3870/j.issn.1004-0781.2007.12.040.
朱华, 黄学萃, 杨海广, 等. 石斛属多糖的研究进展 [J]. 医药导报, 2007(12): 1476–1479. doi: 10.3870/j.issn.1004-0781.2007.12.040.
[25] YANG Y L, LAI P F, JIANG S P. Research progress of[J]. J Shandong Univ Trad Chin Med, 2008, 32(1): 82–85. doi: 10.3969/j.issn.1007-659X.2008.01.029.
杨一令, 来平凡, 蒋士鹏. 铁皮石斛的研究进展 [J]. 山东中医药大学学报, 2008, 32(1): 82–85. doi: 10.3969/j.issn.1007-659X.2008.01. 029.
[26] SONG X Q, LUO Y B, ZHONG Y F, et al. Advances in the biote- chnology oforchid[J]. Acta Hort Sin, 2005, 32(4): 741– 747. doi: 10.3321/j.issn:0513-353X.2005.04.048.
宋希强, 罗毅波, 钟云芳, 等. 石斛属植物生物技术研究概况 [J]. 园艺学报, 2005, 32(4): 741–747. doi: 10.3321/j.issn:0513-353X.2005. 04.048.
Component Analysis ofAnthocyanin Extract and Its Antioxidant Activity and Irritation
LÜ Xiao-fan, ZHOU Xin-hong, WANG Ying, WU Ya-ni*
(School of Design, Shanghai Jiaotong University, Shanghai 200240, China)
In order to understand the function of anthocyanin from tropicalorchid, the anthocyanin of‘Sanya Sunny’ was extracted by ultrasonic-assisted method, the constituents of anthocyanin extract was analyzed by UPLC-QTOF-MS. The total antioxidant capacity (FRAP) and the scavenging capacity of diphenyl picroacyl (DPPH·) of the extract were determined, and ascorbic acid was used as a positive control to evaluate its antioxidant capacity. Rabbit skin irritation and eye irritation experiments were used to evaluate the irritation of extract. The results showed that a total of 15 anthocyanins were detected in the extract, such as aglycones include delphinium pigment, cyanidin, mallow pigment, petunia pigment and peony pigment. The extract has strong antioxidant activityThe scavenging ability of DPPH· and total antioxidant ability are both stronger than ascorbic acid at the same concentration. There were not irritation on rabbit eyes and skin treated with 0.25-1.0 g/L extract. Therefore, it was suggested that besides ornamental value,‘Sanya Sunny’ also had broad application space in medicine, food and cosmetics fields.
; Anthocyanins; Antioxidant; Safety experiment
10.11926/jtsb.4327
2020–10–27
2020–12–31
吕晓帆(1998~ ),在读硕士研究生,研究方向为芳香植物资源与应用。E-mail: Fanya.L@sjtu.edu.cn
E-mail: ynwu@sjtu.edu.cn
猜你喜欢
杂志排行
热带亚热带植物学报的其它文章
- Advances in Chemical Constituents and Pharmacological Activities of Pleuropterus multiflorus
- 成都地区19个木芙蓉品种的孢粉学研究及其分类学意义
- 龙珠果茎段离体培养和组培苗耐盐性分析
- 谷子产量和品质相关性状的杂种优势及遗传特性分析
- Cloning and Expression Analysis on PmPGK1 and PmGPIC Genes in Pinus massoniana
- Michelia taishanensis Y. H. Tong, X. E. Ye, X. H. Ye & Yu Q. Chen (Magnoliaceae), A New Species from Guangdong
