血清脂蛋白相关磷脂酶A2、脂质代谢与儿童阻塞性睡眠呼吸暂停低通气综合征严重程度的相关性分析
2021-08-10郭宇彭韶
郭宇,彭韶
(郑州大学第一附属医院 儿科,河南 郑州 450000)
儿童阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是儿童于睡眠期间出现的异常呼吸节律现象,其特征为上呼吸道长时间部分阻塞或间歇性完全阻塞,影响睡眠期间的正常通气和睡眠模式[1]。近年来,OSAHS在儿童中的发病率升高明显,如不及时治疗、纠正睡眠模式,则会影响患儿正常能量代谢、生长发育、精神状态及学习生活,导致患儿出现腺样体面容、生长发育迟缓、易激惹、学习成绩下降。脂蛋白相关的磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)是由巨噬细胞、肥大细胞等分泌的新型炎症标志物[2],外周血Lp-PLA2升高在成人OSAHS患者中常提示存在血管炎性反应,并发动脉粥样硬化的风险增加[3],高Lp-PLA2和血脂水平可预测心脑血管风险及不良预后[4]。但研究Lp-PLA2对儿童OSAHS疾病的发生进展的影响较为少见。通过研究OSAHS患儿外周血中Lp-PLA2的水平及脂质代谢的情况,分析Lp-PLA2、血脂代谢情况与儿童OSAHS疾病严重程度的关系。
1 资料与方法
1.1 研究对象选取2018年1月至2020年10月在郑州大学第一附属医院住院治疗的OSAHS患儿151例,年龄3~13岁,平均(7.24±2.60)岁,其中男87例,女64例。
1.2 分组利用PSG记录AHI,根据美国麻醉医师协会[5]对儿童OSAHS疾病严重程度分级标准,将收集的OSAHS患儿分为轻度组(5次·h-1≥AHI>1次·h-1)46例,年龄3~13岁,平均(8.07±1.51)岁,其中男27例,女19例;中度组(10次·h-1≥AHI>5次·h-1)51例,年龄3~13岁,平均(8.50±1.76)岁,其中男31例,女20例;重度组(AHI>10次·h-1)54例,年龄3~13岁,平均(7.89±2.02)岁,其中男29例,女25例。选择50例同期于郑州大学第一附属医院体检的健康儿童,作为对照组,年龄3~13岁,平均(7.63±2.51)岁,其中男26例,女24例。4组间一般资料比较,差异无统计学意义(P>0.05)。本研究由郑州大学第一附属医院医学伦理委员会审核通过,并提前告知儿童及家属检查目的取得对方同意,儿童家属已签知情同意书。
1.3 选取标准
1.3.1OSAHS患儿 (1)纳入标准:①年龄3~13岁;② 8 h多导睡眠监测仪(polysomnography,PSG)记录呼吸暂停低通气指数(apnea hypopnea index,AHI)>1次;③伴有呼吸暂停、张口呼吸、打鼾、日间贪睡等症状。(2)排除标准:①患有严重心肺疾病;②其他严重睡眠障碍;③中枢性睡眠呼吸暂停低通气综合征;④丧失自我控制能力的精神病;⑤服用阿片类药物;⑥神经肌肉疾病;⑦先天性颜面部畸形及外伤;⑧先天性呼吸系统发育不良;⑨遗传代谢异常;⑩既往行上呼吸道手术等。
1.3.2对照组 (1)纳入标准:①年龄3~13岁;②既往体健,无先天性、遗传性、传染性疾病,无使用激素等药物史,无外伤、手术、输血史;③生长发育与同龄儿相符,随社会计划免疫接种,无不良反应;④精神智力正常,具有自我意识可正常交流。(2)排除标准:①鼻塞、流涕、咽腔不适、咳嗽、咳痰、喘息等呼吸道疾病症状;②张口呼吸、呼吸暂停、打鼾、日间嗜睡等睡眠障碍症状;③家族鼾症史。
1.4 观察指标
1.4.1一般资料采集 基础信息:性别、年龄、体质量指数(body mass index,BMI)、血压。临床病史:主要症状、伴随症状、既往史、生长发育史、家族史。
1.4.2PSG监测 采用PSG(美国 Alice4及Sandman Elite)对OSAHS患儿进行连续8 h的睡眠呼吸监测,由同一监测人员进行操作及记录,记录AHI值。
1.4.3生化指标 所有患儿入院完成PSG后采集晨起7:30至8:00空腹状态下静脉血标本3 mL,3 500 r·min-1离心10 min后,由全自动酶联免疫分析仪检测血清Lp-PLA2、 低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)水平,检验试剂盒分别来自于美国Rapidbio公司、天津康尔克生物科技有限公司。

2 结果
2.1 一般资料4组性别、年龄、BMI、收缩压、舒张压差异无统计学意义(P>0.05)。见表1。
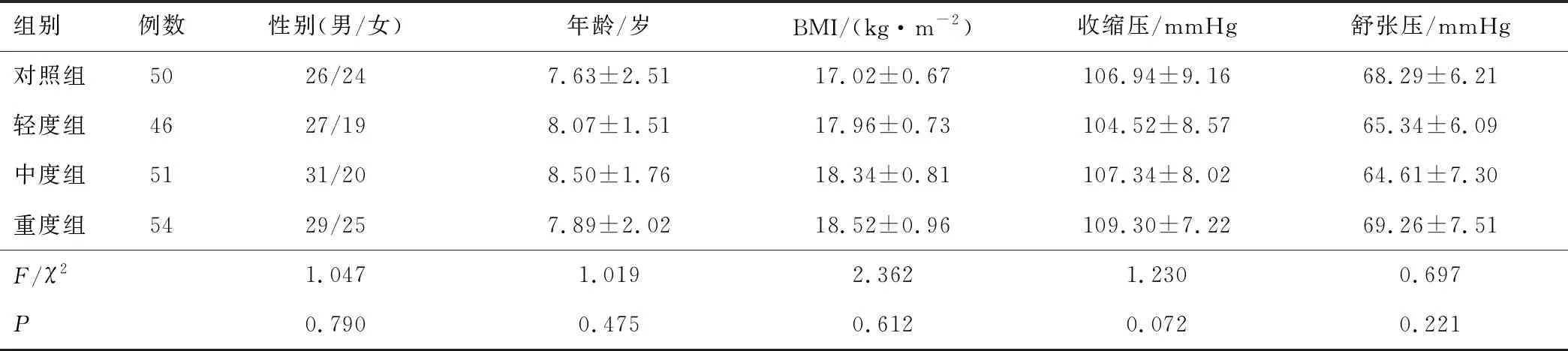
表1 4组一般资料比较
2.2 生化指标轻度组、中度组、重度组外周血Lp-PLA2、LDL、TG、TC高于对照组(P<0.05);轻度组、中度组、重度组外周血HDL低于对照组(P<0.05);重度组外周血Lp-PLA2、LDL、TG、TC高于轻度组、中度组(P<0.05);重度组外周血HDL低于轻度组、中度组(P<0.05);中度组外周血Lp-PLA2、LDL、TG高于轻度组(P<0.05);中度组外周血HDL、TC较轻度组差异无统计学意义(P>0.05)。见表2。

表2 4组Lp-PLA2、LDL、HDL、TG、TC水平比较
2.3 OSAHS患儿生化指标与AHI的相关性分析OSAHS患儿血清Lp-PLA2、LDL、TG与AHI呈正相关(P<0.05),HDL与AHI呈负相关(P<0.001)。见表3。

表3 OSAHS患儿血清生化指标与AHI的相关性
3 讨论
OSAHS为慢性呼吸系统疾病,其发生发展主要是由狭窄或可折叠等上呼吸道的解剖学异常导致,同时伴有非解剖学因素,包括呼吸兴奋阈值降低,呼吸驱动减退等[6]。OSAHS在学龄前儿童多表现为呼吸暂停、频发觉醒、遗尿、虚汗;学龄期儿童则多表现为张口呼吸、间断打鼾、异常的胸腹呼吸运动[7]。OSAHS患儿常因早期症状不明显、特异性较低未能引起患儿家属重视或出现误诊,后因长期睡眠呼吸紊乱影响正常能量代谢、免疫调节,出现腺样体面容、生长发育迟缓、异常体质量增长、胸闷等症状后才入院治疗。
OSAHS是心血管病、脑卒中发病率及死亡率的独立危险因素,Quan等[8]发现OSAHS患儿长期气道扩张受限或气道提前关闭会导致夜间呼吸受限而出现慢性间歇性低氧(chronic intermittent hypoxia,CIH),CIH导致交感-迷走平衡紊乱使心率变异性增加,同时可导致钾离子水平升高,去除高血糖、高血压等疾病的影响,OSAHS严重程度的增加可使心血管病发病率及死亡率进一步提高。Möller-Levet等[9]发现睡眠限制可改变外周血细胞基因表达,包括PRDX2、PRDX5等免疫细胞活化通路和SLC2A3、SGHLC25、ABCA1等脂质代谢通路上调,当睡眠受限加重可出现累积效应,循环系统的慢性炎症导致机体出现心血管疾病、代谢性疾病等病理状态。
Lp-PLA2是由人PLA2G7基因编码的一种钙依赖性脂肪酶,主要由成熟的单核巨噬细胞、肥大细胞产生[10]。Northern印迹分析表明,当组织或器官(如扁桃体、腺样体、胸腺、胎盘)内有大量巨噬细胞时能表达高水平的Lp-PLA2mRNA,该水平在单核细胞分化过程中可持续存在[11]。在低氧状态下,氧化应激反应产生的氧自由基可激活Lp-PLA2活性[12],激活后的Lp-PLA2在外周血循环过程中可与LDL和HDL生成炎症复合物,形成炎症级联反应[13]。Bonnefont-Rousselot等[14]发现,Lp-PLA2在动脉粥样硬化斑块的坏死中心表达明显升高,可将Lp-PLA2作为心血管疾病的独立风险指标,并且用作临床风险预测的辅助手段。Bekci等[15]发现,男性OSAHS患者睡眠期间觉醒次数增加可出现Lp-PLA2、TG、TC升高(P<0.05),Lp-PLA2水平与觉醒独立相关(P=0.002),夜间觉醒作为OSAHS直观表现方式,OSAHS患者夜间觉醒增多,导致交感神经兴奋性增加,心率加快、血管损伤加重,为OSAHS患者继发心血管疾病提供血流动力学障碍依据。Moise等[16]发现,OSAS患者Lp-PLA2水平升高(P<0.05),在患有代谢综合征的OSAHS患者表现明显,Lp-PLA2水平可与AHI呈正相关(P=0.015),表明OSAHS患者Lp-PLA2等炎症标志物的增加可与内皮损伤和动脉粥样硬化的发展相关。OSAHS患儿体内Lp-PLA2水平较对照组明显升高,且随AHI升高而升高,符合目前研究现状,由于儿童仍处于生长发育阶段,免疫调节机制尚不完善,对于OSAHS应激反应较明显,Lp-PLA2水平升高,且长期OSAHS可使机体出现持续性损伤加重,出现免疫组织和器官代偿性增生,使Lp-PLA2水平依赖性升高,心血管疾病风险升高。
OSAHS患者由于夜间呼吸睡眠不稳定出现食欲升高、运动量降低,其肥胖风险及速度与健康人群相比日益提升。Karkinski等[17]发现同等BMI水平的OSAHS患者TG、TC、LDL水平明显升高,HDL明显降低(P<0.05),表明OSAHS可通过胰岛素敏感度降低、胰岛素抵抗等在非肥胖患者的脂质代谢障碍中起重要作用。Nadeem等[18]对OSAHS患者的一项荟萃分析中发现,OSAHS患者TG水平升高,HDL降低,且与AHI密切相关(P=0.001),表明OSAHS患者HDL、TG水平的改变与CIH导致机体全身炎症水平升高、白介素-1等促血管内皮LDL、TG代谢的细胞因子生成增多有关,同时OSAHS严重程度增加,氧化物生成增多,脂肪细胞脂解,脂质过氧化也可促进OSAHS体内血脂异常代谢加重与累积。OSAHS患儿与对照组比较,结果显示LDL、TG、TC水平明显升高,且随疾病严重程度升高而升高,HDL水平降低,随疾病严重程度升高而降低,符合目前研究现状,儿童由于神经及内分泌系统尚未完善,基础代谢率较高,当出现睡眠障碍时,神经-内分泌系统紊乱,且由于嗜睡、精神状态低下,代谢减慢,出现恶性循环,出现代谢综合征的风险升高。
血清Lp-PLA2、脂质代谢与OSAHS患儿疾病严重程度的相关性研究表明,OSAHS患儿存在慢性炎症反应及异常能量代谢,且随着严重程度升高而加重。传统OSAHS诊断存在耗时较长、操作复杂、舒适度低等缺点,患儿不易配合,可通过检测外周血Lp-PLA2、血脂水平了解OSAHS患儿疾病进展、心血管疾病及代谢性疾病的风险情况,为OSAHS患儿早期预防、病情诊疗、生活管理提供了方向。
