含全身放疗方案与白消安方案预处理治疗复发/难治急性髓系白血病疗效的对比分析
2021-08-10刘圆圆费新红张书芹温红霞王静波
刘圆圆,费新红,张书芹,温红霞,王静波
(航天中心医院 血液科,北京 100049)
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是治疗中、高危患者急性髓系白血病(acute myeloid leukemia,AML)的首选方法,预处理方案的优劣直接影响患者的预后。传统的预处理方案有白消安联合环磷酰胺(Bu/Cy)和全身照射联合环磷酰胺(TBI/Cy)方案,Blaise等[1]研究表明,对于缓解期接受全身放疗(total body irradiation,TBI)预处理的患者,其总生存率和无白血病生存率具有显著优势,且复发率较低,但大型荟萃分析显示,两种方案的生存率相似[2-3]。那么对于那些对多种化疗药耐药的复发/难治急性髓系白血病采用以全身放疗为基础的清髓方案(total body irradiation-myeloablative conditioning regimen,TBI-MAC)是否具有优势,目前还没有明确推荐。本研究对近年来进行allo-HSCT的复发/难治急性髓系白血病患者进行回顾分析。
1 病例与方法
1.1 病例本研究回顾分析航天中心医院2012年5月至2017年12月进行异基因造血干细胞的135例复发/难治的急性髓系白血病的临床资料,其中69例接受TBI-MAC方案预处理,66例接受以白消安为基础的清髓方案(BU-MAC)。排除标准为:(1)年龄小于18岁;(2)既往曾行allo-HSCT或自体移植及脐带血或无关供者移植。观察的指标包括两组患者的疾病特征;移植相关合并症;复发率、无病生存率及总生存率等。本研究经航天中心医院生物医学伦理委员会批准(20170305-XJS-02),全部患者及其供者均知情同意。
1.2 复发/难治AML诊断标准复发性AML:完全缓解(complete response,CR)后外周血再次出现白血病细胞或骨髓中原始细胞>0.050(除外巩固化疗后骨髓再生等其他原因)或髓外出现白血病细胞浸润。难治性AML:经过标准方案治疗2个疗程无效的初治病例;CR后经过巩固强化治疗,12个月内复发者;12个月后复发但经过常规化疗无效者;2次或多次复发者;髓外白血病持续存在者[4]。
1.3 预处理方案的选择移植前对患者的治疗情况进行评估,在TBI或BU的基础上优先选择可能有效的化疗药物,心、肝、肾等重要器官功能较差的患者可用氟达拉滨(FLU)代替环磷酰胺。氟达拉滨耐药的难治复发AML患者接受克拉屈滨联合中剂量阿糖胞苷及粒细胞集落刺激因子(CLAG)方案代替氟达拉滨联合中剂量阿糖胞苷及粒细胞集落刺激因子(FLAG)方案。若移植前有髓外白血病浸润的患者优先选择含TBI的预处理方案。单倍体移植预处理加用抗人T淋巴细胞免疫球蛋白。
1.4 植活标准外周血中性粒细胞计数连续3 d≥0.5×109L-1为白细胞植活,在未输注血小板的情况下,血小板连续7 d≥20×109L-1为血小板植活[5]。通过短串联重复序列证实为供者细胞植入。
1.5 移植物抗宿主病的诊断标准及预防诊断根据Fred Hutchinson的移植物抗宿主病(graft versus host disease,GVHD)标准[6]。GVHD的预防采用环孢素/他克莫司、霉酚酸酯及短程甲氨蝶呤方案。

2 结果
2.1 临床资料本研究共纳入复发/难治AML患者135例,其中69例患者接受TBI-MAC预处理,66例接受BU-MAC预处理。BU总剂量中位数为12.8(11.2,12.8)mg·kg-1,TBI剂量为12 Gy(照射源为钴60,剂量率为6 cGy·min-1,照射方式为分次照射)。移植前中枢神经系统白血病未转阴的患者接受了全脑及全脊髓的放疗,患者的疾病特征和移植类型见表1。两组患者性别、疾病的状态、细胞遗传学/分子生物学、从诊断到移植的时间、供受者的性别、血型以及移植前合并症指数差异无统计学意义。TBI-MAC组较BU-MAC组移植前原始细胞比率更高(P<0.05),髓外浸润的患者比率较高。航天中心医院使用这两个方案时对移植前肿瘤负荷高、髓外浸润的患者更倾向于以TBI为基础的方案。干细胞的来源及输注细胞在两组之间没有区别,从移植类型上比较BU-MAC组同胞相合患者居多(P<0.05)。

表1 患者的诊断及临床特征
2.2 植入情况TBI-MAC组66例患者顺利植入,白细胞植活的中位时间为20(10~26)d,血小板植活的中位时间16(8~90)d;BU-MAC组63例顺利植入,白细胞植活的中位时间15(8~25)d,血小板植活的中位时间13(7~52)d,两组间比较,差异无统计学意义(P>0.05)。
2.3 GVHD的发生情况两组GVHD发生率的比较,TBI-MAC组32例发生急性GVHD,发生率为46.4%,BU-MAC组27例发生急性GVHD,发生率为40.9%,两组间比较,差异无统计学意义(P>0.05),其中TBI-MAC组Ⅱ~Ⅳ GVHD发生率相对较高,但与BU-MAC组比较,差异无统计学意义(P>0.05)。在可评估的患者中,两组慢性GVHD的发生率分别为42.0%和51.5%,两组间比较,差异无统计学意义(P>0.05)。见表2。
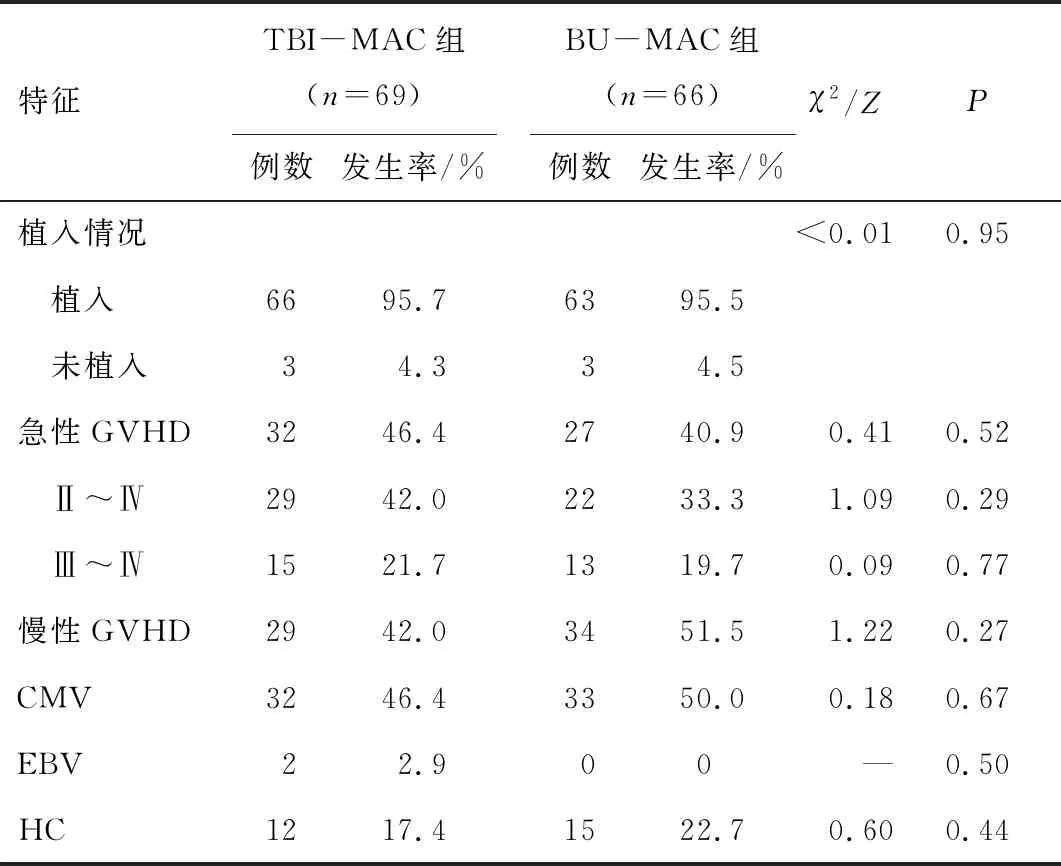
表2 allo-HSCT的植入情况及合并症
2.4 病毒感染的发生率移植100 d内TBI-MAC组32例发生巨细胞病毒(CMV)血症,累积发病率为46.4%,BU-MAC组33例患者发生CMV血症,累积发病率为50.0%,两组间比较,差异无统计学意义(P>0.05);TBI-MAC组2例发生EB病毒血症,累积发病率为2.9%,BU-MAC组无EB血症发生;TBI-MAC组12例发生出血性膀胱炎(HC),累积发病率为17.4%, BU-MAC组15例患者发生HC,累积发病率为22.7%,两组间比较,差异无统计学意义(P>0.05)。见表2。
2.5 复发率及非复发死亡率TBI-MAC组复发的中位时间是4(2~10)个月,2 a的累积复发率为(47.7±7.1)%;BU-MAC组复发的中位时间5(2~22)个月,2 a的累积复发率BU-MAC组为(46.9±9.3)%,两组间比较,差异无统计学意义(P=0.25);TBI-MAC组非复发死亡率为(25.0±6.3)%,BU-MAC组为(22.4±6.0)%,两组间比较,差异无统计学意义(P=0.69)。见图1、2。

图1 两组患者复发率比较
2.6 无病生存率和总生存率中位随访时间为20(4~68)个月。移植后2 a TBI-MAC组和BU-MAC组无病生存率分别为(41.1±6.0)%、(37.2±6.5)%,两组间比较,差异无统计学意义(P=0.76);TBI-MAC组2 a的总生存率为(42.3±6.1)%,BU-MAC组为(42.2±7.0)%,两组间比较,差异无统计学意义(P=0.49)。见图3、4。

图2 两组患者非复发死亡率比较
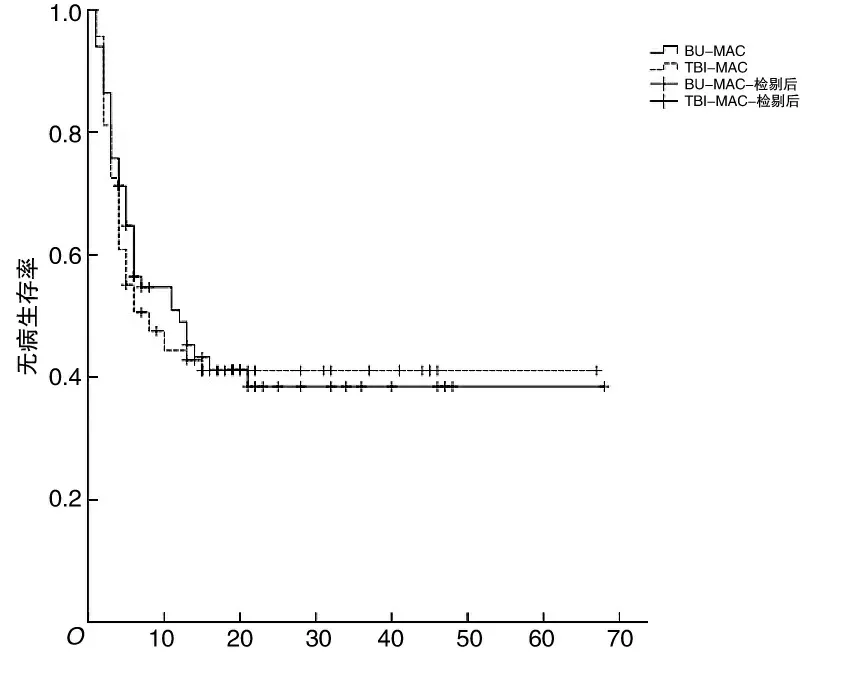
图3 两组患者无病生存率比较

图4 两组患者总生存率比较
2.7 死亡原因分析135例患者移植后73例患者死亡,TBI-MAC组39例,BU-MAC组34例,死亡的原因均以复发为主,其次是感染和GVHD。见表3。
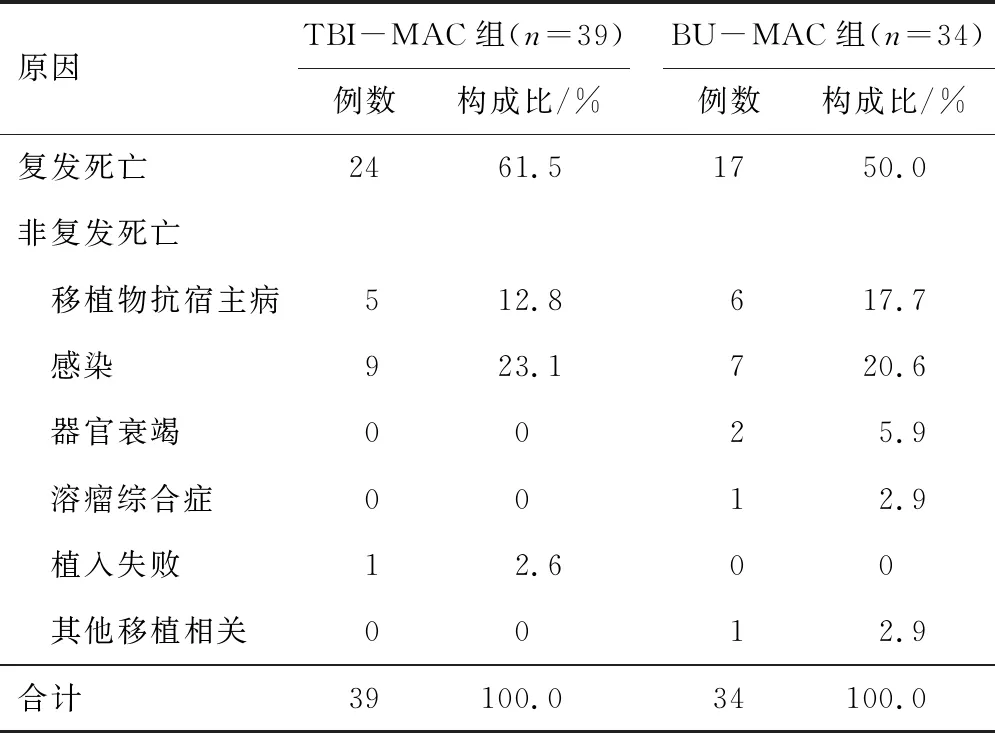
表3 两组患者死亡原因分析
3 讨论
allo-HSCT治疗AML的预处理方案,回顾性分析和荟萃分析关于TBI-MAC是否优于BU-MAC无明确的答案[7-8]。有研究表明,TBI-MAC患者口服BU可以降低复发率,且无病生存率高[9];而接受静脉BU治疗的患者,由于BU的副作用减少,患者的生存率提高,获得了与TBI-MAC相似的结果[3]。另一项来自国际血液和骨髓移植研究中心的回顾性分析显示,对于第1次缓解期AML患者,BU组的无病生存率和总生存率优于TBI组,复发率相近,非复发死亡率低[10]。那么在治疗复发/难治的AML患者是不是有相似的结果,未见到大样本量的病例报道。
本研究回顾性分析了航天中心医院5 a间收治的135例复发/难治AML,69例接受TBI-MAC方案,66例接受BU-MAC方案。移植后2 a TBI-MAC组的累积复发率为(47.7±7.1)%,BU-MAC组为(46.9±9.3)%,非复发死亡率TBI-MAC组为(25.0±6.3)%,BU-MAC组为(22.4±6.0)%,两组间比较,差异无统计学意义(P>0.05)。TBI-MAC方案进行allo-HSCT,其合并症与BU-MAC方案比较,差异无统计学意义,两组急性GVHD的发生率分别为46.4%和40.9%,其中Ⅱ~Ⅳ发生率分别为42.0%和33.3%,两组间比较,差异无统计学意义(P>0.05);慢性GVHD的发生率在两组中分别为42.0%和51.5%,两组间比较,差异无统计学意义(P>0.05),进一步证实TBI-MAC在治疗复发/难治AML患者时与BU-MAC安全性相当。
多项研究表明对于复发/难治AML患者,外周血幼稚细胞、疾病状态、染色体核型以及供者的类型都是判断预后的指标[11-12]。由于治疗组的分配不是随机的,本研究中TBI-MAC组原发耐药患者多,有髓外浸润,细胞遗传学/分子遗传学预后不良的患者较多,而且移植前的肿瘤负荷较BU-MAC组高(P<0.05),这些差异提示TBI-MAC组的危险度更高,但移植后的复发率两组无明显差异,提示TBI-MAC对于预后极差的患者还是有一定的优势。而且TBI具有射线剂量分布均匀、无肿瘤细胞的庇护、与化疗药物无交叉耐药性、不需要解毒和排泄等优势,因此在复发/难治白血病中应用广泛[13-14]。从本研究统计结果可以看出,复发是两组复发/难治AML患者主要的死亡原因,除了可以应用新药和新技术降低移植前肿瘤负荷,改进预处理方案也可以降低非复发死亡率,提高生存率。近年来,有研究报道采用TBI联合BU或马法兰预处理可使患者的非复发死亡率降低,无病生存率提高[15-16]。同时移植后定期检测患者的残留白血病,根据患者的疾病状态早期减停免疫抑制剂及免疫治疗也是改善患者的预后,提高生存率的关键[17]。
综上,对于难治复发的患者,降低复发率是提高患者生存率的关键,因此在选择allo-HSCT治疗复发/难治急性髓系白血病的患者时,对于那些对多种化疗药耐药、细胞倍增比较快以及肿瘤侵袭性较强的患者,可以考虑优先选择以TBI为基础的方案降低复发率。
