生物炭及其老化对杉木林土壤养分含量和微生物群落组成影响的室内模拟*
2021-08-10张燕林黄彩凤包明琢周垂帆何宗明
张燕林 黄彩凤 包明琢 周垂帆 何宗明
(福建农林大学林学院 人工林可持续经营福建省高校工程研究中心 福州 350002)
杉木(Cunninghamialanceolata)由于生长快、材质好、产量高,是我国南方重要的用材树种。但近些年来杉木人工林经营普遍出现了退化,即产量随栽植代数增加而递减,严重影响杉木人工林持续经营,这主要是由土壤质量下降导致的(夏丽丹等,2018)。Yu等(2017)研究指出杉木连栽会导致土壤pH值、有效磷等含量下降;刘丽等(2013)研究表明,杉木土壤细菌多样性及丰度随栽植代数增加不断下降,影响了养分归还效率;Liu等(2010)研究发现,土壤微生物生物量及群落多样性随连栽而降低。因此,如何缓解杉木人工林地力衰退,改善杉木林土壤质量,已成为森林经营研究的热点之一。
生物炭是农作物秸秆、木材、采伐枝叶、动物粪便等生物质在300~700 ℃的高温厌氧条件下热解产生的一种多孔碳质材料(Quanetal.,2020)。多数研究表明,生物炭不仅可用于污染土壤修复,还能提高土壤肥力、改良酸性土壤、促进作物生长(Farrelletal.,2013),生物炭作为一种新型改良剂,在农田土壤中的效益已得到了许多认证并广泛应用。微生物群落能快速响应土壤环境变化,对土壤质量变化有重要指示作用,因此也受到研究者广泛关注(Klimeketal.,2015)。胡华英等(2019a)研究发现,添加生物炭能有效提高杉木人工林土壤有效磷、速效钾等养分含量,同时还会引起细菌群落变化。Li等(2019)研究发现,添加生物炭促进了杉木人工林凋落物分解,减少了土壤有机碳矿化。Zhou等(2020)研究也发现,杉木叶制成的生物炭显著提高了杉木林土壤全磷和速效磷含量,同时也增加了土壤细菌多样性。然而,生物炭用于我国南方环境中会在降雨、土壤酸化等其他生物与非生物因子的长期干扰下发生老化,这会导致其自身理化性质改变,如降低其自身的芳香性、pH值、灰分含量,增加含氧官能团的表面密度等(林庆毅等,2017;Renetal.,2016;Liuetal.,2019)。目前对生物炭在杉木林土壤质量改良方面的研究已取得了一定进展,但应用的生物炭在经历长期老化后对杉木林土壤养分及微生物群落组成等的作用鲜有报道,这限制了对生物炭在杉木林土壤中长期使用效果的认识,同时也限制了生物炭在杉木林经营中的使用。
有鉴于此,本研究依据杉木人工林生长区降雨多及土壤酸化日益严峻的特点,对生物炭进行水洗和酸化处理,以此模拟生物炭在自然环境中的老化。基于高通量测序技术,研究生物炭老化前后对土壤微生物群落组成的影响,分析土壤主要养分状况,探究生物炭不同处理下对土壤主要养分与主要微生物群落组成的影响及其相互作用机制。深入认识生物炭及其老化对杉木人工林土壤性质的影响,为我国南方红壤林地的生物炭长期使用提供科学依据,对缓解杉木人工林连栽生产力下降有重要理论和实践意义。
1 材料与方法
1.1 试验材料及其制备 土壤样品采自福建省南平市王台镇第2代杉木人工林(117°57′E,26°28′N)的酸性红壤。于第2代杉木人工林林分内设置一个20 m × 20 m的样地,依据“S”形取样法采集多点0~20 cm土层的土样,将土样充分混合过2 mm筛,经自然风干后保存备用。同时以在同一样点采集的杉木叶为原料,洗净后在80 ℃下干燥,磨碎过1 mm筛,将制备的杉木叶粉末置于600 ℃的马弗炉中进行4 h的缺氧炭化,升温速率为20 ℃·min-1,待其冷却后即可获取600 ℃生物炭(biochar,BC)(Lietal.,2019)。将80 g BC与1 L的超纯水混合液在70 ℃的温度下保持6 h后分3次用1 L的超纯水淋洗,每次间隔2 h,烘干后即可获取水洗老化生物炭(washed aged biochar,WBC)(林庆毅等,2017)。另取BC 80 g,将其与500 mL 20%的H2O2混合并进行1天的振荡后重新加入等量的20% H2O2进行2天的氧化,烘干后即可获取酸化老化生物炭(acidified aged biochar,OBC)(文方园等,2016)。通过测定BC、WBC和OBC的基本性质,得到对应的pH值为10.34±0.01、10.03±0.01、9.63±0.02,灰分含量为21.72%±0.17%、10.46%±0.64%、9.48%±0.05%,速效钾含量为(1 414.20±13.11)、(1 098.80±17.47)、(1 020.40±12.00)mg·kg-1,全碳含量为(562.00±10.21)、(680.30±1.01)、(665.73±0.39)mg·kg-1,全氮含量为(19.80±0.23)、(20.13±0.23)、(21.07±0.18)mg·kg-1。
1.2 试验处理 向供试土壤中分别以3%的比例加入制备的3种生物炭,同时设置一组对照,即共有4组处理,具体为:1)土壤中未加生物炭,对照组(CK);2)土壤中加入3%的BC;3)土壤中加入3%的WBC;4)土壤中加入3%的OBC。每组处理设3个重复,将样品置于25 ℃、黑暗的培养箱中进行150天的培养,培养期间每隔2~3天对样品进行称重补水以维持土壤湿度为田间持水量的60%。培养结束后取部分土样用于理化性质测定,另一部分置于-80 ℃下保存,用于土壤微生物群落组成的分析。
1.3 土壤pH值及主要养分含量测定 以不含CO2的蒸馏水为提取液,按1∶2.5的固液比获取悬浮液后用pH计测定pH值;使用全自动微量分析仪(VARIO MAX 德国ELEMENTAR)测定土壤全碳(TC)和全氮(TN)含量;以 1 mol·L-1CH3COONH4为提取液,按1∶10的固液比进行浸提后用原子吸收分光光度计测定速效钾(AK)含量;以 2 mol·L-1的KCl溶液按1∶10的固液比进行浸提后使用连续流动分析仪测定铵态氮(NH4+-N)和硝态氮(NO3--N)含量,同时取部分上清液过0.45 μm滤膜后用总有机碳(总氮)分析仪(SHIMADZU TOC-VCPH/CPN Analyzer 日本岛津)测定溶解性有机碳(dissolved organic carbon,DOC)和溶解性有机氮(dissolved organic nitrogen,DON)含量。
1.4 土壤微生物性质测定 从新鲜土样中提取DNA后,利用特异性引物扩增细菌16S rDNA基因的V3—V4区(引物序列为:ACTCCTACGGG AGGCAGCAG;GGACTACHVGGGTWTCTAAT)(Jiaoetal.,2016)以及真菌ITS1基因的ITS1—ITS2区(引物序列为CTTGGTCATTTAGAGGAAGTAA;TGCGTTCTTCATCGATGC)(Schochetal.,2012)。两者的扩增反应体系均由1 μL Forward Primer (5 μmol·L-1)、1 μL Reverse Primer (5 μmol·L-1)、3 μL BSA (2 ng·μL-1)、12.5 μL 2×Taq Plus Master Mix、7.5-X μL ddH2O和30 ng模版DNA组成。反应程序为在94 ℃保持5 min进行预变性后,在94 ℃保持30 s进行变性、55 ℃保持30 s进行退化、72 ℃保持30 s进行延伸这一流程中循环28次,最后在72 ℃保持7 min进行延伸(Zhouetal.,2020)。完成PCR扩增获取扩增产物后将同一样本的产物进行混合,利用2%的琼脂糖凝胶电泳对混合后的产物进行检测后交由北京奥维森科技有限公司使用 Illumina Misep PE300测序平台进行高通量测序。
1.5 数据处理分析 测序完成后过滤掉碱基质量分数低于20的序列,使用Trimmomatic和Pear软件过滤50 bp以下的序列并进行拼接,最后使用usearch软件去除嵌合体和短序列从而获取有效序列(Haasetal.,2011;Wangetal.,2007)。使用uparse软件(usearch v10.0.420)对所有的有效序列按照97%的相似度进行操作分类单元(operational taxonomic units,OTUs)的划分(Edgar,2013)。分别使用Silva(Release128 http:∥www.arb-silva.de)和Unite (Release 7.2 http:∥unite.ut.ee/index.php)数据库完成对细菌和真菌分类信息的注释(Quastetal.,2012;Kõljalgetal.,2013)。使用SPSS 19.0软件对土壤养分和主要优势微生物的数据进行单因素方差(ANOVA)分析,采用最小显著性差异法LSD分析不同处理间的显著性(P<0.05)。
2 结果与分析
2.1 生物炭处理对土壤pH值及主要养分含量的影响 不同生物炭处理下的土壤pH值及主要养分含量测定结果见图1。老化前后生物炭的添加均能显著提高土壤pH值及速效钾(available potassium,AK)、全碳(total carbon,TC)、全氮(total nitrogen,TN)等的含量,其中BC对土壤pH值和AK含量的促进效果与老化生物炭相比更显著,而对土壤TC的促进效果却不及老化生物炭。与CK相比,添加BC能显著提高土壤DOC含量(323.13 mg·kg-1),而WBC和OBC处理的土壤DOC含量却显著降低,分别为236.80和239.43 mg·kg-1。与CK相比,OBC处理显著降低了土壤DON含量,低至56.71 mg·kg-1。此外,老化前后生物炭的添加对土壤NH4+-N和NO3--N含量的影响也不同。与CK相比,BC添加显著增加了土壤NO3--N含量,WBC添加显著增加了土壤NH4+-N含量,而OBC添加对土壤NH4+-N和NO3--N含量均无显著影响。
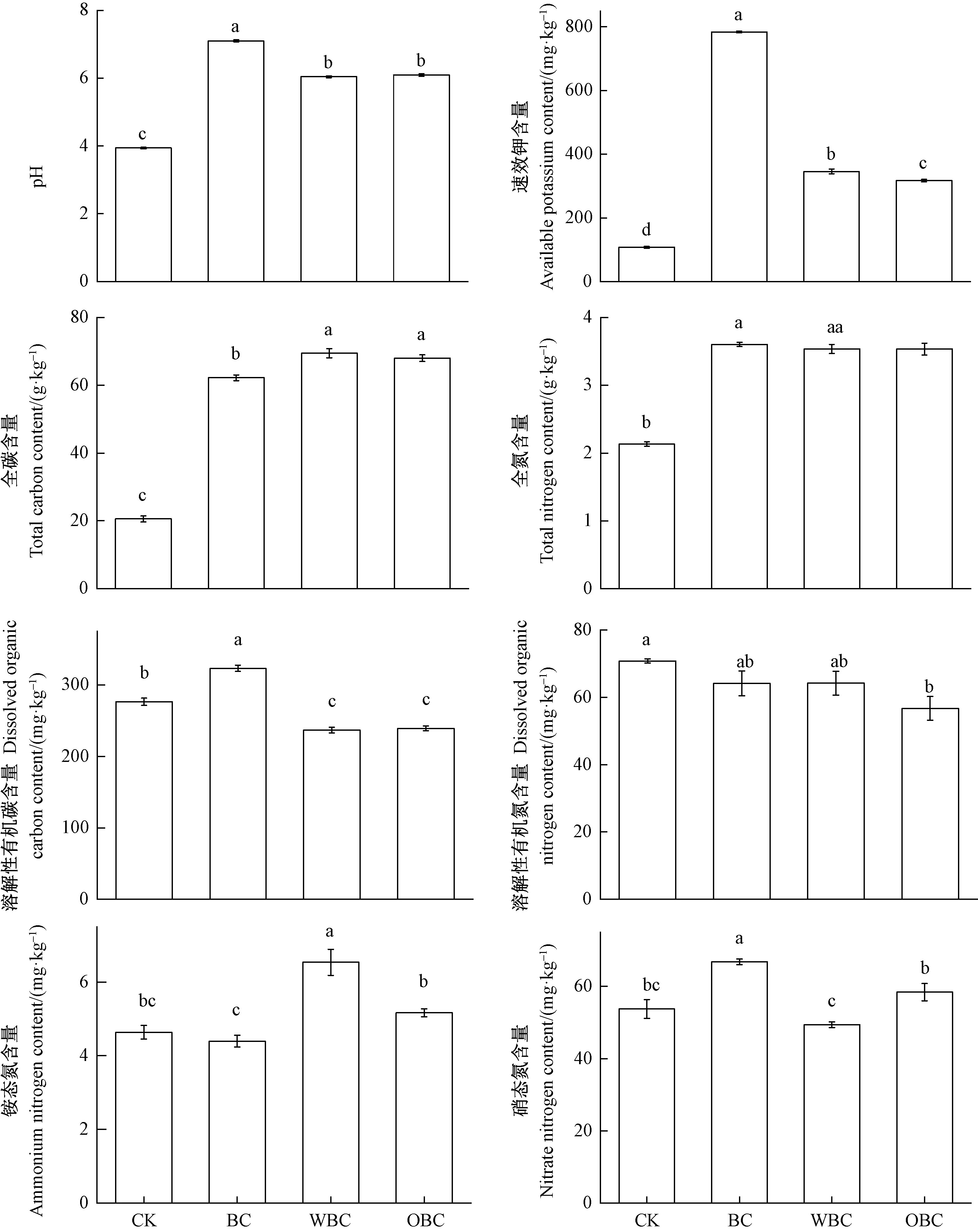
图1 不同处理下的土壤pH值及主要养分含量Fig.1 Soil pH-value and main nutrient content under different treatments图中数据为平均值±标准误差(n=3),同一图中不同小写字母表示呈显著差异性(P<0.05)。The data in the figure was mean ± standard error (n=3),bars with different letters are significantly different (P<0.05).
2.2 生物炭处理对土壤微生物群落组成的影响 将测序所得的有效序列按97%的相似度进行OTU的划分后整理绘制的韦恩图(图2)。由图2A可知,在4组处理中检测到的土壤细菌总OTU数为2 773,其中CK有1 647个、BC处理有1 713个、WBC处理有2 050个、OBC处理有2 133个,CK、BC、WBC和OBC处理的土壤中特有的OTU数分别为157、123、104和202个,表明生物炭老化前后均能增加土壤细菌物种数。从图2B可知,检测到的土壤真菌OTU数共有1 893个,其中CK有936个、BC处理有930个、WBC处理有949个、OBC处理有1 299个。CK、BC、WBC和OBC处理土壤中共有的OTU数为479个,特有的OTU数分别为114、111、106和533个。以上结果表明酸化老化生物炭对土壤真菌物种数的促进作用更显著。

图2 不同处理下土壤细菌(A)和真菌(B)OTU韦恩图Fig.2 OTU Venn diagrams of the bacteria (A)and fungi (B)in soil under different treatments
为验证土壤样本测序数据量的合理性,以随机抽样形式对序列进行抽取,对抽取到的序列数与其所能代表的OTU数建立稀释性曲线(图3)。当细菌和真菌的测序数分别位于20 000~35 000和15 000~35 000之间时曲线趋于平缓,表明在对应区间内,细菌和真菌随着测定序列数增加,其所能代表的OTU数增加较少。因此,此次测序的数据量合理,均能正常反映土壤中微生物的丰度。

图3 不同处理下土壤细菌(A)和真菌(B)稀释曲线Fig.3 Rarefaction curves of soil bacteria (A)and fungi (B)under different treatments
同时,为了解不同处理土壤微生物群落组成的差异,分别对细菌和真菌的群落组成进行了非度量多维尺度(NMDS)分析(图4)。不同处理组间微生物群落组成的差异以组间距离的远近来呈现,其中,距离越远表明微生物群落组成差异越大,反之越小。生物炭不同处理下土壤的细菌群落组成与CK的差异均较大,WBC和OBC处理下土壤的细菌群落组成差异较小(图4A);不同处理组间的土壤真菌群落组成也均存在差异(图4B)。其中,OBC处理土壤的真菌群落组成与CK相比具有较大差异,而BC和WBC处理的土壤真菌群落组成与CK差异较小。
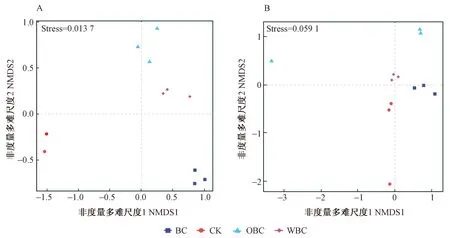
图4 不同处理土壤的细菌(A)、真菌(B)群落组成的非度量多维尺度分析Fig.4 Nonmetric multidimensional scaling (NMDS)of soil bacteria (A)and fungal (B)community composition under different treatments
2.3 生物炭处理对土壤微生物相对丰度的影响 共检测到30个门分类水平和206个科分类水平下的细菌类群,而真菌门和科分类水平下的类群共检测到18和249个。选取门和科分类水平下相对丰度位于前十的微生物类群分析不同生物炭处理对它们相对丰度的影响(图5、6)。从图5A、B中可看出,变形菌门(Proteobacteria)(30.78%~45.35%)、酸杆菌门(Acidobacteria)(13.82%~20.18%)、绿弯菌门(Chloroflexi)(8.54%~19.28%)、放线菌门(Actinobacteria)(5.83%~12.31%)及厚壁菌门(Firmicutes)(3.00%~10.75%)占优势地位,与CK相比,不同生物炭处理均能显著提高土壤变形菌门、芽单胞菌门(Gemmatimonadetes)和拟杆菌门(Bacteroidetes)的相对丰度,而使绿弯菌门、放线菌门以及厚壁菌门的相对丰度显著降低。OBC处理土壤的疣微菌门(Verrucomicrobia)(3.86%)和浮霉菌门(Planctomycetes)(3.41%)的相对丰度显著增加,而螺旋体菌门(Saccharibacteria)(1.95%)的相对丰度显著下降。从图5C、D可看出,子囊菌门(Ascomycota)(53.83%~57.25%)、担子菌门(Basidiomycota)(20.96%~26.99%)和被孢霉门(Mortierellomycota)(11.98%~19.90%)占优势地位。与CK相比,不同生物炭处理显著增加了土壤类原生动物门(Rozellomycota)和丝足虫门(Cercozoa)的相对丰度,且不同处理间无显著差异。WBC的添加显著提高了土壤担子菌门和毛霉亚门(Mucoromycota)的相对丰度,分别为26.99%和1.38%;而OBC的添加显著降低了土壤壶菌门(Chytridiomycota)的相对丰度,为0.38%。

图5 不同处理土壤的细菌(A、B)和真菌(C、D)在门水平的相对丰度Fig.5 Relative abundances of soil bacteria (A,B)and fungi (C,D)at the phylum under different treatments图中数据为平均值±标准误差(n=3),同一图中不同小写字母表示呈显著差异性(P<0.05)The data in the figure is the mean ± standard error (n=3),bars with different letters are significantly different (P <0.05).Pro:变形菌门 Proteobacteria;Aci:酸杆菌门 Acidobacteria;Chl:绿弯菌门 Chloroflexi;Act:放线菌门 Actinobacteria;Fir:厚壁菌门 Firmicutes;Ver:疣微菌门Verrucomicrobia;Sac:螺旋体菌门Saccharibacteria;Gem:芽单胞菌门Gemmatimonadetes;Pla:浮霉菌门 Planctomycetes;Bac:拟杆菌门 Bacteroidetes;Asc:子囊菌门 Ascomycota;Bas:担子菌门 Basidiomycota;Mor:被孢霉菌门 Mortierellomycota;Muc:毛霉亚门 Mucoromycota;Roz:类原生动物门 Rozellomycota;Chy:壶菌门 Chytridiomycota;Cer:丝足虫门 Cercozoa;GS1:GS19;Glo:球囊菌门 Glomeromycota;Ent:虫霉亚门 Entomophthoromycota.下同。The same below.
从图6A、B可以看出,主要的优势细菌科有DA111(6.08%~11.52%)、黄色杆菌科(Xanthobacteraceae)(6.81%~7.60%)、酸热菌科亚群1(Acidobacteriaceae_Subgroup_1)(4.32%~10.16%)和梭菌科亚群3(Solibacteraceae_Subgroup_3)(2.29%~4.17%)。不同生物炭处理均显著提高了土壤芽单胞菌科(Gemmatimonadaceae)、鞘脂单胞菌科(Sphingomonadaceae)和红螺菌科(Rhodospirillaceae)的相对丰度,同时显著降低了DA111和酸杆菌科(Acidothermaceae)的相对丰度。BC和WBC处理土壤的酸热菌科亚群1的相对丰度显著下降,而Xanthomonadales-Incertae-Sedis的相对丰度显著增加,同时BC处理还显著降低了土壤浮霉菌科(Planctomycetaceae)的相对丰度,为1.51%。从图6C、D可看出,被孢霉科(Mortierellaceae)(11.97%~19.89%)、Trimorphomycetaceae(13.35%~16.12%)、毛壳科(Chaetomiaceae)(6.84%~11.98%)和丛赤壳科(Nectriaceae)(6.74%~10.66%)和为主要优势真菌科。BC添加显著降低了土壤毛壳科和曲霉科(Aspergillaceae)的相对丰度,分别为6.84%和1.31%,同时显著促进了肉座菌科相对丰度(5.29%)的增加,而WBC添加则显著提高了土壤灵芝科(Ganodermataceae)(2.69%)的相对丰度。
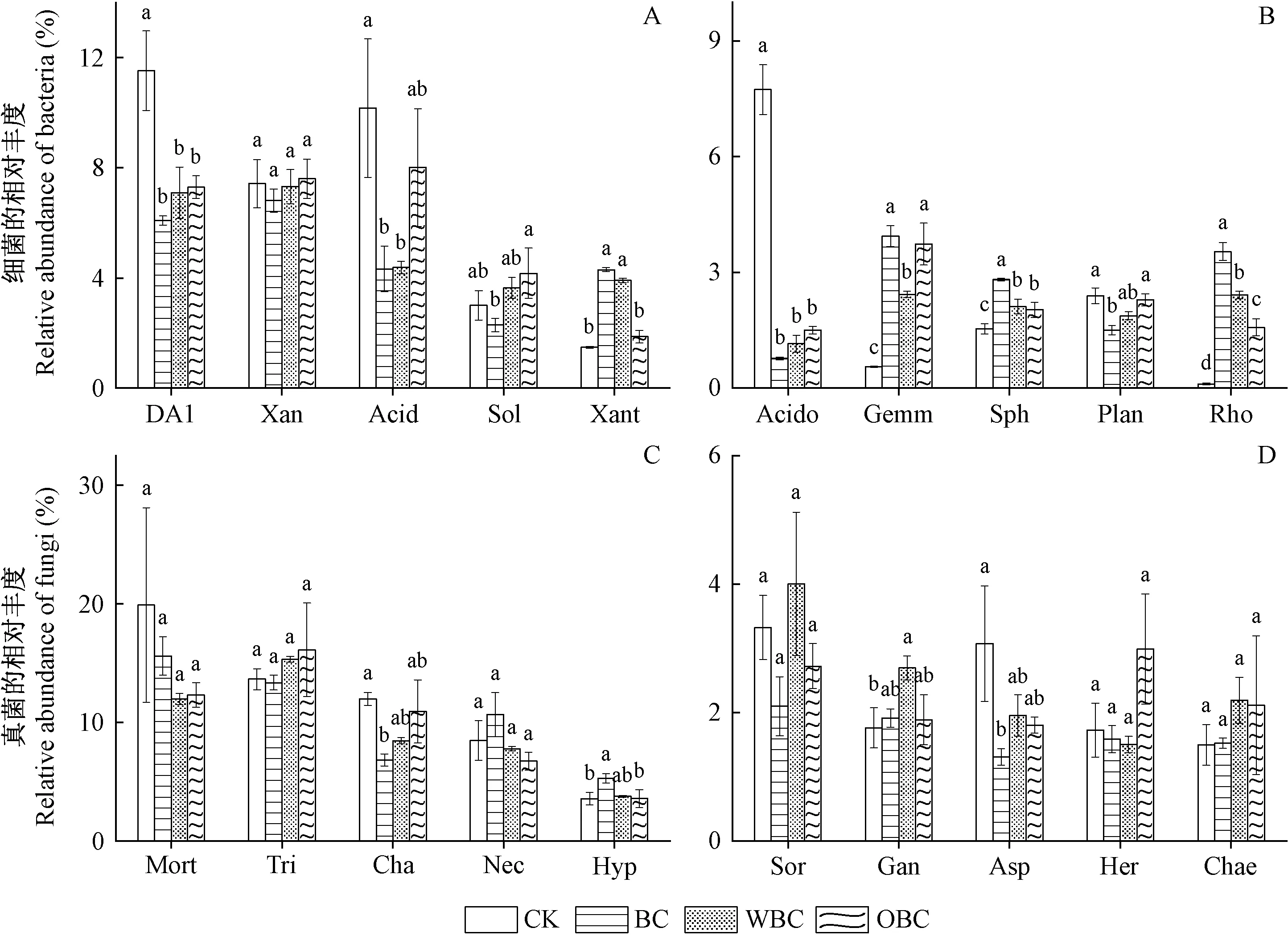
图6 不同处理土壤的细菌(A、B)和真菌(C、D)在科水平的相对丰度Fig.6 Relative abundances of soil bacteria (A,B)and fungi (C,D)at the family under different treatments图中数据为平均值±标准误差(n=3),同一图中不同小写字母表示呈显著差异性(P<0.05)。The data in the figure is the mean ± standard error (n=3),bars with different letters are significantly different (P <0.05).DA1:DA111;Xan:黄色杆菌科 Xanthobacteraceae;Acid:酸热菌科亚群1 Acidobacteriaceae_Subgroup_1;Sol:梭菌科亚群3 Solibacteraceae_Subgroup_3;Xant:Xanthomonadales_Incertae_Sedis;Acido:酸杆菌科Acidothermaceae;Gemm:芽单胞菌科Gemmatimonadaceae;Sph:鞘脂单胞菌科 Sphingomonadaceae;Plan:浮霉菌科 Planctomycetaceae;Rho:红螺菌科 Rhodospirillaceae;Mort:被孢霉科Mortierellaceae;Tri:Trimorphomycetaceae;Cha:毛壳科Chaetomiaceae;Nec:丛赤壳科 Nectriaceae;Hyp:肉座菌科Hypocreaceae;Sor:粪壳菌科Sordariaceae;Gan:灵芝科Ganodermataceae;Asp:曲霉科Aspergillaceae;Her:小疱毛壳科 Herpotrichiellaceae;Chae:Chaetosphaeriaceae.
2.4 土壤养分含量与微生物相对丰度的冗余分析 对土壤主要养分含量与优势细菌、真菌(门水平)的相对丰度进行冗余分析,其中土壤养分与微生物类群的夹角越接近于0°,表明两者呈现的正相关性越显著;夹角越接近于180°,表明两者呈现的负相关性越显著。由此可见,酸杆菌门和浮霉菌门与NH4+-N呈显著正相关性而与DOC和DON呈负相关,螺旋体菌门与此相反。绿弯菌门、放线菌门和厚壁菌门的相对丰度与DON呈正相关性,而与TN、TC呈显著负相关。变形菌门、拟杆菌门与pH值、AK、NO3--N呈显著正相关,芽单胞菌门和疣微菌门与TC、TN也呈显著正相关,同时疣微菌门还与DON呈现极显著负相关(图7A)。
子囊菌门、虫霉亚门与AK、NO3--N、DOC呈现正相关,类原生动物门、丝足虫门、GS19与TN、TC、pH值也呈正相关。担子菌门、球囊菌门与NH4+-N呈现出显著正相关而与DOC、NO3--N呈负相关;DON与壶菌门、被孢霉门呈显著正相关(图7B)。

图7 土壤养分含量与门水平下的细菌(A)、真菌(B)的冗余分析Fig.7 Redundancy analysis (RDA)of soil nutrients with bacteria (A)and fungi (B)at the phylum
3 讨论
3.1 不同生物炭处理对土壤养分含量的影响 由于生物炭富含矿质养分且其表面具有电荷和官能团,因此生物炭添加能有效提高土壤养分含量(Ahmedetal.,2016)。本研究发现,生物炭添加能够显著提高土壤全碳(TC)、全氮(TN)、溶解性有机碳(DOC)、速效钾(AK)和NO3--N的含量,这与先前研究结果一致。如Syuhada等(2016)认为生物炭添加能有效减少土壤中钾的淋溶,从而促进土壤AK含量增加。Gao等(2017)也发现,土壤的pH值、TC、TN等含量因生物炭添加而显著提升。然而,本研究还发现,生物炭经老化引起的自身理化性质改变也会对土壤养分含量产生不同影响。其中,由于生物炭能有效抑制土壤有机碳矿化,并且生物炭经老化后被其表面吸附的有机碳等有机质会因生物炭表面结构被破坏而释放到土壤中,从而导致老化生物炭与生物碳(BC)相比对土壤TC有更显著的促进效果(陈颖等,2018)。然而,与本研究结果不同,Mukherjee等(2013)指出陈化生物炭会降低土壤TC含量,这可能是生物炭裂解温度、陈化方式不同所致。与BC相似,老化生物炭对土壤AK和TN含量也有促进作用,这与生物炭老化前后均有较高含量的AK和TN有关(胡华英等,2019a)。然而,由于生物炭老化后降低了自身的AK含量,从而使老化生物炭与BC相比对土壤AK的促进作用较弱。同时,由于生物炭经水洗和酸化处理后,去除了自身含有的溶解性有机质,从而造成老化生物炭处理土壤的溶解性有机碳(DOC)和溶解性有机氮(DON)含量下降(陈威等,2015)。
3.2 不同生物炭处理对土壤微生物群落组成的影响 本研究发现,不同处理组中土壤细菌的OTU数均大于真菌,这验证了土壤微生物以细菌为主的说法,与Su等(2017)的研究结果一致。由于真菌适应于酸性环境,而生物炭添加会造成土壤酸碱度朝着适宜细菌的方向发展,从而使真菌相较于细菌更难在生物炭添加培养的土壤中定殖(Amelootetal.,2013)。而老化生物炭由于理化性质和微观结构遭至破坏,减弱了对土壤pH值和养分含量的调节能力,同时增加了生物炭的比表面积(林庆毅等,2017;Dongetal.,2017),使细菌和真菌得以快速发展。Allison等(2008)的研究表明,土壤微生物群落组成对土壤养分的变化极其敏感,本研究发现不同生物炭处理对土壤养分含量具有不同的影响,因此可认为老化前后生物炭处理的土壤微生物群落组成差异主要是由生物炭对土壤养分含量的影响所引起的。
对不同分类水平下的微生物类群而言,老化前后生物炭的添加不会改变土壤主要微生物类群的优势度。本研究中,土壤主要的优势细菌门为变形菌门、酸杆菌门、绿弯菌门、放线菌门以及厚壁菌门,这与李金融等(2018)对土壤细菌多样性研究结果一致,由于它们对环境有较强适应性,因此在酸性土壤及老化前后生物炭培养的土壤中与其他细菌群落相比具有较高的活性。老化前后生物炭对土壤芽单胞菌科均有促进作用,而对黄单胞菌科没有显著影响,而王晶等(2020)的研究指出秸秆炭化对土壤芽单胞菌科和黄单胞菌科均有促进作用,这可能是生物炭制备原料、施用量、土壤性质不同造成的。对真菌的研究发现,子囊菌门和担子菌门是主要优势真菌门,与Paungfoo-Lonhienne等(2015)的研究结果一致,并且子囊菌门的相对丰度要优于担子菌门。本研究还发现,水洗老化生物炭对土壤灵芝科有明显促进作用,而生物炭降低了土壤中隶属于子囊菌门的毛壳菌科的相对丰度,这与黄修梅等(2019)研究指出的生物炭添加利于毛壳菌科丰度增加的结果不同。
3.3 土壤养分含量与微生物相对丰度的相关性 由于土壤基本养分含量与门水平下主要微生物类群具有密切相关性,因此可认为老化前后生物炭的添加对微生物群落的影响主要是通过土壤特性改变间接引起的(Luchetaetal.,2016)。Dickie等(2010)的研究也表明,土壤中C、N、P等元素含量对微生物活性有明显制约作用。通过对土壤养分与门水平下细菌相对丰度的冗余分析发现,酸杆菌门与TC有正相关性,主要是因酸杆菌门对土壤碳循环有重要作用,并且能定殖于含碳量丰富的土壤中(Lehmannetal.,2011)。然而,生物炭老化前后对酸杆菌门的相对丰度均无显著影响,这可能是由于添加的生物炭在增加土壤碳含量的同时也提高了酸杆菌门适宜生存的酸性环境的酸碱度导致的。由于绿弯菌门、放线菌门、厚壁菌门属于贫营养型细菌(李金融等,2018),而拟杆菌门、芽孢杆菌门和变形菌门属于富营养型细菌(Fiereretal.,2007),因此它们与土壤主要养分的相关性呈现出了相反结果。由于老化前后的生物炭均会促进土壤TC、TN和AK等的含量增加,由此造成了绿弯菌门、放线菌门、厚壁菌门相对丰度的下降,拟杆菌门、芽孢杆菌门和变形菌门相对丰度的增加。本研究还发现,酸化老化生物炭的添加会增加浮霉菌门的相对丰度、降低螺旋体菌门的相对丰度,主要是因螺旋体菌门适应于DON、DOC含量高的土壤,而浮霉菌门与之相反。
Fontaine等(2011)研究表明,子囊菌的生长与氮的有效性有关,并且子囊菌活性增加也会反过来促进土壤有机质的分解,这与本研究发现的子囊菌门与NH4+-N、DOC呈显著正相关一致。本研究还发现,生物炭添加对担子菌门和子囊菌门的相对丰度均无显著影响,Jin等(2010)研究则表明生物炭处理的土壤会降低担子菌门的丰度。造成这种现象的原因可能是生物炭的制备原料不同,由于本试验的制备原料为杉木叶,由其制成的生物炭相较于其他生物炭含有更丰富的难分解有机质(胡华英等,2019b),且担子菌门被广泛认为是难分解有机质的主要分解者(Renetal.,2016)。同时由于生物炭经水洗老化后其自身纤维素和半纤维素等难分解有机质含量提高(林庆毅等,2017),由此造成了WBC对担子菌门相对丰度的显著促进。Xiong等(2014)研究也表明,难分解有机质的增加有利于担子菌门的发展。被孢霉亚门的相对丰度与DON有显著正相关,而其相对丰度却不受生物炭添加的影响,这与Yao等(2017)的研究结果大体相同。此外,毛霉亚门与TC、TN和NH4+-N含量具有正相关性,而壶菌门与之相反,表明TC、TN和NH4+-N含量提高会促进增加毛霉亚门的相对丰度,同时对壶菌门起抑制作用。由于WBC对TC、TN和NH4+-N含量均有显著促进作用,由此导致了WBC处理中毛霉亚门相对丰度的增加。
由于本研究结论是基于室内模拟试验,在杉木林土壤中的长期使用生物炭效果的认知上仍存在局限性,因此未来应开展长期野外定位研究。
4 结论
在2代杉木人工林土壤中添加生物炭,能有效改善土壤养分状况,而生物炭经历老化后降低了土壤溶解性有机碳和溶解性有机氮的含量,减弱了对土壤养分的改善效果。生物炭老化前后在总体上均能增加土壤微生物的物种数,其中酸化老化生物炭有最为显著的促进效果;门水平下主要微生物类群的相对丰度与土壤主要养分含量呈显著的正或负相关;老化前后的生物炭均能调节土壤主要微生物类群的相对丰度,其中酸化老化生物炭能显著提高土壤细菌中疣微菌门和浮霉菌门的相对丰度,降低细菌中螺旋体菌门及真菌中壶菌门的相对丰度;水洗老化生物炭提高了土壤真菌担子菌门、毛霉亚门和灵芝科的相对丰度。
