红曲菌9901利用柚子囊固态发酵产Monacolin K
2021-08-09刘晓宁钱高飞傅曼琼付杰戴海民张薄博
刘晓宁,钱高飞,傅曼琼,付杰,戴海民,张薄博*
1(江南大学 生物工程学院,江苏 无锡,214000)2(汕头大学 理学院,广东 汕头,515063)3(广东柚通柚美农产品技术研究有限公司,广东 梅州,514000)
红曲菌是一种具有悠久应用历史的药食两用丝状真菌,发酵后能产生天然色素和多种具有生理活性的次生代谢产物,包括Monacolin K、γ-氨基丁酸、多糖等[1]。Monacolin K 对胆固醇合成限速酶3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)具有高效抑制作用,从而具有抑制胆固醇合成,控制高血脂的功效[2-3]。与从其他菌类提取或人工合成的洛伐他汀相比,红曲产品中的Monacolin K结晶少、溶解度高,因而对心血管疾病的疗效更显著,毒副作用更小[4-5]。但是微生物产Monacolin K常用谷物类基质生产成本较高,不适合工业生产。
食品副产物作为发酵基质,用于菌体或微生物次级代谢产物的生产已有多年历史。为了能够降低生产成本,提高食品副产物的利用价值,目前已有以黄精渣[6]、甘蔗渣[7]、沙棘籽粕[8]、米糠[9]、豆粕[10]、麦麸[11]等作为培养基,进行红曲固态发酵生产Monacolin K的研究。吴双双[9]通过采用紫外-化学诱变育种,与添加营养物质相结合的方式来发酵米糠,生产Monacolin K,产量最高达到11.68 g/kg,说明食品副产物发酵生产Monacolin K有较大的发展空间。本课题组在以大米[12]和小米[13]等谷物为原料,进行固态发酵产Monacolin K的研究方面已取得了较好的结果。在此基础上,本研究选取几种具有高值化潜力的食品副产物进行发酵实验,对比了红曲菌固态发酵生产Monacolin K的产量,确定以柚子囊作为固态发酵基质,探究不同发酵条件对红曲菌9901产Monacolin K的影响,并对发酵工艺进行优化。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
红色红曲菌9901,江南大学实验室筛选并保藏。
1.1.2 培养基
菌种保藏培养基(g/L):马铃薯200,葡萄糖20,琼脂20,pH自然,121 ℃灭菌20 min。
种子液培养基(g/L):葡萄糖60,鱼粉蛋白胨25,NaNO32,MgSO4·7H2O 1,K2HPO4·3H2O 1,玉米浆粉6,500 mL锥形瓶装液量100 mL,pH值调至6.0,121 ℃灭菌20 min。
固态发酵培养基:食品副产物类基质干质量为10 g,培养基初始含水量45%,pH自然,121 ℃灭菌30 min。
1.1.3 试剂
洛伐他汀(纯度98%)。甲醇、乙腈(纯度99.9%)。葡萄糖、鱼粉蛋白胨、NaNO3、MgSO4·7H2O、K2HPO4、玉米粉、(NH4)2SO4、甘油、乳糖、琼脂、无水乙醇、酵母膏、蔗糖、麦芽糖,以上为分析纯。柚子囊,由大埔县通美实业有限公司提供,土豆、陈皮、麦糟、麸皮、香菇腿、橘子核均为市售。
1.2 仪器与设备
A11型超高速粉碎仪,广州艾卡仪器设备有限公司;HYG-A型全温摇床柜,太仓市实验设备厂;SW-CJ-IF型超净工作台,苏州净化设备有限公司;FA-1004FA型电子天平,上海舜宇恒平科学仪器有限公司;HH-B11-360型电热恒温培养箱,连云港医疗器械设备厂;LDZX-40B1型高压蒸汽灭菌锅,上海申安医疗器械厂;101-1型电热鼓风干燥箱,上海博讯医疗设备厂;MB 45型水分活度仪,美国奥豪斯公司;SHZ-D型循环水式真空泵,巩义市予华仪器有限公司;KQ-100型超声波清洗仪,昆山市超声仪器有限公司;PB-10型pH仪,季尔国际贸易上海有限公司;1525型高效液相色谱仪,美国Waters公司。
1.3 实验方法
1.3.1 红曲菌9901利用食品副产物固态发酵产Monacolin K的工艺
将在4 ℃冰箱保藏的红曲菌9901,放在28 ℃培养箱活化1 d后,用无菌水将菌种孢子从斜面洗脱下来,制成孢子浓度为1×106个/mL的孢子悬浮液,接种10 mL的孢子悬浮液,于100 mL液态种子培养基中。置于30 ℃恒温恒湿的摇床内,以180 r/min,培养2 d,之后将种子培养液以不同接种量,接种至固态培养基,放置于恒温恒湿培养箱以30 ℃,培养2 d后以25 ℃培养不同时间。发酵完成后烘干,用高效液相色谱法检测Monacolin K的含量。
1.3.2 红曲菌9901利用食品副产物固态发酵产Monacolin K的实验设计
1.3.2.1 不同食品副产物对Monacolin K产量的影响
分别取干重为10 g的柚子囊、陈皮、麦糟、麸皮、香菇腿、橘子核作为食品副产物固态基质,液体种子以10%(mL∶g)的接种量,接入装有上述基质的100 mL发酵瓶中,初始含水量为45%;30 ℃发酵培养2 d;然后25 ℃发酵培养至18 d。发酵完成后检测Monacolin K的含量。
1.3.2.2 初始含水量对Monacolin K产量的影响
将红色红曲菌9901的液态种子,以10%(mL∶g)的接种量,接入装有干重为10 g柚子囊的100 mL发酵瓶中,调节初始含水量分别为40%、45%、50%、55%、60%、65%,30 ℃发酵培养2 d;然后25 ℃条发酵培养至18 d。发酵完成后检测Monacolin K的含量。
1.3.2.3 接种量对Monacolin K产量的影响
将红色红曲菌9901的液态种子,分别以5%、10%、15%、20%、25%、30%(mL∶g)的接种量,接入装有干重为10 g柚子囊的100 mL发酵瓶中,调节初始含水量为45%。30 ℃发酵培养2 d;然后25 ℃发酵培养至18 d。发酵完成后检测Monacolin K的含量。
1.3.2.4 外加碳源类型对Monacolin K产量的影响
将红色红曲菌9901的液态种子,以10%(mL∶g)的接种量,接入装有干重为10 g柚子囊的100 mL发酵瓶中,调节初始含水量为45%。额外添加碳源,种类分别为甘油、葡萄糖、蔗糖、乳糖、麦芽糖,添加量为总质量的5%(质量分数)。30 ℃发酵培养2 d;然后25 ℃发酵培养至18 d。发酵完成后检测Monacolin K的含量。
1.3.2.5 乳糖添加量对Monacolin K产量的影响
将红色红曲菌9901的液态种子,以10%(mL∶g)的接种量,接入装有干重为10 g柚子囊的100 mL发酵瓶中,调节初始含水量为45%。额外添加乳糖,添加量分别为总质量的1%、3%、5%、7%、9%(质量分数)。30 ℃发酵培养2 d;然后25 ℃发酵培养至18 d。发酵完成后检测Monacolin K的含量。
1.3.2.6 外加氮源类型对Monacolin K产量的影响
将红色红曲菌9901的液态种子,以10%(mL∶g)的接种量,接入装有干重为10 g柚子囊的100 mL发酵瓶中,调节初始含水量为45%。添加的氮源分别为硫酸铵、硝酸钠、玉米粉、酵母膏、蛋白胨,添加量为总质量的2%(质量分数)。30 ℃发酵培养2 d;然后25 ℃发酵培养至18 d。发酵完成后检测Monacolin K的含量。
1.3.2.7 发酵时间对Monacolin K产量的影响
将红色红曲菌9901的液体种子,分别以10%(mL∶g)的接种量,接入装有干重为10 g柚子囊的100 mL发酵瓶中,初始含水量为45%,30 ℃发酵培养2 d;25 ℃条件下,分别检测发酵12、14、16、18、20、22、24 d时Monacolin K的含量。
1.3.2.8 响应面试验优化
为进一步研究变量之间交互作用的影响关系,使用响应面分析法筛选最佳发酵条件。每个单因素的初步研究是响应面优化的指导范围,基于Box-Behnken采样原理,选择对Monacolin K含量有影响的3个因素:初始含水量A、乳糖添加量B、接种量C进行3因素3水平的响应面分析试验。响应面试验因素水平见表1。

表1 响应面试验因素水平设计
1.3.3 Monacolin K含量检测方法
1.3.3.1 液相色谱检测条件
仪器:Waters 2487;色谱柱型号,20 RBA×SB-C18;流动相V(乙腈)∶V(水)=55∶45,磷酸调pH值至2.5;流速1.5 mL/min,柱温30 ℃;检测器,紫外检测器;检测波长238 nm;进样量20 μL。
1.3.3.2 内酯型Monacolin K标准曲线绘制
取Monacolin K标准品4.0 mg,置于10 mL容量瓶中,用甲醇定容至10 mL,超声,使溶液完全溶解,得到400 μg/mL的标准母液,分别配制质量浓度为10、25、50、80、100、150、200 μg/mL的标准溶液,经0.22 μm的有机滤膜过滤后,通过高效液相色谱进行测定,根据峰面积与Monacolin K浓度的对应关系,以浓度为横坐标,峰面积为纵坐标,绘制出内酯型Monacolin K的标准曲线,得到回归方程及相关系数。
1.3.3.3 酸型Monacolin K标准曲线绘制
取内酯型Monacolin K标准品2.0 mg,置于10 mL容量瓶中,用0.1 mol/L的NaOH(用50%的乙腈配制)溶液定容至10 mL,得到200 μg/mL的标准母液,于50 ℃水浴1 h,超声1 h,用1 mol/L的HCl调pH至中性。
将标准母液逐级稀释后得到质量浓度为10、25、50、80、100、150、200 μg/mL的标准溶液,经0.22 μm的有机滤膜过滤后,通过高效液相色谱进行测定,根据峰面积与Monacolin K浓度的对应关系,以浓度为横坐标,峰面积为纵坐标,绘制出酸型Monacolin K的标准曲线,得到回归方程及相关系数。
1.3.3.4 样品的测定
将红曲菌利用固态食品副产物发酵结束的产品,放于45 ℃电热鼓风干燥箱中烘干,之后用研磨机打碎至粉末状,将每份样品的粉末混匀,并过100目筛子,取0.5 g样品于50 mL比色管中,用70%(体积分数)乙醇定容至50 mL,55 ℃水浴1 h,每20 min振荡1次,水浴结束后冷却至室温,静置后过0.22 μm有机滤膜,通过高效液相色谱测定。根据内酯型Monacolin K和酸型Monacolin K标准曲线计算Monacolin K总含量。
2 结果与讨论
2.1 Monacolin K标准曲线的绘制
以HPLC测得的内酯式Monacolin K峰面积为纵坐标,以内酯式Monacolin K标准液浓度为横坐标,用Origin拟合,经计算得到内酯式Monacolin K标准曲线回归方程为:y=0.723 2x+0.578 9。试验表明内酯式Monacolin K质量浓度在0~200 mg/L,具有良好的线性关系。
以HPLC测得的酸式Monacolin K峰面积为纵坐标,以酸式Monacolin K标准液浓度为横坐标,用Origin拟合,经计算得到酸式Monacolin K标准曲线回归方程为:y=0.753 97x+0.178 67。试验表明酸式Monacolin K质量浓度在0~200 mg/L,具有良好的线性关系。
2.2 食品副产物固态基质的确定
不同的固态发酵基质的组织结构、密度、通气性能以及比表面积,对微生物的生长环境及传质、传热造成很大影响[14-15]。故选取有发酵潜力的食品副产物作为基质进行固态发酵,对红色红曲菌9901发酵产Monaconlin K的能力进行检测,考察不同食品副产物固态基质对Monaconlin K产量的影响,如图1所示。

图1 食品副产物种类对红色红曲菌9901产Monacolin K的影响
在所选的食品副产物固态发酵基质中,Monacolin K的产量,由高到低的排列顺序为:柚子囊>麸皮>麦糟>橘子核>香菇腿>陈皮。Monacolin K产量最高的为柚子囊,产量平均可达6 187.9 mg/kg。Monacolin K产量最低的为陈皮,产量仅有1 763.6 mg/kg。用柚子囊作为固态发酵基质Monacolin K产量,是以陈皮作为固态发酵基质时Monacolin K产量的3.5倍。柚子囊是一种多孔的介质,同时其本身具有一定营养成分(总糖含量9.3%,蛋白质含量1.7%),因此可以提供适宜红曲菌生长的条件,用于红曲菌9901固态发酵产Monacolin K。
2.3 基质初始含水量的确定
固态发酵基质的水分含量一般在40%~60%[16],过高或者过低均不利于菌丝生长以及次级代谢的正常进行[17-18]。因此调节不同的初始含水量,来研究初始含水量对红色红曲菌9901固态发酵产Monacolin K的影响。由表2可知,随着初始含水量的增加,红色红曲菌9901固态发酵产Monacolin K的产量先增加后减少。初始含水量过多过少时均不利于Monacolin K的生产,可能是由于当含水量过高时,基质间的氧传递不足,且易出现结团现象,菌丝无法深入基质内部生长,因此营养利用不充分。而当含水量过低时,虽基质松散,但基质内部未被水渗透,从而菌体不易生长到柚子囊内部。初始含水量为45%时,发酵产物中Monacolin K含量最高达到最高。因此,采用初始含水量为45%的条件进行后续实验。

表2 初始含水量对红色红曲菌9901固态发酵产Monacolin K的影响
2.4 接种量的确定
接种量会直接影响菌体生长进而影响次级代谢产物的合成,因此研究了接种量对红色红曲菌9901固态发酵产Monacolin K的影响。由图2可知,随着接种量的增加,发酵产物中Monacolin K含量先升高后降低,当接种量为10%时发酵产物中Monacolin K含量最高。这是因为接种量太少菌体生长较慢,但过大的接种量会使菌体生长过快,营养物质迅速消耗,同样不利于Monacolin K的合成。因此选取10%(mL∶g)的接种量,作为红色红曲菌9901固态发酵产Monacolin K的最适接种量。
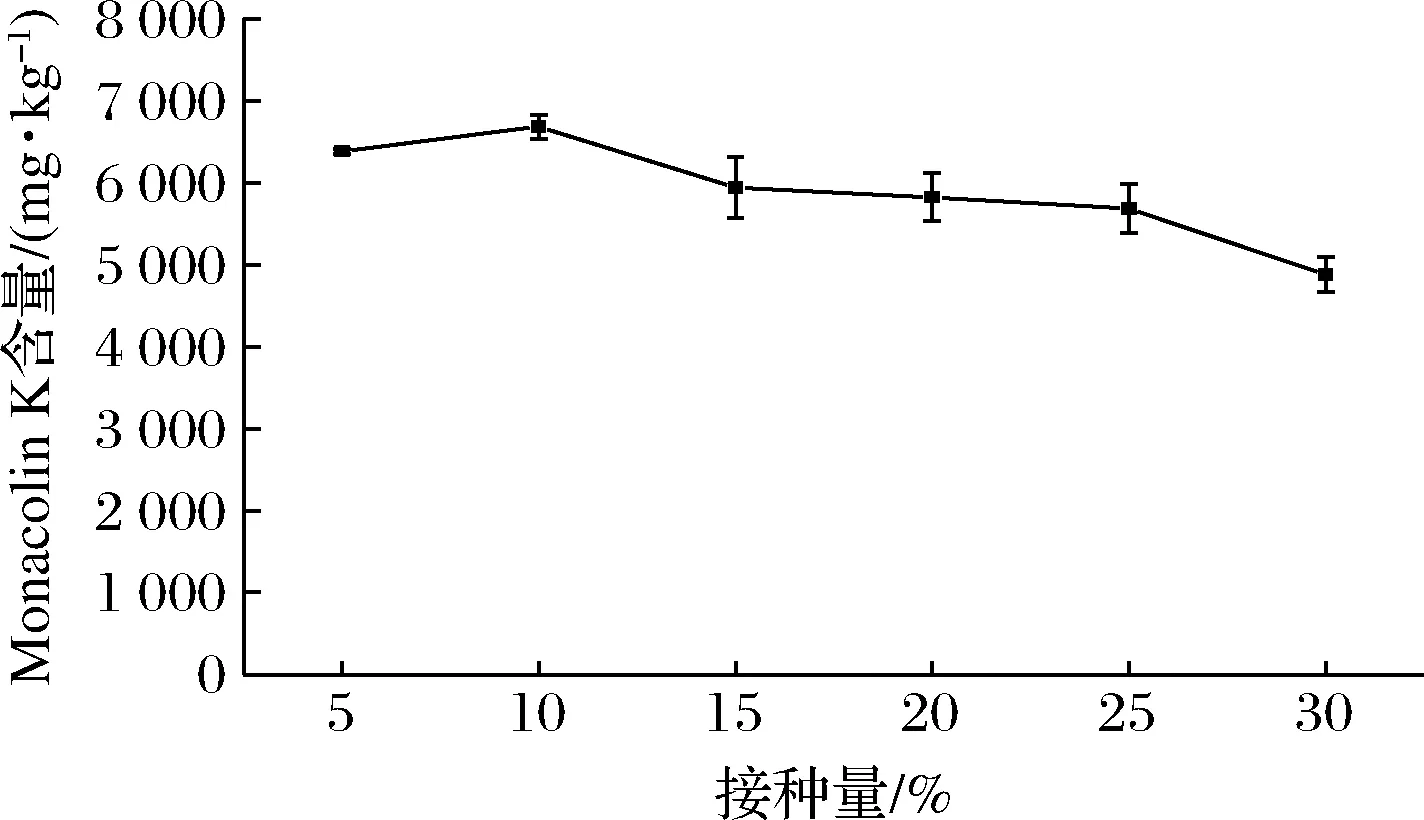
图2 接种量对红色红曲菌9901固态发酵产Monacolin K的影响
2.5 外加碳源类型的确定
碳源是构成菌体和产物的碳架及其能量来源,不同的碳源种类会影响Monacolin K的产量,参考相关文献报道[19-23],本试验选用以下5种碳源进行比较:乳糖、甘油、葡萄糖、蔗糖、麦芽糖。由图3可知,添加不同的碳源种类对红色红曲菌9901固态发酵产Monacolin K有较大差异。通过实验现象观察,额外添加葡萄糖的实验组中,菌丝体的生长较其他实验组更快更多。葡萄糖是最易利用的碳源,从而使得更多的营养物质用于菌体生长,反而不利于后期Monacolin K的积累。添加乳糖、甘油、蔗糖、麦芽糖的实验组,菌丝体适度生长,发酵后期能正常积累Monacolin K。添加乳糖后,红曲菌9901生产Monacolin K的含量最高,因此乳糖为红色红曲菌9901固态发酵产Monacolin K的最适外加碳源。

图3 碳源类型对红色红曲菌9901固态发酵产Monacolin K的影响
2.6 乳糖添加量的确定
由于碳源是红曲菌发酵产生Monacolin K的限制性底物,碳源含量是决定细胞生长和产物积累量的主要因素之一。由图4可知,随着乳糖质量浓度的逐渐增加,Monacolin K的产量不断增加。乳糖在添加量为占总质量的3%时,红曲菌9901生产Monacolin K的含量最高。当乳糖添加量继续增加时,菌体细胞渗透压不断增大,会对菌丝体代谢产物的合成及氧的传递过程造成较大影响[24],Monacolin K的产量不断降低。从Monacolin K的产量和原料利用率等因素综合考虑,选择占总质量的3%的乳糖,作为红色红曲菌9901固态发酵产Monacolin K的最适碳源添加量。
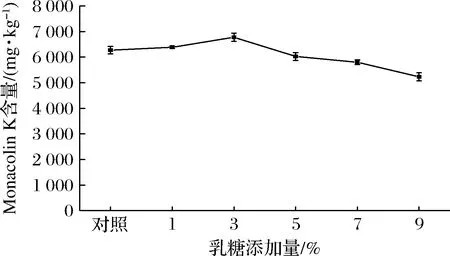
图4 乳糖添加量对红色红曲菌9901固态发酵产Monacolin K的影响
2.7 外加氮源类型的确定
氮源不足会导致菌体生长缓慢,氮源过多,则微生物生长过于旺盛,不利于代谢产物的积累。本试验选取了5种常见的碳源:NaNO3、蛋白胨、酵母膏、(NH4)2SO4、玉米粉进行发酵实验。由图5可知,对照组的含量最高,不需要添加氮源,即可生产出较多的Monacolin K,从优化发酵工艺、降低成本等方面来考虑,选择不额外添加碳源,进行红色红曲菌9901固态发酵产Monacolin K的后续实验。
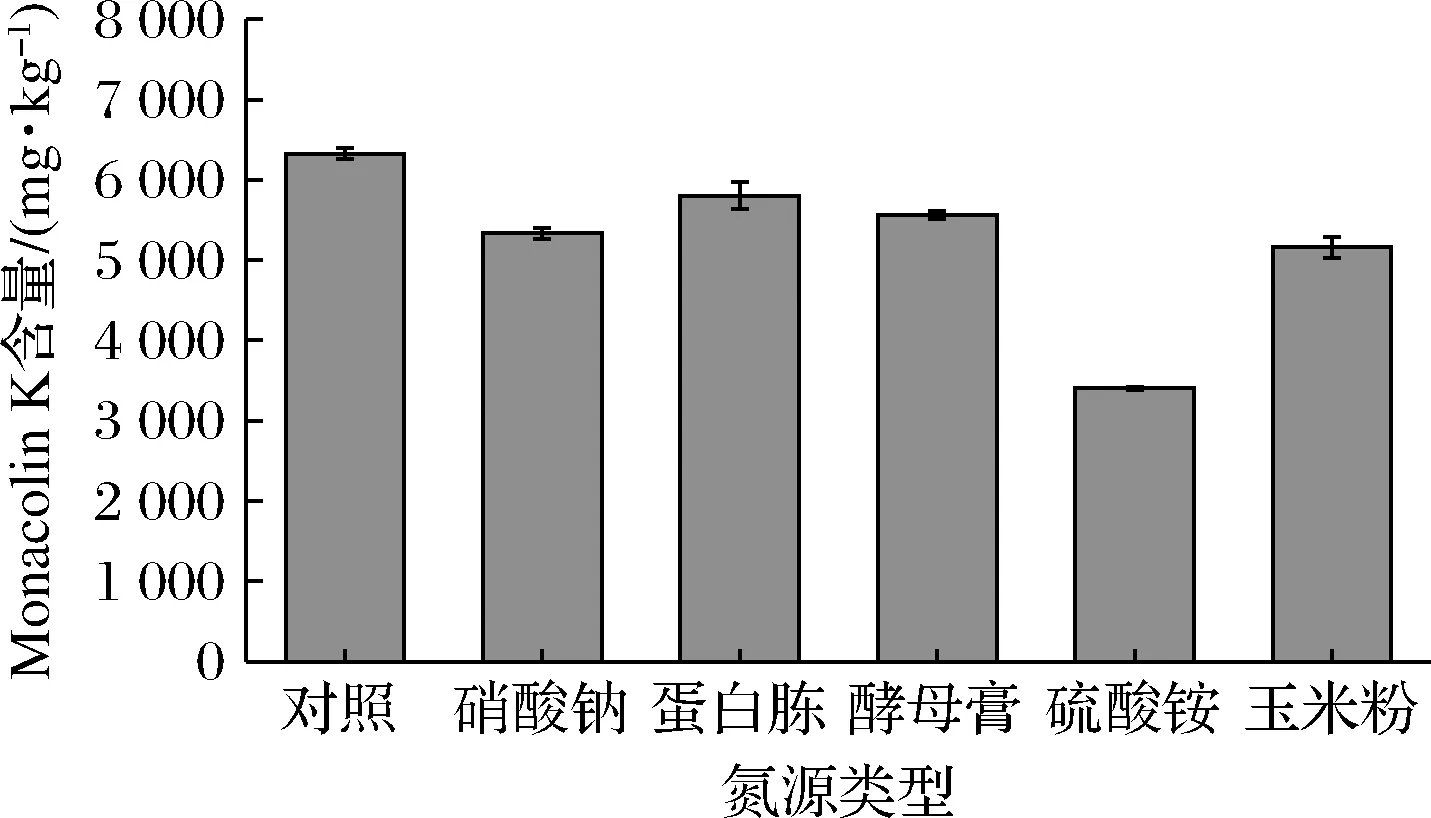
图5 氮源类型对红色红曲菌9901固态发酵产Monacolin K的影响
2.8 发酵时间的确定
红曲菌固态发酵使用不同的菌株,不同的培养方式,产Monacolin K的周期不同[23,25],且固态发酵周期较长。为确定红色红曲菌9901利用柚子囊发酵产Monacolin K的最佳时间,进行了发酵时间的确定实验。由图6可知,从第12~18天,随着发酵时间的增加,Monacolin K的含量迅速增加,Monacolin K开始大量积累。发酵20 d时,Monacolin K积累速度减缓,产量达到最大。随着发酵时间的增加,而22 d时,Monacolin K的含量开始有所下降,可能是固态发酵后期,培养基基质营养物质的消耗完毕,菌体已经不能合成Monacolin K,而且Monacolin K开始分解造成的。因此,红色红曲菌9901固态发酵柚子囊的发酵周期选为20 d。

图6 发酵时间对红色红曲菌9901固态发酵产Monacolin K 的影响
2.9 响应面试验优化结果及分析
根据Box-Behnken中心组合实验设计原理和单因素试验的结果,选取初始含水量、乳糖添加量及接种量作为自变量,设计了3因素3水平的响应面分析实验。以Monacolin K产量作为考核指标进行实验,相关的设计与结果如表3所示。

表3 响应面试验设计与结果
利用Design-Expert 10.0.1软件对实验数据进行分析,得到红色红曲菌9901固态发酵产Monacolin K的二次多项回归方程:
Y=6 804.58+691.26A-81.605B-511.123C+1 093.58AB+246.885AC-453.99BC-1 547.22A2-873.719B2-837.394C2


表4 响应面拟合回归方程的方差分析结果
各因素之间的交互作用,对红曲菌9901利用柚子囊发酵生产Monacolin K的影响,可以通过多元回归方程所作的三维空间的曲面图及等高线图直观的反映出来[26]。从图7中3个响应面图,可以看出曲面最高点均在响应面上,故各因素的最优水平在所选范围之内。各因素对Monacolin K产量影响越大,其响应面图越为陡峭,从以上结果可以看出,A(初始含水量)、B(接种量)对红色红曲菌9901固态发酵柚子囊生产的Monacolin K积累量影响更大。结合表3、表4可以看出,实验所选的3种因素均具有很好的交互作用,且交互作用的强弱分别为:AB>AC>BC。为进一步准确确定全局最优解,以最大化Monacolin K含量为优化目标,根据Design-Expert 10.0.1 软件运行结果,Monacolin K含量在初始含水量A、乳糖添加量B、接种量C的共同影响下的最优工艺为:初始含水量A为46.4%、乳糖添加量B为3.4%、接种量C为8.5%,在此条件下模型预测的最大Monacolin K含量为6 970.8 mg/kg。按照此条件进行验证,Monacolin K 产量达到6 984.9 mg/kg。与模型预测结果基本吻合,说明该模型预测值与实验值具有良好的拟合性。

a-乳糖添加量和初始含水量的3D图;b-接种量和初始含水量的3D图;c-接种量和乳糖添加量的3D图;d-乳糖添加量和初始含水量的等高线图;e-接种量和初始含水量的等高线图;f-接种量和乳糖添加量的等高线图
3 结论
本实验以具有降脂功效的Monacolin K为目标产物,通过对不同的食品副产物固态发酵基质进行筛选,最终选择了柚子囊作为固态发酵基质。并确定红曲菌9901利用柚子囊固态发酵产Monacolin K的最佳发酵条件为:初始含水量A为46.4%、乳糖添加量B为3.4%、接种量C为8.5%,在30 ℃培养2 d后,变温到25 ℃培养至22 d,Monacolin K的产量可达6 984.9 mg/kg。
本实验使用常见的食品副产物,原料易得且价格低;固态发酵对设备要求低、能耗低、水消耗量少、无污染、无废料产生;发酵产物无需复杂的提取分离过程,可全部利用,进一步降低生产成本,对柚子产业深加工和开发下游的柚子系列产品都具有重要的指导意义。
