虎杖苷通过调控HMGB1/TLR4/NF-κB信号通路对脓毒症急性肺损伤的保护作用
2021-08-09孙鹏陈敏张细六许爱军
孙鹏 陈敏 张细六 许爱军
1.湖北工业大学医院 武汉 430068 2.武汉市第九医院 3.武汉市第五医院 4.武汉同济医院
脓毒症是一种因感染反应失调导致的、危及生命的器官功能障碍综合征,是重症加强护理病房(intensive care unit,ICU)住院患者最常见的死亡原因之一[1]。在脓毒症患者中,约30%可发展为多器官功能障碍综合征,其中肺部是最易受感染的器官之一,约40%的脓毒症患者出现急性肺损伤(acute lung injury,ALI),并可进一步发展为急性呼吸窘迫综合征(acute respiratory distress syndrme,ARDS)[2]。 目前治疗ALI的药物和方法有限,主要包括高流量鼻导管吸氧、无创通气、俯卧位吸氧、体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、抗炎治疗及相应的支持疗法等,降低患者病死率的作用不明显,因此寻找新的治疗药物是临床治疗脓毒症相关ALI亟待解决的关键问题[3]。近年来,中药及其活性成分在治疗脓毒症相关ALI方面表现出明显优势,具有多环节、多靶点整体调节的特点,有较好的应用前景[4]。虎杖苷(polydatin,PD)是中药虎杖的提取物,具有抗炎、抗氧化应激、降血脂、镇咳、抗休克等药理作用[5]。研究表明,PD对多种原因诱导的肺损伤具有保护和治疗作用,但其作用机制尚不清楚[6-7]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)/Toll样 受体4(Toll like receptor 4,TLR4)/核因子-κB(nuclear factor-κB,NF-κB)信号通路是重要的炎症相关信号转导途径,Sun等[8]研究证明,抑制HMGB1、TLR4、NF-κB等基因及其他细胞因子的表达水平可减轻败血症中重要器官的损伤。本研究通过盲肠结扎穿孔术制备大鼠脓毒症ALI模型,以HMGB1/TLR4/NF-κB信号通路为切入点,探究PD对脓毒症ALI的保护作用及其作用机制。
1 材料和方法
1.1 实验动物 无特定病原体(specific pathogen free,SPF)级SD大鼠50只,6~8周龄,雌雄各半,体质量180~220g,购自河南省实验动物中心[实验动物生产许可证号码:SCXK(豫)2017-0001],饲养于河南省实验动物中心实验室独立动物房[实验动物使用许可证号码:SYXK(豫)2016-0002],实验动物及饲养条件符合《实验动物管理条件》要求。饲养条件:室温(22±1)℃,湿度(50±10)%,每天定时换气,12h光暗照明,食水不限。实验严格遵循替代 (replacement)、减少(reduction)、优化(refinement)的3R原则,给予实验动物人道关怀。本研究的主体部分主要在湖北工业大学医院完成,武汉市第九医院、武汉市第五医院、武汉同济医院共同参与完成了实验样本的检测工作。研究方案获湖北工业大学医院伦理委员会批准(伦理委员会审批号码:HBGYDXYY20200225)。
1.2 主要试剂与仪器 PD购于上海麦克林生化科技有限公司(批号:C10020672),使用时以0.5%羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC-Na)溶解,并混合均匀;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒均购于南京建成生物工程研究所有限公司(批号:A001-3-2、A003-1-2); 肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、 白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附检测(enzyme linked immunosorbent assay,ELISA)检测试剂盒均购于武汉伊莱瑞特生物科技有限公司(批号:E-EL-M0049c、E-EL-M0037c、E-EL-M0044c);HMGB1、TLR4、NF-κB p65、 甘 油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔源单克隆抗体和羊抗兔二抗均购于美国CST公司(批号:6893、14358S、8242、5174、7074);RevertAidTMfirst Strand cDNA Synthesis Kit购于美国Thermo Scientific公司(批号:K1622);引物购于日本Takara公司(批号:RR420A)。DYCZ-24KS双板垂直电泳仪购于北京六一仪器厂;7500聚合酶链式反应(polymerase chain reaction,PCR)仪为美国Applied Biosystems公司产品;IX53显微镜购于日本奥林巴斯公司;G:BOX多功能凝胶成像系统为英国Syngene公司产品;Multiskan MK3酶标仪购于美国Thermo Fisher Scientific公司;TGL16MB高速冷冻离心机购于长沙湘智离心机仪器有限公司。
1.3 方法
1.3.1 分组与造模 将50只大鼠随机分为假手术组、模型组和PD高、中、低剂量组,每组10只。模型组和PD高、中、低剂量组大鼠采用盲肠结扎穿孔术制备脓毒症ALI模型,具体操作参考文献[9]的方法。大鼠提前禁食12h,腹腔注射2%的戊巴比妥钠溶液麻醉,仰卧位固定于手术台,腹部备皮、消毒,右下腹部作一2cm的切口,分离盲肠,在盲肠末端距离回盲部5mm处结扎,然后以20号针头穿刺盲肠,每隔4cm穿刺1次,共3次,使盲肠形成创口,轻压盲肠挤出少量肠内容物,最后回纳盲肠,缝合腹腔。假手术组开腹后仅翻动盲肠后关腹,不进行结扎和穿刺。若造模后3~24h内大鼠出现竖毛、少尿、腹泻、直肠温度下降和眼角血性分泌物,则表明造模成功。经观察,各组大鼠均造模成功,未出现死亡大鼠。
1.3.2 给药方法 造模第2天开始给药。PD高、中、低剂量组大鼠分别予以100、50、25mg·kg-1PD灌胃,药物以浓度为0.5%的CMC-Na混合均匀;假手术组和模型组以等体积的CMC-Na灌胃,1次/d,连续7d。
1.3.3 ELISA法检测血清炎症因子TNF-α、IL-1β、IL-6水平 末次给药后2h,大鼠腹主动脉穿刺取血,4℃静置2h,3 000r/min离心10min,离心半径为12.5cm,分离血清,严格按照试剂盒说明书操作步骤检测大鼠血清TNF-α、IL-1β、IL-6水平。
1.3.4 各组大鼠肺组织湿干重比 (wet-to-dry weight ratio,W/D)检测 末次给药后2h,处死大鼠,分离右上肺叶,用于W/D检测,其余肺组织一部分以4%多聚甲醛固定,用于苏木精-伊红(hematoxylin-eosin,HE)染色;另一部分-80℃冻存,用于MDA水平和SOD活力检测、实时定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,Real-time qPCR)及Western blot检测。以吸水纸擦干肺组织表面水分后称重,记为湿重(wet,W),随后将肺组织放入80℃恒温干燥箱烘干,24h后称重,记为干重(dry,D),并计算W/D。
1.3.5 各组大鼠肺组织MDA水平及SOD活力检测取-80℃冻存的大鼠肺组织,加入预冷磷酸盐缓冲溶液(phosphate buffered solution,PBS),冰上研磨匀浆,10 000r/min离心10min,离心半径为12.5cm,取上清液-80℃保存。
1.3.5.1 SOD活力检测 取待测样品20μL,依次加入SOD检测缓冲液、WST-8工作液和反应启动工作液,37℃孵育30min,450nm波长检测吸光度(absorbance,A)值,根据标准曲线计算待测样品的SOD活力。
1.3.5.2 MDA水平检测 取待测样品100μL,加入工作液和蒸馏水,100℃水浴中孵育60min,冰浴冷却,4 000r/min常温离心10min,吸取200μL上清液加入玻璃比色皿中,分别检测各样品在波长450、532和600nm处的A值,ΔA450=A450测定-A450空白,ΔA532=A532测定-A532空白,ΔA600=A600测定-A600空白,MDA含量(nmol·mg-1)=5×[12.9×(ΔA532-ΔA600)-2.58×ΔA450]。
1.3.6 HE染色观察大鼠肺组织病变 肺组织以4%多聚甲醛固定48h后,蒸馏水清洗,脱水、透明后4μm切片,脱蜡、复水后HE染色,400倍光镜下观察大鼠肺组织病理变化。
1.3.7 Real-time qPCR检测肺组织HMGB1、TLR4和NF-κB p65 mRNA表达水平 取-80℃冻存的大鼠肺组织,冰上研磨,加入Trizol裂解液提取组织总RNA,使用RevertAidTMfirst Strand cDNA Synthesis Kit逆转录试剂盒合成cDNA,按照说明书进行PCR扩增。 反应体系:dNTPs 0.5μL+5×Buffer 5μL+Taq 酶0.3μL+MgCl21.5μL+cDNA模板2μL+上下游引物各1μL,加去离子水至总体积25μL。反应条件:95℃5min,95℃ 30s、62℃ 30s、72℃ 30s,40个循 环 ,72℃延伸10min,4℃ 5min终止反应。实验重复3次。采用2-△△CT的方法计算目的基因mRNA相对表达水平的变化。引物序列见表1。
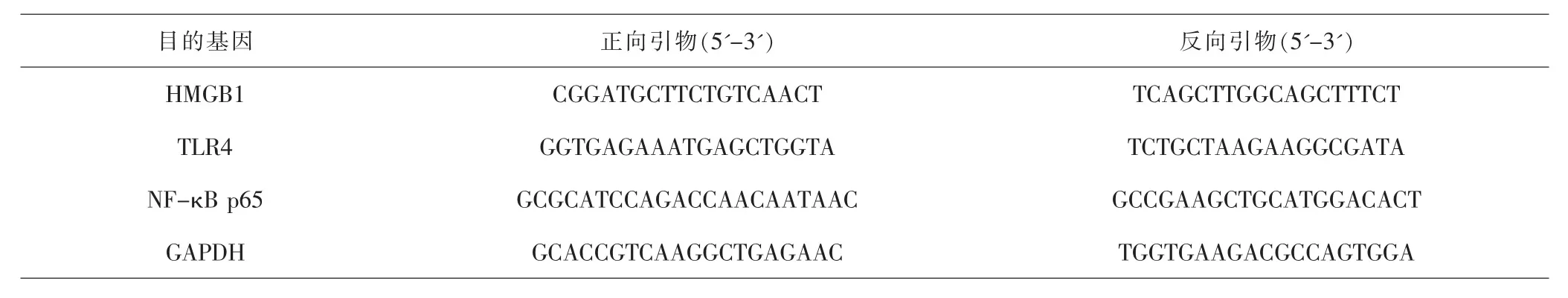
表1 引物序列Tab.1 Primer sequences
1.3.8 Western blot检测肺组织HMGB1、TLR4和NF-κB p65蛋白表达水平 取-80℃冻存的大鼠肺组织,冰上研磨,离心取沉淀,加入裂解液提取肺组织蛋白,以二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒测定蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶 电 泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后转膜,5%脱脂奶粉封闭2h,加入HMGB1、TLR4和NF-κB p65兔源一抗(稀释比例均为1∶1 000),4℃孵育过夜,次日以含Tween的Tris缓冲盐溶液(Tris buffered saline with Tween,TBST)清洗后加入羊抗兔二抗(稀释比例为1∶2 000),37℃孵育2h,洗膜,滴加发光液,置于凝胶成像系统显影。以GAPDH为内参照,采用Image J软件分析各个蛋白对应灰度值,计算蛋白相对表达量。
1.4 统计学分析 应用SPSS 25.0统计软件进行统计学分析,计量资料以±s表示,多样本间比较采用单因素方差分析,两样本比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 造模后3~24h内,模型组和PD高、中、低剂量组大鼠均出现竖毛、少尿、腹泻、直肠温度下降现象,皮毛杂乱无光泽,眼角出现血性分泌物,表明造模成功。经过PD治疗后,PD高、中剂量组大鼠竖毛、少尿、腹泻情况明显改善,皮毛恢复光泽,直肠温度恢复正常,眼角血性分泌物减少;而PD低剂量组大鼠仍存在皮毛杂乱无光泽、少尿、腹泻、直肠温度低等体征,眼角仍可见明显的血性分泌物。
2.2 各组大鼠血清炎症因子TNF-α、IL-1β、IL-6水平比较 各组间总体比较,血清炎症因子TNF-α、IL-1β、IL-6水平差异有统计学意义(P<0.01)。与假手术组比较,模型组、PD各剂量组大鼠血清上述炎症因子水平均显著升高(P<0.05)。与模型组比较,PD高、中剂量组大鼠上述血清炎症因子水平降低(P<0.05),PD低剂量组炎症因子水平差异无统计学意义(P>0.05);与PD高剂量组比较,PD中、低剂量组炎症因子水平均升高(P<0.05);与PD中剂量组比较,PD低剂量组炎症因子水平升高(P<0.05)。见表2。
表2 各组大鼠血清TNF-α、IL-1β、IL-6水平比较(±s,pg·mL-1)Tab.2 Comparison of the serum levels of TNF-α,IL-1β and IL-6 in each group(±s,pg·mL-1)

表2 各组大鼠血清TNF-α、IL-1β、IL-6水平比较(±s,pg·mL-1)Tab.2 Comparison of the serum levels of TNF-α,IL-1β and IL-6 in each group(±s,pg·mL-1)
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05;与PD高剂量组比较,▲P<0.05;与PD中剂量组比较,△P<0.05Note:Compared with sham operation group,#P<0.05;compared with model group,*P<0.05;compared with PD high-dose group,▲P<0.05;compared with PD medium-dose group,△P<0.05
组别 n TNF-α IL-1β IL-6假手术组 10 66.85±19.24 62.38±20.98 58.69±18.58模型组 10 320.14±23.96# 411.87±23.99# 398.76±20.57#PD 高剂量组 10 150.24±21.65#* 180.26±22.17#* 168.37±19.38#*PD 中剂量组 10 196.37±22.87#*▲ 208.39±21.56#*▲ 238.22±21.66#*▲PD 低剂量组 10 315.29±22.44#▲△ 400.65±23.54#▲△ 394.59±20.87#▲△F值 108.65 145.62 89.54 P 值 <0.01 <0.01 <0.01
2.3 各组大鼠肺组织W/D值比较 各组间总体比较,肺组织W/D值差异有统计学意义(P<0.01)。与假手术组比较,模型组、PD各剂量组大鼠W/D值均升高(P<0.05)。与模型组比较,PD高、中剂量组W/D值降低(P<0.05),而PD低剂量组W/D值差异无统计学意义(P>0.05);与PD高剂量组比较,PD中、低剂量组W/D值升高(P<0.05);与PD中剂量组比较,PD低剂量组W/D值升高(P<0.05)。 见表3。
表3 各组大鼠肺组织W/D值比较(±s)Tab.3 Comparison of W/D value of lung tissues in each group(±s)

表3 各组大鼠肺组织W/D值比较(±s)Tab.3 Comparison of W/D value of lung tissues in each group(±s)
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05;与PD高剂量组比较,▲P<0.05;与PD中剂量组比较,△P<0.05Note:Compared with sham operation group,#P<0.05;compared with model group,*P<0.05;compared with PD high-dose group,▲P<0.05;compared with PD medium-dose group,△P<0.05
组别n W/D假手术组 10 4.11±0.31模型组 10 6.40±0.52#PD高剂量组 10 4.79±0.38#*PD 中剂量组 10 5.35±0.42#*▲PD 低剂量组 10 6.28±0.49#▲△F值 28.94 P值 <0.01
2.4 各组大鼠肺组织MDA水平及SOD活力比较 各组间总体比较,肺组织MDA水平及SOD活力差异有统计学意义(P<0.01)。 与假手术组比较,模型组、PD各剂量组MDA水平升高,SOD活力降低(P<0.05)。 与模型组比较,PD高、中剂量组MDA水平降低,SOD活力升高(P<0.05),而PD低剂量组MDA水平和SOD活力差异无统计学意义 (P>0.05);与PD高剂量组比较,PD中、低剂量组MDA水平升高,SOD活力降低(P<0.05);与PD中剂量组比较,PD低剂量组MDA水平升高,SOD活力降低(P<0.05)。 见表4。
表4 各组大鼠肺组织MDA水平和SOD活力比较(±s)Tab.4 Comparison of level of MDA and SOD activity of lung tissues in each group(±s)
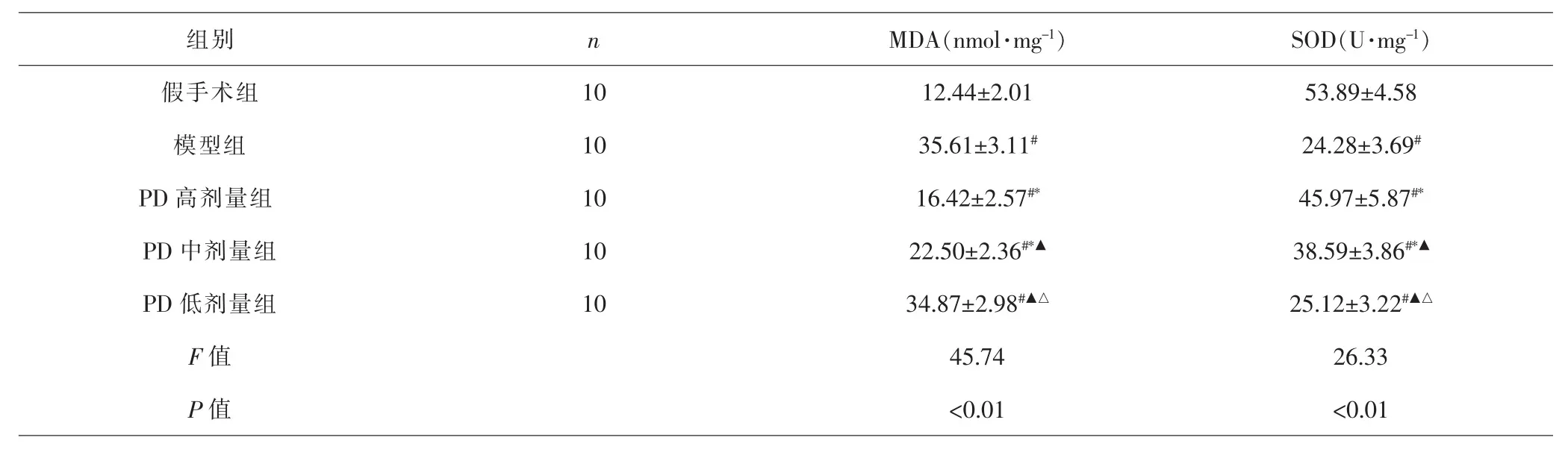
表4 各组大鼠肺组织MDA水平和SOD活力比较(±s)Tab.4 Comparison of level of MDA and SOD activity of lung tissues in each group(±s)
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05;与PD高剂量组比较,▲P<0.05;与PD中剂量组比较,△P<0.05Note:Compared with sham operation group,#P<0.05;compared with model group,*P<0.05;compared with PD high-dose group,▲P<0.05;compared with PD medium-dose group,△P<0.05
组别 n MDA(nmol·mg-1) SOD(U·mg-1)假手术组 10 12.44±2.01 53.89±4.58模型组 10 35.61±3.11# 24.28±3.69#PD 高剂量组 10 16.42±2.57#* 45.97±5.87#*PD 中剂量组 10 22.50±2.36#*▲ 38.59±3.86#*▲PD 低剂量组 10 34.87±2.98#▲△ 25.12±3.22#▲△F值 45.74 26.33 P值 <0.01 <0.01
2.5 各组大鼠肺组织病理变化比较 HE染色显示,假手术组大鼠肺组织结构清晰、完整,肺泡腔结构正常,无渗液,无炎性细胞浸润,肺泡壁光滑。与假手术组比较,模型组大鼠肺组织结构紊乱,肺泡壁明显增厚,失去正常形态,肺间质水肿充血,可见大量炎性细胞浸润。与模型组比较,PD高、中剂量组大鼠肺组织损伤情况得到一定程度改善,肺泡结构基本清晰,水肿和充血程度减轻,有少量炎性细胞浸润,但PD低剂量组肺组织病理切片仍显示有大量炎性细胞浸润,肺泡壁增厚、充血。见图1。
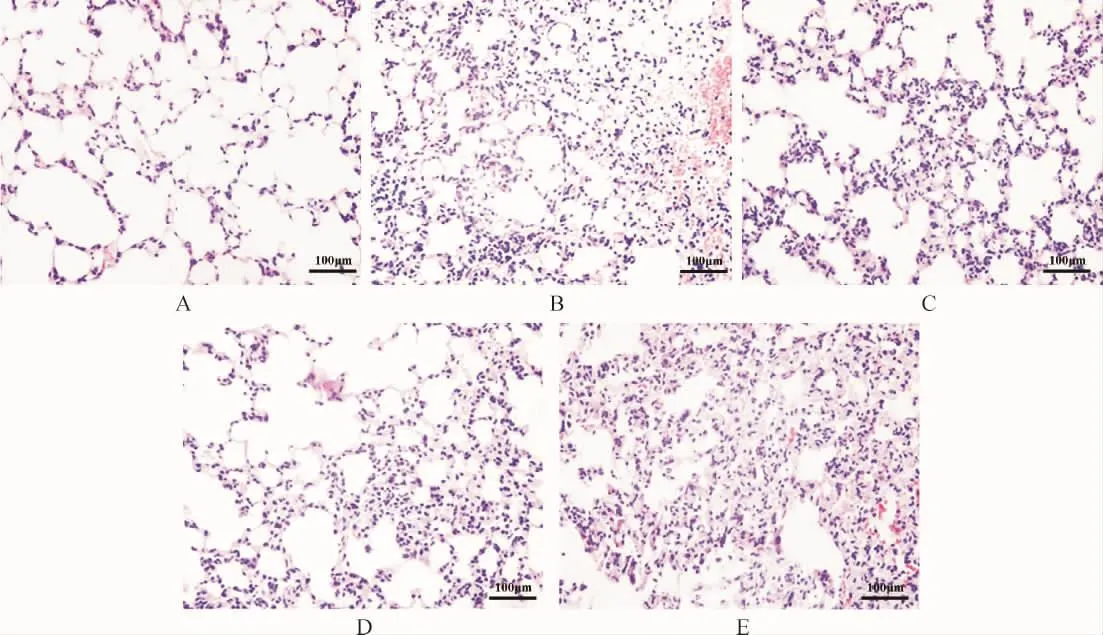
图1 各组大鼠肺组织病理变化比较(HE染色,400×)Fig.1 Comparison of pathological changes of lung tissues in each group(HE staining,400×)
2.6 各组大鼠肺组织HMGB1、TLR4和NF-κB p65 mRNA表达比较 各组间总体比较,肺组织HMGB1、TLR4和NF-κB p65 mRNA表达差异有统计学意义(P<0.01)。与假手术组比较,模型组、PD各剂量组HMGB1、TLR4和NF-κB p65 mRNA表达增高(P<0.05)。 与模型组比较,PD高、中剂量组HMGB1、TLR4和NF-κB p65 mRNA表达显著降低(P<0.05),而PD低剂量组HMGB1、TLR4和NF-κB p65 mRNA表达差异无统计学意义(P>0.05);与PD高剂量组比较,PD中、低剂量组HMGB1、TLR4和NF-κB p65 mRNA表达增高(P<0.05); 与PD中剂量组比较,PD低剂量组HMGB1、TLR4和NF-κB p65 mRNA表达增高(P<0.05)。 见表5。
表5 各组大鼠肺组织中HMGB1、TLR4和NF-κB p65 mRNA表达比较(±s)Tab.5 Comparison of HMGB1,TLR4 and NF-κB p65 mRNA expression of lung tissues in each group(±s)

表5 各组大鼠肺组织中HMGB1、TLR4和NF-κB p65 mRNA表达比较(±s)Tab.5 Comparison of HMGB1,TLR4 and NF-κB p65 mRNA expression of lung tissues in each group(±s)
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05;与PD高剂量组比较,▲P<0.05;与PD中剂量组比较,△P<0.05Note:Compared with sham operation group,#P<0.05;compared with model group,*P<0.05;compared with PD high-dose group,▲P<0.05;compared with PD medium-dose group,△P<0.05
组别 n HMGB1 TLR4 NF-κB p65假手术组 10 1.05±0.13 1.02±0.09 0.99±0.10模型组 10 2.65±0.18# 1.95±0.16# 2.78±0.19#PD 高剂量组 10 1.35±0.15#* 1.40±0.13#* 1.38±0.12#*PD 中剂量组 10 1.96±0.16#*▲ 1.72±0.15#*▲ 1.81±0.16#*▲PD 低剂量组 10 2.58±0.20#▲△ 1.98±0.18#▲△ 2.45±0.17#▲△F值 54.11 28.47 36.58 P 值 <0.01 <0.01 <0.01
2.7 各组大鼠肺组织HMGB1、TLR4和NF-κB p65蛋白表达比较 各组间总体比较,肺组织HMGB1、TLR4和NF-κB p65蛋白表达差异有统计学意义(P<0.01)。与假手术组比较,模型组、PD各剂量组大鼠肺组织HMGB1、TLR4和NF-κB p65蛋白表达增高(P<0.05)。 与模型组比较,PD高、中剂量组HMGB1、TLR4和NF-κB p65蛋白表达显著降低(P<0.05),而PD低剂量组HMGB1、TLR4和NF-κB p65蛋白表达差异无统计学意义(P>0.05);与PD高剂量组比较,PD中、低剂量组HMGB1、TLR4和NF-κB p65蛋白表达增高(P<0.05);与PD中剂量组比较,PD低剂量组HMGB1、TLR4和NF-κB p65蛋白表达增高(P<0.05)。见图2、表6。
表6 各组大鼠肺组织HMGB1、TLR4和NF-κB p65蛋白表达比较(±s)Tab.6 Comparison of HMGB1,TLR4 and NF-κB p65 protein expression of lung tissues in each group(±s)
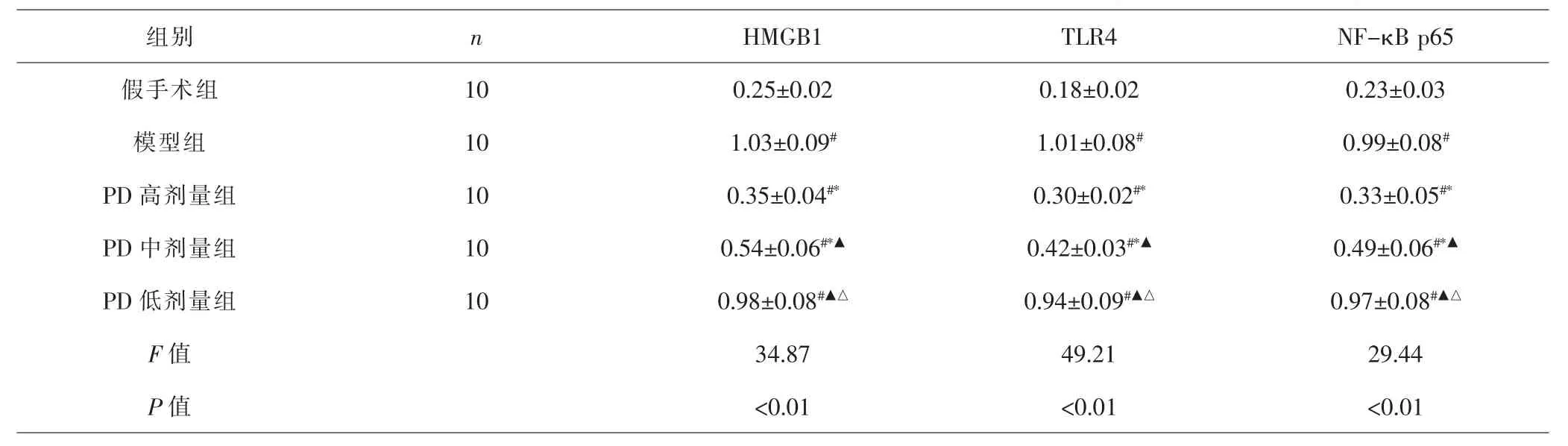
表6 各组大鼠肺组织HMGB1、TLR4和NF-κB p65蛋白表达比较(±s)Tab.6 Comparison of HMGB1,TLR4 and NF-κB p65 protein expression of lung tissues in each group(±s)
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05;与PD高剂量组比较,▲P<0.05;与PD中剂量组比较,△P<0.05Note:Compared with sham operation group,#P<0.05;compared with model group,*P<0.05;compared with PD high-dose group,▲P<0.05;compared with PD medium-dose group,△P<0.05
组别 n HMGB1 TLR4 NF-κB p65假手术组 10 0.25±0.02 0.18±0.02 0.23±0.03模型组 10 1.03±0.09# 1.01±0.08# 0.99±0.08#PD 高剂量组 10 0.35±0.04#* 0.30±0.02#* 0.33±0.05#*PD 中剂量组 10 0.54±0.06#*▲ 0.42±0.03#*▲ 0.49±0.06#*▲PD 低剂量组 10 0.98±0.08#▲△ 0.94±0.09#▲△ 0.97±0.08#▲△F值 34.87 49.21 29.44 P 值 <0.01 <0.01 <0.01
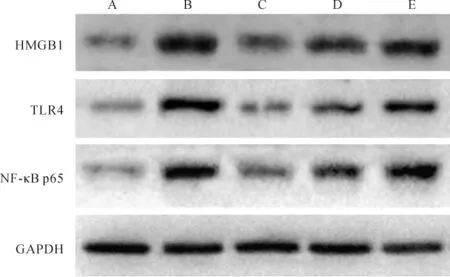
图2 Western blot检测各组大鼠肺组织HMGB1、TLR4和NF-κB p65蛋白表达Fig.2 Protein expression of HMGB1,TLR4 and NF-κB p65 in lung tissues in each group detected with Western blot
3 讨论
脓毒症是继发于感染的致命性急性器官功能障碍,其病理生理反应极为复杂,包括促炎途径和先天性免疫途径的激活、适应性免疫途径的改变等过程,其发生同时也取决于宿主和病原体的特征,以及患者所经历的医疗事件(如手术和其他感染)和治疗方法[10-11]。肺部是脓毒症病程中最易受到影响的器官,ALI则是脓毒症诱发的常见炎性疾病,严重者可发展为ARDS[12]。临床研究显示,中药对于脓毒症相关ALI和ARDS具有较好的治疗效果,可作为ARDS的临床辅助治疗[13]。PD是中药虎杖的主要活性成分,Cao等[14]研究发现,PD可通过抑制上皮-间充质转化过程减轻小鼠放射性肺损伤,从而有效抑制肺炎和肺纤维化的发展。Fu等[15]研究表明,PD可缓解百草枯引起的人胚肺成纤维细胞MRC-5损伤,其机制与抑制炎症反应、提高抗氧化能力及抑制核苷酸结合寡聚结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor pyrin domain 3,NLRP3)炎症小体活化有关。虽然已有研究证明,PD对多种肺损伤性疾病具有治疗作用,但其对脓毒症相关ALI的影响尚不清楚。
本研究构建了大鼠脓毒症ALI模型,造模后大鼠均出现竖毛、少尿、腹泻、直肠温度下降现象,皮毛杂乱无光泽,眼角出现血性分泌物,表明造模成功。PD治疗后,PD高、中剂量组大鼠竖毛、少尿、腹泻情况明显改善,皮毛恢复光泽,眼角分泌物减少,表明一定剂量PD可改善脓毒症ALI模型大鼠的体征。在脓毒症相关ALI发病过程中,炎症反应的迅速发展和氧化应激损伤是导致机体多器官损害的重要原因,多种细胞因子共同参与了这一过程[16-17]。TNF-α是ARDS发生发展中的关键因子,能够刺激其他炎症因子的分泌和释放,并逐级扩大炎症反应,加重肺损伤[18]。在这一过程中,IL-1β和IL-6等炎症因子大量表达,募集炎性细胞,诱发炎症级联反应,可迅速加重病情,甚至导致患者死亡[19]。本研究结果显示,与假手术组比较,模型组大鼠血清TNF-α、IL-1β、IL-6水平显著升高;与模型组比较,PD高、中剂量组大鼠血清炎症因子水平均降低,但低剂量PD干预未达到降低血清炎症因子水平的效果。模型组大鼠肺组织W/D值显著升高,与模型组比较,PD高、中剂量组W/D值显著降低,而PD低剂量组W/D值差异无统计学意义,初步证明一定剂量的PD能够抑制肺损伤大鼠炎症反应,减轻脓毒症诱发的肺损伤。
氧化应激反应是肺损伤的基本病理生理过程,MDA水平高低能够直接反映机体的氧化应激反应强弱;而SOD则可清除有害氧自由基,抑制氧化应激损伤[20]。本研究中,模型组大鼠肺组织MDA水平显著高于假手术组,而SOD活力低于假手术组;与模型组比较,PD高、中剂量组MDA水平降低,SOD活力升高,而PD低剂量组MDA水平和SOD活力差异无统计学意义,表明一定剂量PD能够抑制脓毒症相关肺损伤的氧化应激反应。进一步采用HE染色观察各组大鼠肺组织病变,结果显示,模型组大鼠肺组织结构紊乱,肺泡壁明显增厚,失去正常形态,肺间质水肿充血,有大量炎性细胞浸润,而PD高、中剂量组大鼠肺组织损伤得到一定程度缓解,肺泡结构基本清晰,水肿和充血程度减轻,炎性细胞浸润减少,表明PD能够显著减轻脓毒症诱发的肺组织损伤。
目前虽然脓毒症相关肺损伤的发病机制尚未完全阐明,但已有研究证明,HMGB1/TLR4/NF-κB信号通路在多种原因所致的肺损伤中发挥了重要调控作用[8]。HMGB1是高度保守的核蛋白,在受到脂多糖、TNF-α或IL-1刺激后,由单核巨噬细胞和其他免疫细胞释放,也可由受损和坏死的组织细胞被动释放,进一步促进多种炎症因子的分泌,参与脓毒症、败血症、肺炎和关节炎等疾病的发展过程[21]。TLR4是HMGB1诱导炎症的必需受体,HMGB1可激活TLR2和TLR4,进而靶向作用于NF-κB并启动下游炎症反应[22]。Wang等[23]研究证明,抑制TLR4/NF-κB信号通路的激活,能够减轻败血症引起的ALI。张建峰等[24]研究发现,右美托咪定能够通过抑制TLR4/NF-κB信号通路,减轻炎症反应,缓解大鼠脓毒症肺损伤。本研究结果提示,与假手术组比较,模型组大鼠肺组织HMGB1、TLR4和NF-κB p65 mRNA和蛋白表达显著增高;与模型组比较,PD高、 中剂量组HMGB1、TLR4和NF-κB p65 mRNA和蛋白表达显著降低,而PD低剂量组HMGB1、TLR4和NF-κB p65 mRNA和蛋白表达差异无统计学意义,表明PD可能通过抑制HMGB1/TLR4/NF-κB信号通路的激活,从而发挥对脓毒症相关ALI的治疗作用。
综上所述,PD对大鼠脓毒症相关ALI具有治疗作用,能够减轻大鼠肺组织病理变化,缓解炎症和氧化应激损伤,其作用机制与抑制HMGB1/TLR4/NF-κB信号通路的活化有关。但本研究仅在体内实验水平进行了初步探讨,更详细的分子机制仍需结合体外实验进一步探究。
