SCD1对甲状腺乳头状癌细胞增殖和侵袭的影响及其机制研究
2021-08-08任欣欣孙玉华刘国权
王 玥,李 强,任欣欣,孙玉华,刘国权
(蚌埠医学院 1.检验系生物化学与分子生物学教研室,2.安徽省癌症转化医学重点实验室,3.生命科学院细胞生物学系,安徽 蚌埠 2 33030)
甲状腺癌是最常见的内分泌恶性肿瘤,占全世界所有癌症2.1%,其中女性患者占大多数[1]。甲状腺癌中最常见的组织类型是甲状腺乳头状癌(papillary thyroid cancer,PTC),其总体预后最好,最常见的转移部位是颈部淋巴结[2]。甲状腺乳头状癌发展相对缓慢,外科手术为预后较好的治疗手段,但由于患者早期症状不明显,发现时大多已经发生远处器官或淋巴结转移,且术后极易复发[3]。因此筛选新的诊断标记物对于甲状腺乳头状癌的早期诊断和治疗至关重要。
硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)是催化饱和脂肪酸(saturated fatty acid,SFA)向单不饱和脂肪酸(monounsaturated fatty acid,MUFA)转 化 的 关 键 酶[4]。研 究 表 明,SCD1在多种恶性肿瘤中高表达,并且参与肿瘤细胞的侵袭转移过程,如乳腺癌、肾癌、卵巢癌和非小细胞肺癌等[5-8]。有报道显示,SCD1在甲状腺乳头状癌组织中同样呈高表达[9],然而SCD1对于甲状腺癌细胞增殖转移的影响及其分子机制尚未得到充分研究。因此,本研究探讨了SCD1对甲状腺乳头状癌细胞增殖、转移和侵袭以及上皮-间质转化(epithelial mesenchymal transition,EMT)的影响,为甲状腺乳头状癌的靶向治疗提供新的方向。
1 材料与方法
1.1 细胞株及主要试剂
人甲状腺滤泡上皮正常细胞Nthy-ori 3-1和甲状腺乳头状癌细胞株TPC1、BCPAP、K 1均购自合肥维三生物科技有限公司,RPMI-1640培养基、DMEM培养基、胎牛血清以及胰蛋白酶均购自美国Gibco公司,si-NC和si-SCD1购自广州锐博生物技术有限公司,辣根过氧化物酶标记的羊抗兔/鼠二抗、极超敏ECL化学发光试剂盒、CCK-8溶液、BCA蛋白浓度测定试剂盒、转染试剂Lipo8000以及cDNA反转录试剂盒均购自上海碧云天生物技术有限公司,实时荧光定量PCR试剂2×Real Star Green Fast Mixture(with ROXⅡ)购自GenStar康润生物有限公司,一抗(SCD1,N-cadherin,Snail,vimentin,E-cadherin,β-actin)购自上海艾博抗贸易有限公司,Transwell小室和Matrigel基质胶购自Conring公司。
1.2 细胞培养及转染
用含10%胎牛血清的RPMI-1640培养基培养Nthy-ori 3-1细胞和TPC1细胞,含10%胎牛血清的DMEM培养基培养BCPAP细胞和K1细胞,于37℃、5%CO2浓度条件的培养箱中进行培养,所有实验细胞处于对数生长期。待细胞融合度达到70%~80%时,采用Lipo8000转染试剂对细胞进行转染,转染步骤严格按照转染说明书进行,24 h后收集细胞进行相应检测。细胞分为3组,分别是空白对照组(Control)、对照干扰组(si-NC)和干扰SCD1组(si-SCD1),三组分别设置3个复孔,重复3次试验。
1.3 qRT-PCR实验检测SCD1、N-cadherin、Snail、vimentin和E-cadherin mRNA表达水平
分别收集转染后各组TPC1细胞,采用Trizol法提取细胞总RNA,并用紫外分光光度计检测其浓度和纯度。按照反转录试剂盒说明书将RNA反转录得到cDNA,并调整cDNA浓度,以此cDNA为模板进行PCR扩增。扩增条件为:95℃2 min,95℃15 s,60℃30 s,共40个循环。以β-actin为内参,最终Ct值采用2-ΔΔCt方法进行分析,引物序列见表1。所有实验均进行3次。

表1 PCR扩增引物序列Tab 1 PCR amplification primer sequences
1.4 Western blot实 验 检 测SCD1、N-cadherin、Snail、vimentin和E-cadherin蛋白表达水平
收集转染24 h后的各组细胞,向细胞中加入RIPA裂解液,4℃放置30 min后提取细胞总蛋白,BCA法测定浓度,平衡每孔的上样量为20μg/孔,于10%的SDS-PAGE上进行电泳分离,使用PVDF膜转膜,5%的脱脂奶粉室温封闭1 h,加入一 抗(SCD1、N-cadherin、Snail、vimentin、E-cadherin、β-actin按1∶1 000稀释),于4℃孵育过夜。TBST洗膜10 min×3次,加入二抗(1∶4 000),室温避光孵育2 h,TBST洗膜10 min×3次。采用ECL化学发光法显影拍照。
1.5 CCK-8法检测细胞增殖能力
将处于对数生长期的细胞消化计数,调整细胞密度为6 000个/孔的细胞悬液,取100μL接种至96孔板。待细胞密度达到50%时进行转染,分别在转染0、24、48、72 h时,向每孔中加入10μL CCK-8溶液,于细胞培养箱中继续培养2 h,最后使用酶标仪检测450 nm时的OD值,绘制生长曲线。每次实验重复3次,每组设定3个复孔。
1.6 Transwell小室法检测细胞迁移能力
将转染后的各组细胞分别消化计数,用无血清培养基重悬成单细胞,以6×104个/小室的细胞密度接种于Transwell上室,下室加入含有10%胎牛血清的1640培养基,37℃、5%CO2细胞培养箱中继续培养24 h。使用棉签擦去未穿过底膜的细胞,4%多聚甲醛固定20 min,0.25%结晶紫染色30 min,洗净晾干,在倒置显微镜下观察拍照,统计跨膜细胞数并计算平均值。迁移抑制率(%)=(1−处理组迁移细胞个数/对照组迁移细胞个数)×100%。
1.7 Transwell小室法检测细胞侵袭能力
将Materigel胶与无血清1640培养基按1∶8的比例稀释,在Transwell小室中包被Materigel基质胶,于37℃、1 h凝固后风干,后续步骤同迁移实验。侵袭抑制率(%)=(1−处理组侵袭细胞个数/对照组侵袭细胞个数)×100%。
1.8 统计学处理
采用SPSS 20.0统计软件对数据进行统计分析,所有数据采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SCD1在不同甲状腺癌细胞系中的表达水平
Western blot实验结果表明,与人甲状腺滤泡上皮正常细胞Nthy-ori 3-1相比,甲状腺乳头状癌BCPAP、K1和TPC1细胞中的SCD1表达量明显增加,差异有统计学意义(P<0.05,表2、图1)。由于TPC1细胞中SCD1表达量最高,因此选择TPC1细胞进行后续研究。
表2 SCD1在不同甲状腺癌细胞系中的表达水平(n=3,±s)Tab 2 Expression of SCD1 in different thyroid cancer cell lines(n=3,±s)

表2 SCD1在不同甲状腺癌细胞系中的表达水平(n=3,±s)Tab 2 Expression of SCD1 in different thyroid cancer cell lines(n=3,±s)
注:与Nthy-ori3-1细胞相比,*P<0.05。
组别Nthy−ori3−1 BCPAP K1 TPC1 FP SCD1 0.55±0.30 0.65±0.28*0.84±0.39*1.22±0.32*218.184 0.000

图1 SCD1在不同甲状腺癌细胞系中的表达水平Fig 1 Expression of SCD1 in different thyroid cancer cell lines
2.2 qRT-PCR和Western blot实验检测细胞中SCD1的表达
采用qRT-PCR和Western blot实验对SCD1的干扰效率进行验证。结果显示,与Control组(空白对照组)和si-NC组(对照干扰组)比较,si-SCD1组细胞中SCD1 mRNA和蛋白表达水平显著降低,差异有统计学意义(P<0.05,表3、图2)。表明siRNA可以有效干扰SCD1的表达。
表3 TPC1细胞中SCD1 mRNA及蛋白表达水平(n=3,±s)Tab 3 Expression level of SCD1 m RNA and protein in TPC1 cells(n=3,±s)
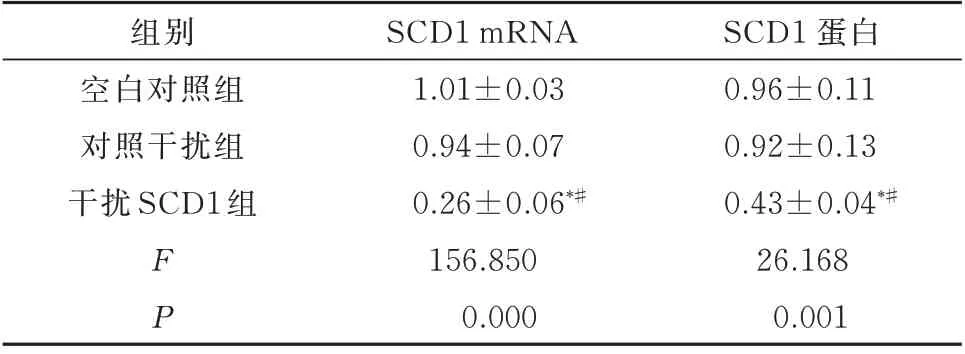
表3 TPC1细胞中SCD1 mRNA及蛋白表达水平(n=3,±s)Tab 3 Expression level of SCD1 m RNA and protein in TPC1 cells(n=3,±s)
注:与空白对照组比较,*P<0.05;与对照干扰组比较,#P<0.05。
组别空白对照组对照干扰组干扰SCD1组FP SCD1 mRNA 1.01±0.03 0.94±0.07 0.26±0.06*#156.850 0.000 SCD1蛋白0.96±0.11 0.92±0.13 0.43±0.04*#26.168 0.001
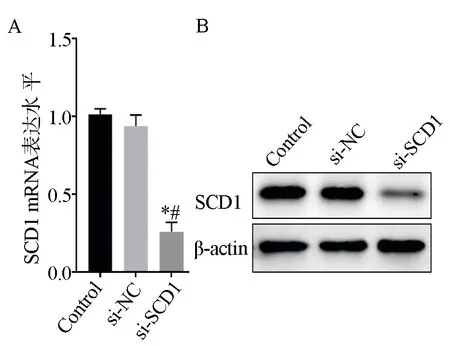
图2 TPC1细胞中SCD1 mRNA及蛋白表达水平Fig 2 Expression level of SCD1 mRNA and protein in TPC1 cells
2.3 干扰SCD1对TPC1细胞增殖能力的影响
CCK-8法检测细胞增殖的结果显示,与Control组和si-NC组比较,si-SCD1组TPC1细胞在24、48、72 h时OD值明显减小,差异有统计学意义(P<0.05,见表4)。表明干扰SCD1能够抑制TPC1细胞的增殖。
表4 干扰SCD1对TPC1细胞增殖能力的影响(n=3,±s)Tab 4 The influence of disturbing SCD1 on proliferation of TPC1 cells(n=3,±s)

表4 干扰SCD1对TPC1细胞增殖能力的影响(n=3,±s)Tab 4 The influence of disturbing SCD1 on proliferation of TPC1 cells(n=3,±s)
注:与空白对照组比较,*P<0.05;与对照干扰组比较,#P<0.05。
组别空白对照组对照干扰组干扰SCD1组FP 0 h 0.07±0.05 0.07±0.05 0.10±0.01 0.500 0.630 24 h 0.37±0.01 0.37±0.04 0.13±0.01*#96.957 0.000 48 h 0.67±0.24 0.61±0.74 0.24±0.41*#63.993 0.000 72 h 1.03±0.65 1.15±0.17 0.41±0.06*#161.719 0.000
2.4 干扰SCD1对TPC1细胞迁移及侵袭能力的影响
Transwell迁移实验结果显示,与Control组和si-NC组比较,si-SCD1组TPC1细胞的迁移能力显著降低,差异有统计学意义(P<0.05,表5、图3A)。Transwell侵袭实验结果显示,与Control组和si-NC组比较,si-SCD1组细胞的侵袭能力显著降低,差异有统计学意义(P<0.05,表5、图3B)。说明干扰SCD1能够抑制TPC1细胞的迁移和侵袭。
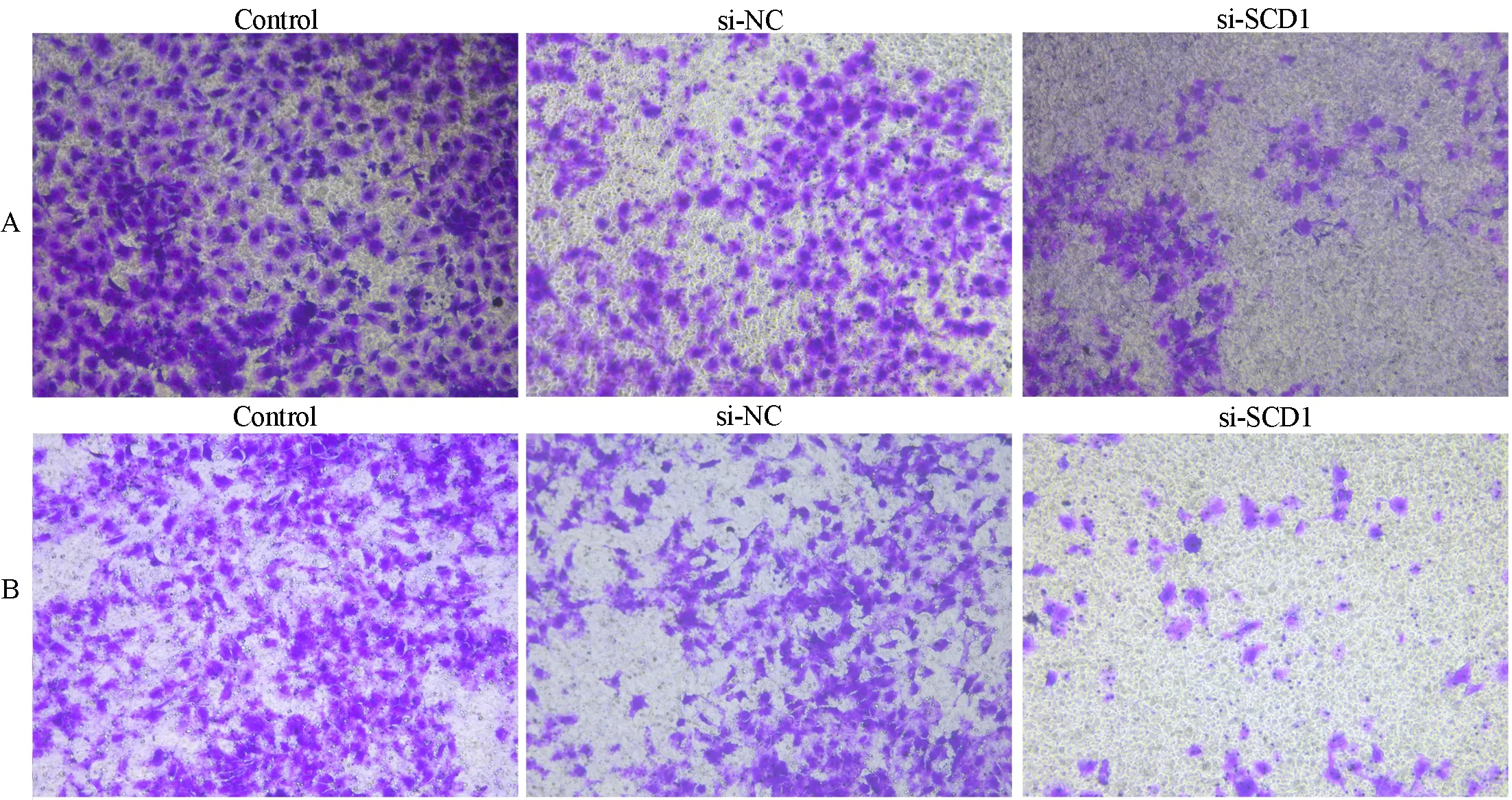
图3 Transwell实验检测干扰SCD1后对T PC1细胞迁移及侵袭能力的影响Fig 3 The migration and invasion of TPC1 cells after interfering SCD1 by Transwell assay
2.5 干扰SCD1对TPC1细胞EMT的影响
表5干扰SCD1对TPC1细胞迁移及侵袭能力影响(n=3,±s)Tab 5 Effects of interfering SCD1 on migration and invasion of TPC1 cells(n=3,±s)
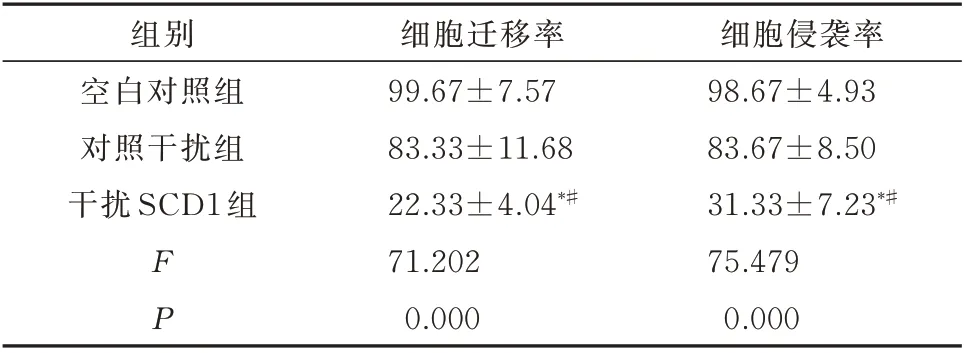
表5干扰SCD1对TPC1细胞迁移及侵袭能力影响(n=3,±s)Tab 5 Effects of interfering SCD1 on migration and invasion of TPC1 cells(n=3,±s)
注:与空白对照组比较,*P<0.05;与对照干扰组比较,#P<0.05。
组别空白对照组对照干扰组干扰SCD1组FP细胞迁移率99.67±7.57 83.33±11.68 22.33±4.04*#71.202 0.000细胞侵袭率98.67±4.93 83.67±8.50 31.33±7.23*#75.479 0.000
采用qRT-PCR和Western blot法检测EMT标志蛋白的表达情况。qRT-PCR结果显示,干扰SCD1后TPC1细胞N-cadherin、vimentin和Snail的表达明显降低,显著低于空白对照组和对照干扰组,而上皮细胞的标志物E-cadherin的表达明显升高,差 异 有 统 计 学 意 义(P<0.05,表6、图4A)。Western blot结果同样证明了,干扰SCD1在TPC1细胞中能下调N-cadherin、vimentin和Snail的表达,且上调E-cadherin的表达,差异有统计学意义(P<0.05,表7、图4B)。结果表明SCD1通过调控EMT途径进而促进了TPC1细胞的增殖、迁移和侵袭。
表6 干扰SCD1后对N-cadherin、vimentin、Snail和E-cad⁃herin m RNA的影响(n=3,±s)Tab 6 Influence on N-cadherin,vimentin,Snail and E-cad⁃herin mRNA after interfering with SCD1(n=3,±s)
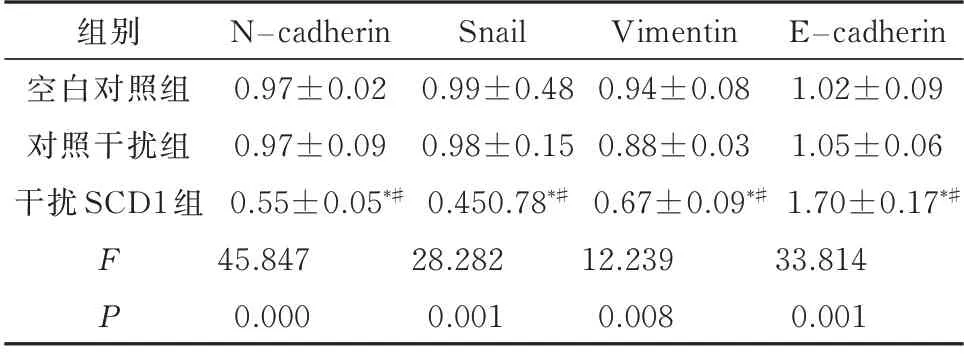
表6 干扰SCD1后对N-cadherin、vimentin、Snail和E-cad⁃herin m RNA的影响(n=3,±s)Tab 6 Influence on N-cadherin,vimentin,Snail and E-cad⁃herin mRNA after interfering with SCD1(n=3,±s)
注:与空白对照组比较,*P<0.05;与对照干扰组比较,#P<0.05。
组别空白对照组对照干扰组干扰SCD1组FP N−cadherin 0.97±0.02 0.97±0.09 0.55±0.05*#45.847 0.000 Snail 0.99±0.48 0.98±0.15 0.450.78*#28.282 0.001 Vimentin 0.94±0.08 0.88±0.03 0.67±0.09*#12.239 0.008 E−cadherin 1.02±0.09 1.05±0.06 1.70±0.17*#33.814 0.001
表7 干扰SCD1后对N-cadherin、vimentin、Snail和E-cadherin蛋白的影响(n=3,±s)Tab 7 Effects of interfering with SCD1 on N-cadherin,vimentin,Snail and E-cadherin proteins(n=3,±s)
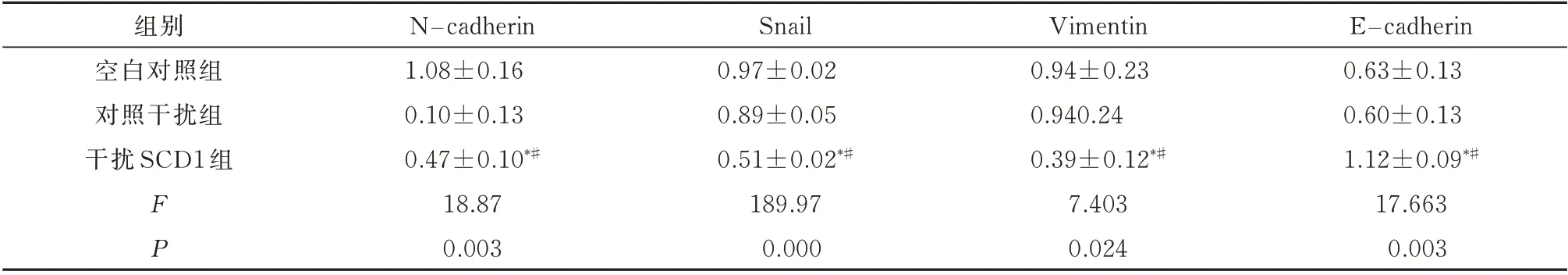
表7 干扰SCD1后对N-cadherin、vimentin、Snail和E-cadherin蛋白的影响(n=3,±s)Tab 7 Effects of interfering with SCD1 on N-cadherin,vimentin,Snail and E-cadherin proteins(n=3,±s)
注:与空白对照组比较,*P<0.05;与对照干扰组比较,#P<0.05。
E−cadherin 0.63±0.13 0.60±0.13 1.12±0.09*#17.663 0.003组别空白对照组对照干扰组干扰SCD1组FP N−cadherin 1.08±0.16 0.10±0.13 0.47±0.10*#18.87 0.003 Snail 0.97±0.02 0.89±0.05 0.51±0.02*#189.97 0.000 Vimentin 0.94±0.23 0.940.24 0.39±0.12*#7.403 0.024

图4 qRT-PCR和Western blot实验检测干扰SCD1后EMT相关蛋白表达情况Fig 4 q RT-PCR and Wester n blot for detecting expr essions of EMT-related pr oteins after inter fer ing SCD 1
3 讨论
乳头状癌、滤泡状癌、髓样癌和未分化癌是甲状腺癌的4种病理类型,其中甲状腺乳头状癌最常见[10]。尽管乳头状癌预后较佳,但容易发生淋巴结转移而严重影响预后[11]。因此,探究甲状腺癌乳头状癌发生和转移的分子机制,寻找治疗甲状腺癌乳头状癌的分子诊断靶点具有重要意义。
越来越多的研究表明,SCD1与多种恶性肿瘤的发生发展密切相关[12]。有研究发现,SCD1在胃癌组织中表达上调,并且能够促进胃癌细胞的增殖和侵袭能力以及EMT过程[13]。黄光明等[14]研究证实,SCD1可以通过下调AMPK途径负性调节自噬,从而减少肝癌细胞的凋亡率,促进其转移。Li[15]等研究显示,SCD1在子宫内膜癌中高表达,靶向敲除SCD1和使用SCD1抑制剂均能抑制子宫内膜癌细胞系AN 3CA的增殖,促进其凋亡。然而关于SCD1对甲状腺癌细胞的具体生物学影响和作用机制尚未见有关报道。因此,本研究利用siRNA技术干扰甲状腺乳头状癌TPC1细胞中SCD1的表达,并通过CCK-8法和Transwell小室实验证实,干扰SCD1后TPC1细胞的增殖、迁移及侵袭能力明显降低。表明SCD1与甲状腺乳头状癌细胞的侵袭转移密切相关,SCD1可能是甲状腺乳头状癌潜在的诊断标记物和治疗靶点。
上皮-间质转化(EMT)是上皮细胞通过一定的程序向间质细胞转化的生物学过程,其与肿瘤细胞的远处转移密切相关[16]。EMT的生物学特性主要表现在细胞极性的丧失和间质性质的获得,肿瘤细胞能够使上皮标记物E-钙黏蛋白(E-cadherin)失去其功能而表达下调,使间质标记物波形蛋白(Vimentin)和N-钙粘蛋白(N-cadherin)等表达上调,导致上皮细胞极性丧失,细胞黏附能力下降,进而增强肿瘤细胞的侵袭和转移能力[17,18]。锌指转录因子Snail能够抑制E-cadherin基因的表达并且诱导EMT的发生[19]。有研究表明,EMT参与了多种肿瘤细胞的侵袭和转移过程,如膀胱癌、肺癌和结肠癌等[20-22]。然而,关于甲状腺乳头状癌上皮细胞间质化的研究还不够深入。为了探究SCD1是否通过促进EMT途径进而促进了甲状腺乳头状癌细胞的增殖和转移,本研究将si-SCD1转染TPC1细胞,采用qRT-PCR和Western blot方法检测细胞EMT标志 物E-cadherin、Vimentin、Snail和N-cadherin的mRNA和蛋白表达水平,结果显示干扰SCD1能明显上调E-cadherin的表达,而降低Vimentin、Snail和N-cadherin的表达,这一结果证实干扰SCD1能够抑制甲状腺乳头状癌细胞的EMT过程,从而抑制肿瘤细胞的增殖、迁移和侵袭。
综上所述,本研究结果显示干扰SCD1能通过抑制EMT信号通路进而抑制甲状腺乳头状癌细胞的增殖、迁移及侵袭。本研究提示SCD1可能是甲状腺乳头状癌诊断和治疗的新靶点,为寻找甲状腺乳头状癌的靶向药物提供了实验依据。
作者贡献度说明:
刘国权:设计实验;王玥:完成实验、处理数据和撰写论文;李强:修改论文;任欣欣、孙玉华:完成部分实验。
