核受体PXR参与癌症进展及化疗耐药性的作用浅析
2021-08-07王少兰杜旭江马晓真
王少兰,杜旭江,韩 曼,马晓真
(陕西中医药大学陕西省中西医结合心血管病防治重点实验室,西安 712046;*通讯作者,E-mail:wangshaolan13@163.com)
孕烷X受体(pregnane X receptor,PXR)是核受体超家族成员,属于配体激活的转录因子。PXR主要表达在肝脏、小肠、胃和肾脏等组织,是机体对抗内外源有毒物质的重要调节因子,可被多种内外源异物如化疗药物等激活[1]。PXR作为代谢性核受体也可以参与调控糖脂代谢、类固醇代谢、胆汁酸胆红素等的代谢,除此外PXR还具有调控免疫炎症和肿瘤进展等作用[2-7]。研究发现PXR可以参与调控多种肿瘤的发生发展[8,9],但其在肿瘤中的作用目前尚有争议,本文列举了近年来PXR在多种肿瘤进展以及耐药性中的差异作用及相关机制。
1 PXR的结构以及生理学功能
1.1 PXR的分子结构
PXR(NR1I2, nuclear receptor subfamily 1 group I member 2)因其能被内源性的配体孕烷激活,故命名为PXR。PXR的结构类似于其他核受体的结构,包括一个NH2端配体非依赖的激活功能结构域1(activation function-1,AF-1或A/B domain),一个高度保守的DNA结合域(DNA binding domain,DBD或C domain),一个相对保守的铰链结构域(D domain),一个COOH端的配体结构域(ligand binding domain,LBD或E domain),其中LBD结构域中包括一个激活功能结构域2(activation function-2,AF-2或F domian)(见图1)[8]。
1.2 PXR的配体及活化
PXR是参与机体外源异物和内源性有害物质解毒的一类重要核受体,其药物代谢解毒作用更被人熟知。PXR可被大量的配体激活,这正是PXR具有广泛的解毒作用的结构基础。PXR的配体可大致分为三大类:①外源性人工合成物质,包括植物雌激素,环境污染物(农药、塑化剂等)和大量的中西药(紫杉醇、利福平和他汀)等;②维生素类,如维生素E、K2和食物中的胡萝卜素等;③内源性的代谢产物,如孕烷、胆汁酸、胆红素及其他代谢产物[9,10]。区别于其他核受体,PXR的配体存在种属差异,人PXR的配体和鼠PXR配体之间存在很大的差异,像利福平、SR12813和苯巴比妥等均可以激活人源PXR,但是对鼠源PXR的激活效果却很差,而PCN(pregnenolone 16α carbonitrile)是一种强的鼠源PXR激动剂,但对人PXR几乎没有作用。这可能跟PXR的配体结合域的同源性较低有关[11]。

AF-1:NH2端配体非依赖的激活功能结构域1;DBD:DNA结合域;LBD:配体结合域,LBD结构域中包括一个激活功能结构域2(AF2)图1 孕烷X受体(PXR)的结构域
PXR的表达具有组织特异性,PXR首次发现在肝脏和小肠高表达[12],随后发现PXR在肾脏和肺脏中也高表达[13],而这些组织都是外源性异物和内源性有害代谢产物解毒的关键器官。除此外,PXR在其他组织如外周血单核细胞、血脑屏障、胎盘、子宫、卵巢、乳腺、破骨细胞、肾上腺、心脏组织和一些特定的脑部组织等也有少量表达[13]。PXR与配体结合后活化入核,构象发生改变并与维甲酸X受体(retinoid X receptor,RXR)形成异源二聚体,进而与目的基因的启动子区的DNA反应元件(PXR responsive elements,PXREs)结合调控其转录。PXR也可以招募其相关的转录共激活子,如类固醇受体共激活子1(steroid receptor coactivators-1,SRC-1)、SRC-2和过氧化物酶体增殖活化受体γ共激活因子-1α(PGC-1α)等发挥作用[14]。PXR的DNA结合序列的核心反应元件是类AG(G/T)TCA形式,然后以正向重复3(direct repeats 3,DR3)、DR4、DR5和翻转重复6(everted repeats,ER6)和ER8等方式,作用于下游靶基因的DNA反应元件,进而调控目的基因的表达,引发一系列生物学效应[15]。近年来也有研究发现,PXREs也存在DR9、DR14或DR19等形式[16],由此可以看出PXR结合反应元件的多样性。
1.3 PXR的生理学作用
PXR对内外源异物的“解毒”过程主要有3个时相分子的参与(见图2)[9,17]。①Ⅰ相的氧化、还原、水解酶,主要为细胞色素CYP450家族成员,这些酶是机体肝脏和小肠等解毒的主要分子,其中30%的解毒作用由CYP3A酶介导,而临床药物解毒作用的60%也由CYP3A介导。已有文献[14,18-20]报道大量的CYP450家族成员如CYP3A4、CYP3A23、Cyp3a11、CYP2B6、Cyp2b9、Cyp2c55、CYP2C8、CYP2C9、CYP2C19和CYP1A等均可被活化的PXR转录上调。②Ⅱ相的结合酶类,主要是各种转移酶类,如谷胱甘肽转移酶和尿苷二磷酸葡萄糖醛酸转移酶(UGT)等。这些酶可以使外源有害物变成水溶性的无害的小分子物质,进而以胆汁和尿液等形式排出体外。已发现UGT1A1、UGT1A6、UGT1A3、UGT1A4和GSTA1、GSTA2、GSTM1等均为PXR的靶基因[21]。③Ⅲ相的转运蛋白,主要包括多耐药蛋白(multidrug resistance1/2,MDR1/2)和多耐药相关蛋白(MRP2,3,4,5),以及各种ATP转运家族成员(ABC)。这些酶主要为胆汁酸的转运体,介导胆汁酸的代谢和排泄,以及药物的转运清除[22]。除了经典的解毒作用外,PXR在机体糖脂代谢、类固醇激素稳态,胆酸和胆汁酸代谢、炎症反应[3]、天然免疫[2,23]以及肿瘤发生发展、化疗耐药性[24]中均发挥生理作用。
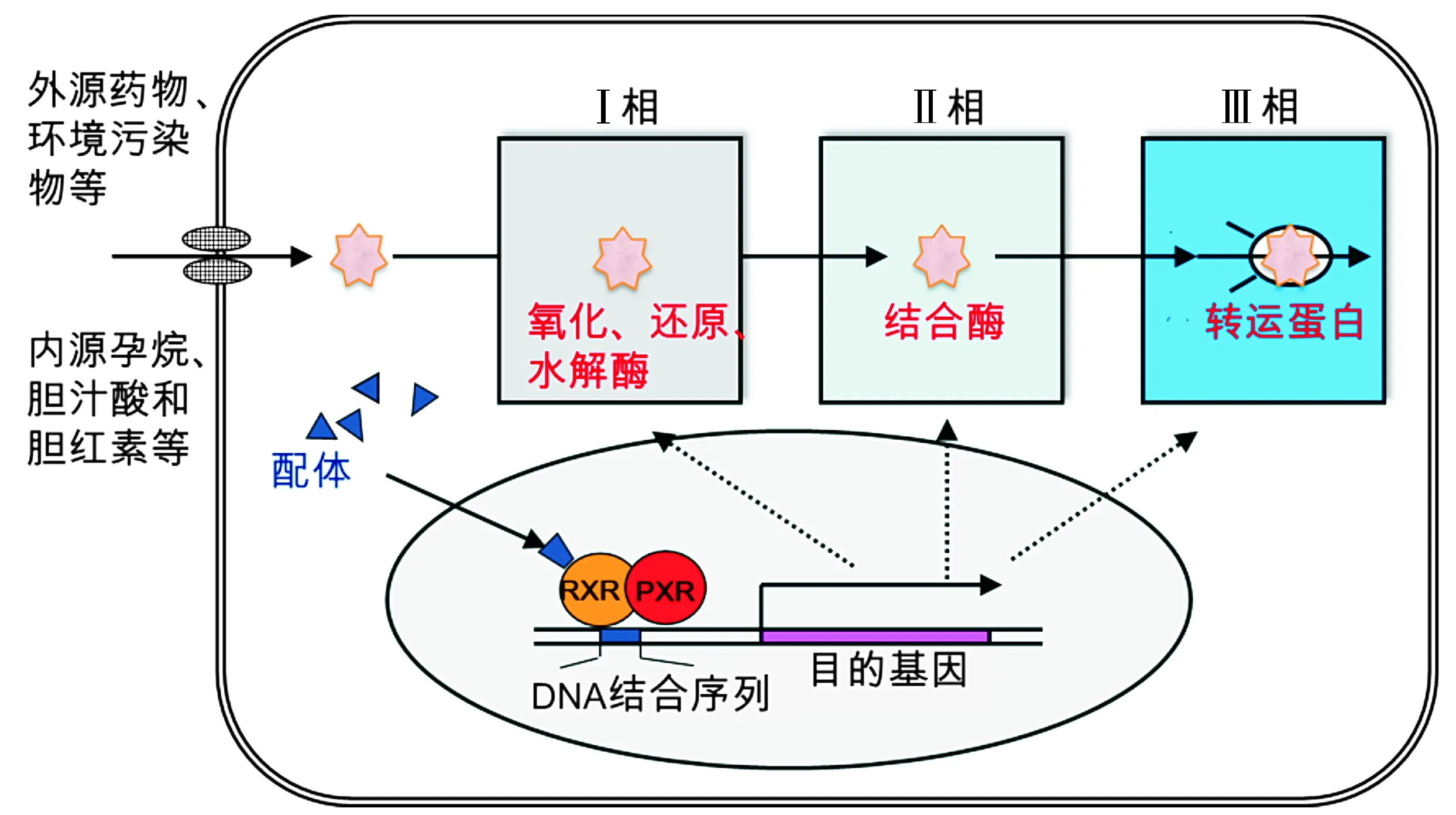
当配体(内外源异物)与PXR结合后,PXR易位到细胞核中,构象发生改变并与维甲酸X受体(retinoid X receptor,RXR)形成异源二聚体,进而与目的基因的启动子区的DNA反应元件(PXR responsive elements,PXREs)结合调控其转录。PXR调控的下游靶基因主要为Ⅰ/Ⅱ相的药物代谢酶和转运蛋白图2 孕烷X受体(PXR)结构以及调控的下游靶基因
2 PXR在肿瘤中的作用
PXR不但表达于多种正常组织,在许多癌症组织也有表达,包括乳腺癌、结肠癌、子宫内膜癌、卵巢癌、前列腺癌、肝癌、骨肉瘤以及食管癌等[25-27]。临床多种化疗药物(紫杉醇、顺铂、伊立替康、他莫昔芬以及长春花碱等)都可激活核受体PXR,上调多种药物代谢酶和转运蛋白的表达进而影响肿瘤化疗的耐药性,因此,PXR介导的多药耐药性(MDR)已经是临床化疗中需要迫切解决的问题[28,29]。除此外,PXR还可以通过调控细胞增殖/抗增殖、促凋亡/抗凋亡、炎症和氧化应激等相关蛋白影响肿瘤的生长、增殖和迁移[29,30],接下来我们对PXR在多种癌症中的作用作简单介绍。
2.1 PXR在乳腺癌中的作用
研究表明PXR在乳腺癌中有潜在的临床相关性,在对非裔美国和南印度乳腺癌患者的研究中发现PXR的单核苷酸多态性(single nucleotide polymorphism,SNPs)与乳腺癌的易感性相关,其中SNPs rs6785049和rs1054191可降低乳腺癌的易感性,而PXR 3′非翻译区(untranslated regions,UTR)的SNPs rs3732360、rs1054190和rs1054191可影响miRNA介导的PXR转录后调控,最终影响乳腺癌发病机制、阿霉素治疗及心脏病理学改变[31,32]。PXR在人乳腺癌组织或多种癌细胞与正常乳腺组织或细胞相比,均有差异表达,如Dotzlaw等[33]检测到PXR在人正常乳腺组织和乳腺癌组织中有表达,而Meyer等[34]则发现乳腺癌组织与癌旁组织相比,PXR以及有机阴离子转运多肽1A2(organic anion-transporting polypeptide 1A2,OATP1A2)的mRNA表达显著升高。Miki等[25]在癌组织中检测到PXR,但在非癌细胞和基质细胞中没有检测到PXR,利福平激活癌组织中PXR上调靶基因(OATP1A2和CYP3A4)的表达,PXR、OATP1A2与乳腺癌分级呈正相关,证实PXR在人乳腺组织中的表达与细胞环境密切相关。大量研究表明,PXR活化与乳腺癌耐药性密切相关,Qiao等[35]发现在人乳腺癌细胞株MCF-7和MDA-MB-231中,PXR激动剂SR12813上调PXR以及下游靶基因MDR1和乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)的表达,进而增强乳腺癌细胞对化疗药物的耐药性,Xu等[36]发现,抗肿瘤药多柔比星和紫杉醇在乳腺癌细胞株MCF-7的耐药性与PXR和NF-κB通路相关,Conde等[37]发现他莫昔芬在高表达PXR的乳腺癌组织中耐药性增强,甚至促进肿瘤细胞生长。Honorat等[38]则证实在MCF-7细胞中PXR活化可下调乳腺癌耐药蛋白三磷酸腺苷结合转运蛋白G超家族成员2(ATP-binding cassette superfamily G member 2,ABCG2)的表达,增加化疗药物敏感性。这些结果表明,PXR及其靶基因可能是乳腺癌化疗耐药性中的一个重要靶点。此外,PXR在人的乳腺癌细胞系也可通过多种机制诱导细胞增殖或凋亡。王少兰等[39]发现,PXR在人乳腺癌细胞MCF-7可能通过上调miRNA21负调控抑癌基因程序性死亡因子4(programmed cell death 4,PDCD4)的表达,抑制乳腺癌细胞的凋亡。PXR激动剂利福平可以浓度和时间依赖性地诱导乳腺癌组织中OATP-1A2的表达,最终促进乳腺癌细胞的增殖[34]。Verma等[40]在人乳腺癌细胞株MCF-7和ZR-75-1中发现,PXR活化也可以通过NO依赖的途径上调p53的表达,进而上调促凋亡因子p21、PUMA、BAK等的表达,诱导乳腺癌细胞的凋亡,PXR对乳腺癌细胞凋亡的调控作用可能和性激素的表达水平及PXR对NO诱导作用的强弱有关,具有一定的组织特异性。综上,PXR通过调控药物耐药、药物转运,增殖以及凋亡相关因子等机制参与乳腺癌进展,但其作用机制尚未完全阐明,有待深入探讨。
2.2 PXR在前列腺癌中的作用
PXR在人前列腺组织中的表达有差异,在癌组织中的表达显著高于正常组织[41],PXR在人前列腺癌细胞株PC-3、LNCaP、LAPC-4和DU145等均有表达[42]。有学者发现PXR的SNP(rs7643645)与前列腺癌患者特异性抗原水平升高的风险密切相关[43]。PXR在前列腺癌同样参与化疗耐药性,Chen等[44]发现,在前列腺癌细胞系PC-3,PXR激动剂SR12813可使PXR mRNA表达水平显著升高,同时上调靶基因MDR1、CYP3A4的表达,进而增强了PC-3细胞对紫杉醇和长春碱等抗肿瘤药物的耐药性,促进了肿瘤细胞存活。反之,靶向敲除PXR使得紫杉醇和长春碱对前列腺癌的化疗敏感性增强。然而有些学者[41]发现,PXR与CYP3A4高表达又可促进前列腺癌患者的存活率,PXR和CYP3A4的高表达是前列腺癌患者预后良好的有力指标。Zhang等[45]证实利福平刺激前列腺癌细胞LAPC-4可以抑制雄激素依赖性的癌细胞生长,并且抑制作用依赖于PXR。Fredericks等[46]在去势抵抗性前列腺癌(CPRC)中发现了抑癌蛋白TERE1与PXR的相关作用,他们发现50%的原发性和转移性前列腺癌标本中TERE1表达缺失,TERE1的缺失会使维生素K2水平下调,最终导致PXR下游参与胆固醇外排和类固醇代谢的基因转录表达降低。在CPRC细胞模型LNCaP-C81细胞株中同样缺乏TERE1,也降低了PXR以及下游胆固醇代谢相关基因的表达,最终促进肿瘤进展。
2.3 PXR在卵巢癌中的作用
PXR在人卵巢癌组织中也有表达,且在SKOV-3、CaOV-3、OVCAR-3和OVCAR-8等人卵巢癌细胞株高表达[47]。Yue等[48]通过观察卵巢癌患者的现状和临床结局,发现PXR蛋白阳性表达率与卵巢癌患者呈负相关,提示PXR可以作为确定卵巢癌患者肿瘤复发率或死亡率的有效标记物。有临床证据表明PXR在卵巢癌侵袭性和耐药性中均起着作用。研究发现抗肿瘤药紫杉醇和顺铂可以激活CaOV-3细胞内PXR上调MDR1的表达,进而促进了细胞增殖[49]。在SKOV-3细胞中,利福平激活PXR促进CYP2B6、CYP3A4和UGT1A1的表达,诱导细胞对紫杉醇、苦皮松和SN-38等抗癌药产生耐药性,最终促进体外培养的SKOV-3细胞增殖和体内异种移植的SKOV-3细胞的增殖[47]。这些结果表明PXR活化既能诱导卵巢癌细胞的肿瘤生长也能增强其化疗耐药性。
2.4 PXR在子宫内膜癌中的作用
Masuyama等[50]发现PXR在正常子宫内膜没有表达,但在子宫内膜癌组织中有表达。随后发现在人子宫内膜癌细胞HEC-1中,沉默PXR,抗肿瘤药紫杉醇和顺铂无法诱导CYP3A4和MDR1蛋白水平升高,进而使得肿瘤细胞的增殖明显抑制以及凋亡作用增强[51]。反之,PXR过度表达降低了紫杉醇或顺铂对HEC-1细胞生长抑制和凋亡作用。
2.5 PXR在宫颈癌中的作用
PXR在宫颈癌细胞株CaSki、HeLa以及宫颈癌组织样本中均有表达,且在癌组织中的PXR的表达低于正常组织[52]。PXR激活不仅使CaSki和HeLa细胞阻滞在G2/M期,抑制增殖和集落形成,还导致裸鼠CaSki和HeLa异种移植瘤生长的减弱。PXR介导的G2/M细胞周期阻滞伴随着泛素连接酶cullin-3和有丝分裂阻滞缺陷2样蛋白1(mitotic spindle assembly checkpoint protein MAD2A,MAD2L1)的上调,以及ANAPC2(anaphase promoting complex subunit 2)和重组周期蛋白依赖蛋白激酶抑制剂1(CDKN1A)的下调,这些均证明PXR在宫颈癌中会抑制细胞增殖[52]。
2.6 PXR在肝癌中的作用
PXR在肝癌中起着错综复杂的作用,首先,PXR在肝癌介导多种化疗药物的耐药性,如抗肿瘤药物索拉非尼能激活原发性肝癌细胞系(HCC)PXR上调CYP3A4和P-糖蛋白(P-glycoprotein,P-gp)的表达,增强其化疗耐药性[53]。大豆中的植物雌激素染料木素会激活PXR上调HepG2细胞内P-gp和MRP2的表达,进而介导索拉非尼的耐药性[54]。ETS-1是肝癌细胞转移的主要调节因子,影响肝癌患者化疗的预后,Shao等[55]发现ETS-1在HCC细胞能直接与PXR结合,增强其转录活性,进而诱导下游多药耐药基因的表达,增强了索拉非尼的化疗耐药性。Bhagyaraj等[56]发现TGF-β通过与其受体结合启动下游SMAD-非依赖的ERK通路激活ETS-1转录因子,最终促进PXR的表达进而参与肝癌细胞的化疗耐药性。Ekins等[57]采用人肝癌HepaG2细胞株、人原代肝细胞及PXR基因敲除小鼠等模型,证实抗真菌药酮康唑可通过阻断AF-2活化区抑制PXR活性,从而逆转利福平诱导的紫杉醇代谢加快,使其血药浓度显著升高,最终起到抗肿瘤作用。其次,PXR也能通过调控增殖、凋亡相关因子参与肝癌进展,Zucchini等[58]证实PXR活化能直接抑制肿瘤细胞凋亡,HepG2细胞过表达PXR可以促进Bcl-2和Bcl-xL等抗凋亡因子的表达,抑制Fas途径诱导的细胞凋亡,最终发挥其抗凋亡作用。肝癌细胞株HepG2和Hep3B过表达PXR可以促进抗凋亡基因Bcl-2和Bcl-xL的表达,下调细胞周期因子周期蛋白依赖性激酶2和4(cyclin-dependent kinases,CDK2和CDK4)的表达,抑制细胞增殖并提高细胞存活率[26]。Azuma等[59]发现HCC过表达PXR后,细胞增殖迁移速度显著降低,同时给予维生素K2刺激后,细胞增殖降低更为明显,证明维生素K2通过PXR抑制肝癌细胞增殖。王少兰等[60]发现PXR在HepG2细胞激活,可上调抑癌基因PDCD4的表达,进而促进HepG2细胞的凋亡。最后,PXR也可通过调控炎症反应参与肝癌进展,Ye等[61]发现利福平激活HepG2细胞内PXR可以抑制LPS诱导的NF-κB活化起到抗炎作用,此外PXR活化可以拮抗LPS-诱导的细胞增殖标记物Ki67的表达,使HepG2阻滞在G0/G1期,起到抗增殖作用。Kotiya等[26]证实,PXR及其下游Ⅰ和Ⅱ药物代谢酶Cyp3a11和Gsta2在二乙基亚硝胺(DEN)诱导的小鼠肝癌组织的表达较正常小鼠肝组织显著降低,同时炎症因子IL-6、SATA3、TNF-α和P65的表达均显著升高,经皮尔逊相关分析发现IL-6、TNF-α、P65与PXR、Cyp3a11在肝癌组织的表达呈负相关。总体而言,PXR在肝癌组织除了介导耐药性外,还可能起保护作用。
2.7 PXR在结肠癌或结直肠癌中的作用
PXR在结肠癌生长、侵袭、迁移和化疗耐药中起着作用。Liu等[62]发现在LS174T细胞,多种中草药化合物均可激活PXR,上调下游DME(drug metablic enzyme),DME和耐药蛋白的表达影响化疗疗效。尼罗替尼和吉非替尼等酪氨酸激酶抑制剂也能激活PXR诱导LS180细胞MDR1蛋白的表达[63]。Raynal等[64]证实PXR的表达水平与结直肠癌细胞对伊立替康及其代谢产物SN38的耐药性正相关,PXR可以促进SN38的葡萄糖醛化,转变为无活性的SN38,促进其耐药性。在HT-29结肠癌细胞中发现苦瓜提取物可抑制PXR降低PXR靶蛋白MDR1、MRP2和BCRP的表达,进而增强细胞对阿霉素敏感性[65]。Jiang等[66]发现经PXR激动剂利福平预处理的人结肠癌细胞系LS147T,再给予5-氟尿嘧啶和奥沙利铂联合用药对肿瘤细胞的毒性显著降低,其存活率明显上升。以上均证实PXR在结肠癌细胞中与化疗耐药和敏感相关密切。其次,PXR也能调控结肠癌细胞增殖和凋亡,结肠癌细胞中异位表达PXR后会诱导P21的转录和E2F1的消融,使细胞周期阻滞在G0/G1,最终抑制癌细胞的增殖和致瘤性[67,68]。Wang等[27]证实,在人结肠癌细胞株LS174T中PXR活化会诱导成纤维生长因子(fibroblast growth factor 19,FGF19)的表达,导致癌细胞增殖、迁移和转移,而在正常的组织PXR活化并不能激活FGF19。然而,也有报道称PXR在结肠癌中的表达丢失或减少,PXR的过度表达则会抑制人结肠癌HT29细胞的增殖[69]。在人结肠癌细胞中,PXR活化会上调抗凋亡基因BAG3(Bcl-2 associated athanogene 3)、BIRC2(baculoviral IAP repeat-containing protein 2)、髓细胞白血病基因-1(myeloid cell leukemia-1,MCL-1)、Bcl-2和Bcl-xL等表达,下调促凋亡基因BAK1(BRI1-associated kinase 1)、TP53(tumor protein p53)和Fas等的表达[24,30]发挥抗凋亡作用。最后,PXR还可调控结肠癌氧化应激,PXR激活可使人结肠癌细胞对氧化性外源毒物百草枯的敏感性增强,其致敏作用可能与降低超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)的活性,升高ROS有关,最终影响结肠癌细胞的生长发育[70]。
3 结语与展望
综上,PXR在乳腺癌、前列腺癌、宫颈癌、子宫内膜癌、肝癌和结肠癌等多种癌症中均发挥作用,但是在不同的肿瘤类型中,PXR所发挥的作用具有差异性。这些不同的作用机制可能取决于肿瘤组织的特异性以及所处的环境。因此识别所有的机制对于深入了解PXR在不同肿瘤进展以及化疗耐药或化疗敏感性中的作用至关重要。PXR在多种肿瘤已被作为综合治疗的一个潜在的关键靶点[71],结合肿瘤组织特异性及其发育不同的微环境,筛选适合PXR调节剂可实现肿瘤细胞内PXR的特异表达调控,最终为PXR减少肿瘤的耐药性以及抑制发展进程提供有效治疗思路。
