QuEChERS/超高效液相色谱-串联质谱法检测果酒中14种甲氧基丙烯酸酯类杀菌剂
2021-08-06黄笑晨郭爱静杨莉丽
黄笑晨,李 昆,李 朔,郭爱静,王 可,*,杨莉丽
(1.河北师范大学 化学与材料科学学院,河北 石家庄 050024;2.石家庄市疾病预防控制中心 石家庄市化学毒物检测及风险预警技术创新中心,河北 石家庄 050011)
甲氧基丙烯酸酯类杀菌剂是一类以天然抗生素Strobilurin A为先导化合物开发的新型杀菌剂,其通过抑制细胞色素b和细胞色素C1之间的电子传递,阻碍菌类的线粒体呼吸,抑制三磷酸腺苷(ATP)生成,从而达到杀菌作用[1-2]。该类杀菌剂能有效防治子囊菌、担子菌、半知菌和卵菌等真菌引起的病害,因具有低毒、广谱、高效等特点,被广泛应用于现代农业生产中[3]。自1996年上市以来,甲氧基丙烯酸酯类杀菌剂已开发了十几个品种,并于2014年以37.43亿美元的销售额成为全球第一大杀菌剂[4]。然而研究表明,嘧菌酯、啶氧菌酯和氟嘧菌酯在施药后易进入土壤中沉积,不易降解,对土壤生态环境造成潜在威胁[5-7]。该类杀菌剂还可通过地表径流、渗透作用等对水体环境造成污染,导致水生生物繁殖力下降并有致畸性[8-11]。因此,该类杀菌剂对人体健康的潜在危害不容忽视。
在果蔬的生产过程中,常施用大量杀菌剂保证产量和品质,杀菌剂残留不可避免地会对果蔬制品(如果酒)造成污染,进而通过人们的摄入在体内累积,对人类健康产生不良影响。目前,该类杀菌剂的研究对象多见于果蔬、水体和土壤等,关于果酒中多种甲氧基丙烯酸酯类杀菌剂的残留分析鲜有报道。因此建立果酒中多种甲氧基丙烯酸酯类杀菌剂的快速、高效的检测方法,对于保障食品质量安全和人民身体健康具有重要意义。
甲氧基丙烯酸酯类杀菌剂的检测方法主要有气相色谱法(GC)[12]、气相色谱-串联质谱法(GCMS/MS)[13]、高效液相色谱法(HPLC)[14]、液相色谱-串联质谱法(LC-MS/MS)[15-17]。其中,LC-MS/MS法由于具有定性准确、灵敏度高、抗干扰能力强等特点,提升了复杂基质中农药多残留分析的能力,被广泛应用于农兽药的残留检测。王岩松等[18]利用LC-MS/MS法测定了葡萄酒中10种甲氧基丙烯酸酯类杀菌剂,但该法采用固相萃取净化,操作较繁琐,耗时较长。本研究采用QuEChERS结合超高效液相色谱-串联质谱(UPLC-MS/MS)建立了同时测定果酒中14种甲氧基丙烯酸酯类杀菌剂的检测方法。该方法操作简便、高效快速、灵敏度高,为果酒中该类杀菌剂的残留检测提供了技术手段。
1 实验部分
1.1 仪器与试剂
Exion-TRIPLE QUAD 5500型超高效液相色谱串联质谱仪(美国AB SCIEX公司);AE240电子天平(瑞士Mettler Toledo公司);Milli-Q超纯水机(美国Millipore公司);C3 I型台式离心机(法国JOUAN公司);T-460/H超声清洗器(德国Elma公司);EVAP-12型氮吹仪(美国Organomation公司);MS2型涡旋振荡器(德国IKA公司)。
吡唑醚菌酯、氟嘧菌酯、嘧菌酯、嘧菌胺、烯肟菌酯(100μg/mL,纯度99.0%,北京曼哈格生物科技有限公司);醚菌胺、肟醚菌胺、醚菌酯、啶氧菌酯、Z-苯氧菌胺、E-苯氧菌胺(100μg/mL,纯度99.0%,天津阿尔塔科技有限公司);肟菌酯、烯酰吗啉、嘧霉胺(纯度>99.0%,Dr.Ehrenstorfer GmbH公司)。甲醇(美国Fisher公司)、乙腈(美国Sigma-Aldrich公司)均为色谱纯;N-丙基乙二胺(PSA)、石墨化碳黑(GCB)(美国Dikma公司);C18(40~50μm,美国Welch公司);无水硫酸镁、氯化钠(分析纯,天津永大化学试剂有限公司);实验用水为Milli-Q超纯水。果酒样品(葡萄酒、柚子酒、石榴酒等)购自石家庄市内超市。
1.2 标准溶液的配制
取适量各标准溶液,用乙腈定容至10 mL棕色玻璃瓶中,得到1 mg/L的混合标准储备溶液,避光储存于-20℃冰箱中。用乙腈逐级稀释混合标准储备溶液,配制0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0μg/L的系列混合标准工作溶液。
1.3 样品前处理
称取4 g果酒样品(精确至0.01 g)于50 mL离心管中,加入8 mL乙腈,涡旋提取60 s,然后加入0.5 g NaCl,涡旋混匀,以4 000 r/min离心5 min,取6 mL上清液加入到含有200 mg C18和600 mg无水MgSO4的15 mL离心管中,涡旋混匀后以8 000 r/min离心5 min。吸取4 mL上清液,在45℃下氮吹浓缩近干,再用1 mL乙腈溶解残渣,过0.2μm滤膜上机检测。
1.4 仪器条件
1.4.1 色谱条件 色谱柱:Phenomenex Kinetex F5(3.0 mm×100 mm,2.6μm);流动相:A为水,B为乙腈;流速:0.3 mL/min;进样量:3μL;柱温:40℃。梯度洗脱程序:0~4 min,45%B;4~4.1 min,45%~55%B;4.1~5.0 min,55%B;5.0~5.1 min,55%~65%B;5.1~9.5 min,65%B;9.5~9.6 min,65%~45%B;9.6~13.0 min,45%B。
1.4.2 质谱条件 离子源:电喷雾离子源(ESI),正离子扫描模式;监测模式:多反应监测(MRM);离子源电压:5 500 V;离子源温度:500℃;气帘气(N2)压力:275.8 kPa;雾化气(N2)压力:344.75 kPa;辅助加热气(N2)压力:344.75 kPa。14种杀菌剂的质谱参数见表1。

表1 14种杀菌剂的色谱保留时间与质谱参数Table 1 Retention times and mass spectrometric parameters of 14 fungicides
2 结果与讨论
2.1 质谱参数的优化
分别配制50 ng/mL的14种甲氧基丙烯酸酯类杀菌剂标准溶液,采用针泵恒流进样,在正离子模式下,首先利用全扫描模式(Q1 MS)寻找目标物的母离子;然后对母离子进行产物离子扫描(Product ion,MS2),选择2个响应信号较强的碎片离子(其中响应值高的作为定量离子,另1个选为定性离子);再将母离子和这2个碎片离子组成检测离子对,在MRM模式下对每个化合物的去簇电压(DP)和碰撞能(CE)进行优化,14种化合物的质谱参数见表1。
2.2 色谱条件的优化
考察了乙腈-水和甲醇-水分别为流动相对14种甲氧基丙烯酸酯类杀菌剂分离效果的影响。结果显示,乙腈-水作为流动相时的灵敏度高于甲醇-水,峰形较好,响应值高,且分离效果好。以乙腈为有机相,进一步考察了分别以纯水、0.1%甲酸水溶液、含2 mmol/L乙酸铵的0.1%甲酸水溶液为水相时的分离效果,发现加入甲酸后14种杀菌剂的峰形虽有改善,但多数化合物的响应受到抑制,此外加入乙酸铵对分离效果的影响较小。综上,最终选择乙腈-水为流动相,14种杀菌剂标准溶液(50μg/L)的总离子流色谱图见图1。

图1 14种杀菌剂标准溶液(50μg/L)的总离子流色谱图Fig.1 Total ion current chromatogram of the 14 fun⁃gicide standard solution(50μg/L)1.Z-metominostrobin;2.E-metominostrobin;3.dimetho⁃morph;4.pyrimethanil;5.orysastrobin;6.azoxystrobin;7.mepanipyrim;8.dimoxystrobin;9.fluoxastrobin;10.kresoxim-methyl;11.picoxystrobin;12.pyraclostrobin;13.trifloxystrobin;14.enestroburin
2.3 样品前处理条件的优化
2.3.1 提取条件的优化 根据14种杀菌剂的结构和理化性质,考察了乙腈、二氯甲烷、丙酮、乙酸乙酯、石油醚作为提取溶剂时的提取效果。结果表明,以乙腈为提取溶剂时14种杀菌剂的回收率为68%~95%;丙酮、乙酸乙酯和石油醚的提取效果较差,14种杀菌剂的回收率普遍在75%以下;二氯甲烷的密度较大,分层后有机相在下层,不易吸取,且14种杀菌剂的回收率(63%~93%)略低于乙腈,故选择乙腈作为提取溶剂。向一定量的空白样品(加标水平为10μg/kg)中分别加入6、8、10、12、14 mL的乙腈,考察了乙腈用量对加标回收率的影响。结果显示:当乙腈用量为8 mL时,14种杀菌剂的回收率较好,均在65%以上;虽然乙腈用量为14 mL的回收率略好于8 mL时,为节约试剂,最终选择8 mL乙腈作为提取溶剂。通过比较样品经超声提取和涡旋提取的效果,发现涡旋提取的效果优于超声提取。进一步对涡旋时间(30、60、90 s)进行比较,发现涡旋提取60 s时14种杀菌剂的回收率最好,因此实验选择涡旋提取时间为60 s。
2.3.2 净化条件的优化 QuEChERS方法的净化填料主要包括无水MgSO4、Na2SO4、C18、PSA和GCB等,其中无水MgSO4和Na2SO4为常见的吸水剂。PSA(去除基质中的脂肪酸、有机酸、碳水化合物和少量色素等)、C18(去除非极性和脂肪性物质)、GCB(去除色素、甾醇类和非极性干扰物)为常见的吸附剂[19]。分别比较了单独使用PSA、C18、GCB、无水MgSO4以及PSA+无水MgSO4、C18+无水MgSO4、PSA+C18+无水MgSO4组合使用情况下的净化效果。实验发现,GCB对果酒中色素的去除效果较好,但对待测化合物的吸附较为严重。由图2可知,PSA的净化效果比C18差,而C18+无水MgSO4对14种杀菌剂的回收率较其他条件下更好,最终确定C18+无水MgSO4作为净化剂。

图2 不同净化剂对14种杀菌剂回收率的影响Fig.2 Effect of different purificants on the recoveries of 14 fungicides
进一步对净化剂的用量进行优化,首先固定无水MgSO4的用量为300 mg,考察了C18用量(100、200、300、400 mg)对净化效果的影响,结果表明C18用量为200 mg时的净化效果最好,14种杀菌剂的回收率为71.0%~107%。固定C18用量为200 mg,考察了无水MgSO4用量(300、400、500、600、700 mg)对净化效果的影响,发现随着无水MgSO4用量的增加,14种杀菌剂的回收率不断提高,但当无水MgSO4的用量超过600 mg时,回收率开始下降,故选择200 mg C18+600 mg无水MgSO4作为净化剂。与文献采用的固相萃取法[18]相比,本文优化后的QuEChERS法不仅简便,且各杀菌剂的回收率较好,均在75%以上。
2.4 基质效应
基质效应(Matrix effect,ME)是指基质成分和目标分析物以外的其他成分对待测物测定值的影响,使用ESI检测时,基质主要影响目标化合物的离子化,使其响应信号增强或减弱,从而形成基质增强或抑制效应。采用同一质量浓度待测物在基质溶液与溶剂中峰面积的比值评价基质效应[20-21],ME越接近100%,表明基质效应越小。将空白样品按“1.3”方法处理得到基质提取溶液,比较了质量浓度分别为10、20、50μg/L情况下14种杀菌剂在果酒基质中的基质效应,14种杀菌剂的ME为80.6%~119%,表明基质效应较小可忽略,所以采用溶剂标准曲线进行定量分析。与文献方法[18]相比,本方法消除了氟嘧菌酯和醚菌胺的基质效应,对果酒基质的净化效果更好。
2.5 线性范围、检出限与定量下限
按“1.2”方法配制质量浓度为0.1~100.0μg/L的混合标准工作溶液,在优化条件下进行测定,以标准溶液的质量浓度(x,μg/L)为横坐标,目标物的峰面积(y)为纵坐标,得到相应的线性方程,再分别以3倍信噪比(S/N=3)确定检出限(LOD),以S/N=10确定定量下限(LOQ)。结果显示,14种杀菌剂在各自的质量浓度范围内线性关系良好,相关系数(r2)均大于0.999,LOD和LOQ分别为0.002~0.723μg/kg和0.006~2.409μg/kg(表2)。
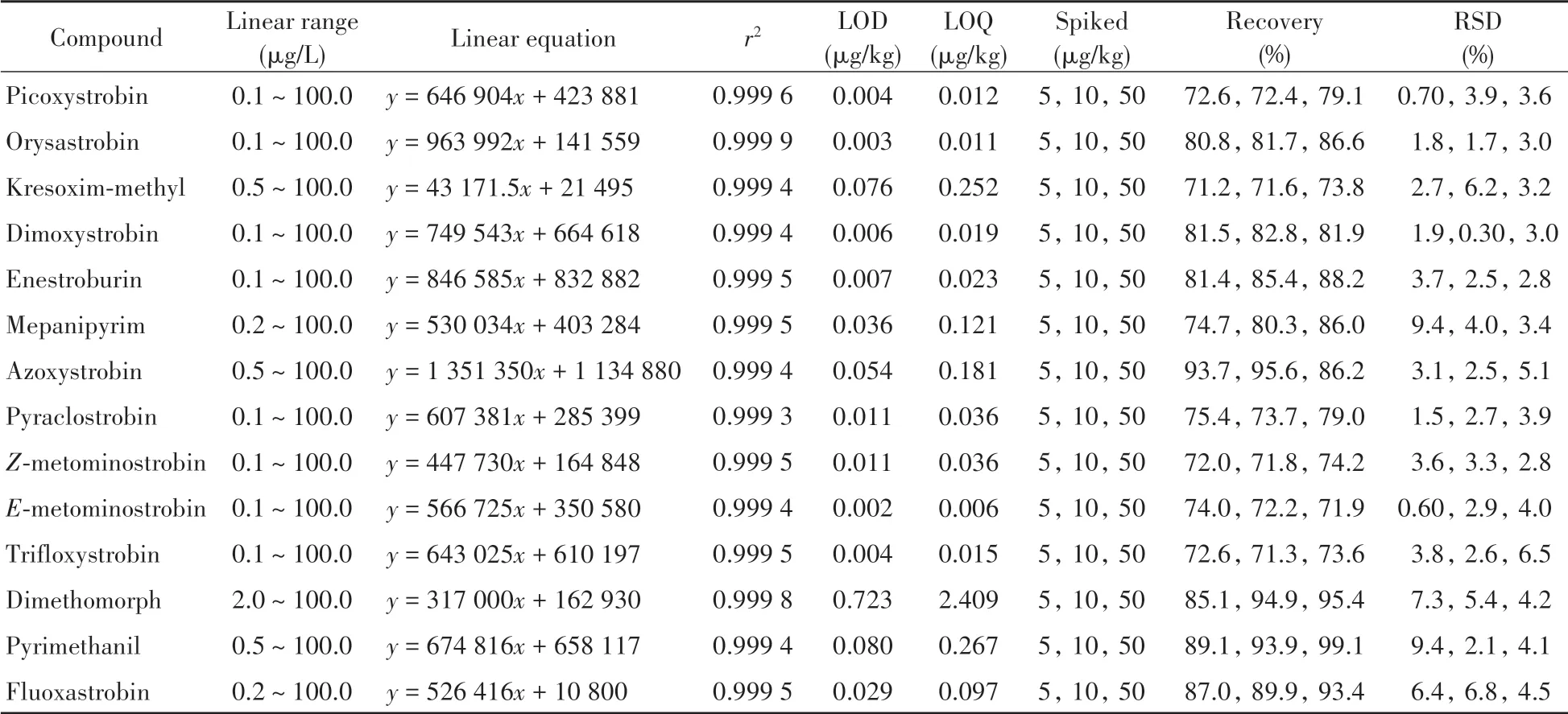
表2 果酒中14种杀菌剂的线性关系、检出限、定量下限、回收率及相对标准偏差Table 2 Linear relations,LODs,LOQs,recoveries and RSDs of 14 fungicides in fruit wines
2.6 回收率与相对标准偏差
取空白果酒样品,分别在5、10、50μg/kg 3个浓度水平下进行加标回收实验,每个水平平行测定7次,按照本方法进行测定。结果显示,14种杀菌剂的平均回收率为71.2%~99.1%,相对标准偏差(RSD)为0.30%~9.4%(见表2)。
2.7 实际样品测定
采用本方法对市售的7份葡萄酒和8份水果酒样品进行检测,其中有6份样品检出烯酰吗啉,5份样品检出嘧霉胺,2份样品检出嘧菌酯(见表3)。目前,《GB 2763-2019》[22]尚未对果酒中该类杀菌剂的限量进行要求,故参照其在对应水果中的限量要求(烯酰吗啉:葡萄为5 mg/kg;嘧霉胺:葡萄、桃为4 mg/kg,柚子为7 mg/kg;嘧菌酯:葡萄为5 mg/kg),所测样品的检出值均小于国家限量标准。表明本方法适用于果酒中14种甲氧基丙烯酸酯类杀菌剂的残留检测。

表3 实际样品的检测结果Table 3 Test results of real samples
3 结 论
本研究建立了同时检测果酒中14种甲氧基丙烯酸酯类杀菌剂的UPLC-MS/MS方法。实验对质谱条件、色谱条件和样品前处理条件进行了优化,并考察了基质效应的影响。结果表明,该方法操作简便、灵敏度高、精密度好、线性关系良好,适用于果酒中14种甲氧基丙烯酸酯类杀菌剂的残留检测。
