全二维气相色谱-飞行时间质谱测定PBAT生物降解膜中挥发性有机物
2021-08-06高维常刘艳霞李洪勋周淑平陈文生
崔 欢,高维常,刘艳霞,李洪勋,周淑平,陈文生,蔡 凯*
(1.贵州师范大学 贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 550001;
2.贵州省烟草科学研究院,贵州 贵阳 550081)
近年来,塑料残留污染所带来的安全性问题备受关注,由聚乙烯、聚丙烯为原料人工合成的传统农用地膜很难在自然条件下降解,并以碎片的形式长时间存在于环境中。地膜长期残留会造成土壤板结,影响作物根系的生长发育,导致农作物减产等问题[1]。高分子聚合物聚己二酸-对苯二甲酸丁二酯(PBAT)生物降解膜是一种能在1~2个植物生长周期内完全被微生物降解的新型地膜,是一种能从源头上攻克聚乙烯或聚丙烯残膜污染的技术,在农业生产中具有广泛的应用前景[2]。虽然PBAT纯料的化学结构(如图1)中无毒性单元,且表现出环境无毒性,但在PBAT生物降解膜生产过程中,不可避免地存在不同程度的溶剂或挥发性物质添加,可在较低温度下释放到空气中,从而产生较大气味,威胁环境和人类健康[3]。因此,有必要建立PBAT生物降解膜中挥发性有机物(VOCs)的组成与含量的分析方法。
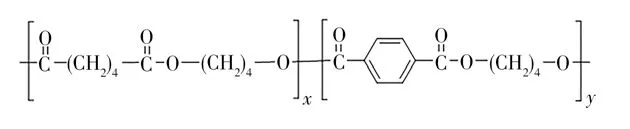
图1 PBAT的结构式Fig.1 Chemical structure of PBAT
传统塑料中VOCs定性与定量分析主要采用液-液萃取(LLE)、固相萃取(SPE)、顶空固相微萃取(HS-SPME)等前处理方法[4-5],其中HS-SPME集采样、萃取、浓缩和进样于一体,具有处理时间短,样品用量小,操作可自动化,无需有机溶剂等优点,被应用到越来越多的分析领域[6-8]。目前,塑料中VOCs的检测方法主要有气相色谱法(GC)[9]及气相色谱-质谱联用法(GC-MS)[10],但这些方法检测复杂基质时通常会出现严重的峰重叠,且灵敏度低,可检测物质偏少。全二维气相色谱-飞行时间质谱(GC×GC-TOF MS)技术的出现极大地提高了样品分离度,且能够获得化合物碎片离子的精确质量和结构信息[11]。基于此,本研究利用HS-SPME结合GC×GC-TOF MS测定了PBAT生物降解膜中的55种主要VOCs(包括苯系物21种、萘类11种、醛酮类8种、醇类4种、酯类3种、茚类2种、胺类2种、酚类1种、其它类3种),并分析了不同PBAT生物降解膜中VOCs的差异。
1 实验部分
1.1 仪器与试剂
GC×GC-TOF MS由Agilent 7890A气相系统、Zoex Zx-1环形调制器(美国Zoex公司)、Zoex Fas-TOF高分辨飞行时间质谱(美国Zoex公司)以及多功能自动进样器(瑞士CTC公司)组成;固相微萃取仪(美国Supelco公司);固相微萃取纤维头:聚二甲基硅氧烷-二乙烯基苯(PDMS-DVB)、聚二甲基硅氧烷-二乙烯基苯-碳分子筛羧乙基(PDMS-DVB-CAR)、聚二甲基硅氧烷-碳分子筛羧乙基(PDMS-CAR)、聚丙烯酸酯(PA)、聚乙二醇(PEG)(美国Supelco公司)。乙腈(色谱纯)及内标乙酸苯乙酯(纯度>98%)均购于Sigma公司。
1.2 标准溶液配制
精确称取22.9 mg乙酸苯乙酯,用乙腈溶解并定容至100 mL容量瓶中,稀释10倍得22.9μg/mL乙酸苯乙酯溶液,置于4℃冰箱保存,备用。
1.3 样品前处理
将PBAT生物降解膜粉碎至2 mm×2 mm碎片,精确称取50.0 mg于22 mL顶空样品瓶中,加入1μL乙酸苯乙酯内标,密封后用多功能自动进样器在80℃平衡10 min进行顶空固相微萃取,以固相微萃取纤维头(PDMS-DVB-CAR)顶空吸附40 min,萃取完毕后在260℃解吸3 min,待分析。
1.4 全二维气相色谱-飞行时间质谱条件
色谱条件:一维柱为DB-5MS石英毛细管柱(30 m×0.25 mm,1.0μm),二维柱为BP-50石英毛细管柱(1.5 m×0.1 mm,0.1μm);程序升温:初始温度60℃,保持2 min,以3℃/min升至240℃,保持1 min;进样口压力:初始压力0.207 MPa,保持2 min,以2.07 kPa/min升至0.331 MPa,保持1 min;样品运行时间:63 min;进样口温度:260℃;进样模式:不分流进样;吹扫时间:3.5 min;调制周期:7 s;持续周期:300 ms;热喷口温度:370℃;冷喷口流速:18 L/min;热喷口压力:0.275 MPa。
质谱条件:EI电离源,电离电压:70 eV;离子源温度:280℃;传输线温度:300℃;质量扫描范围m/z50~500;分辨率:4 000,FWHM(半峰全宽);采集频率:100 Hz。谱图采用GC Image软件分析,通过NIST17谱库检索并结合目标物的准确分子量、特征离子碎片峰对VOCs进行鉴定,采用乙酸苯乙酯按照校正因子F=1进行内标法相对定量。
2 结果与讨论
2.1 HS-SPME条件优化
2.1.1 萃取纤维头的优化 固相微萃取纤维头是影响HS-SPME萃取效率的重要因素之一[12]。实验考察了不同类型5种萃取纤维头(PDMS-DVB、PDMS-DVB-CAR、PDMS-CAR、PA、PEG)对萃取效率的影响。结果显示,PDMS-DVB-CAR萃取纤维对大部分VOCs具有更高的吸附性,萃取效率最高。这是因为PDMSDVB-CAR为中等极性、高度交联涂层,能兼顾各类化合物,更有利于复杂VOCs的吸附。其余4种涂层对分子的大小、极性强弱各有偏重。其中,PDMS-CAR对烷烃及醛酮类化合物具有较高选择性,PA对酸类和醛酮类化合物具有较高选择性,PDMS-DVB对烷烃、烯烃和醛酮类化合物具有较高选择性,PEG更适用于极性物质的萃取。基于本研究中低极性VOCs种类较多,因此选择综合性更强的PDMS-DVB-CAR为最佳萃取纤维头。
2.1.2 平衡温度的选择 固相微萃取中样品的提取和富集是一个动力学过程,样品中各相分配系数决定萃取效率。在选择平衡温度条件时,温度不宜过高也不宜过低[13],实验考察了平衡温度分别为60、70、80、90℃时对萃取效率的影响。结果显示,PDMS-DVB-CAR随着平衡温度的升高,顶空瓶中蒸气压逐渐增加,顶部空间中VOCs浓度增大,萃取效率明显提高。但由于吸收和吸附均为放热过程,当平衡温度达到90℃时,虽有利于高沸点化合物的蒸发,但同时降低了样品在涂层中的分配,部分挥发性强的物质萃取量反而降低。因此,选取80℃为最佳平衡温度。
2.1.3 平衡时间的选择 目标物从样品中挥发到顶空空间,需一定时间才能达到动态平衡[14],因此实验考察80℃下平衡时间分别为5、10、15、20 min时对PDMS-DVB-CAR萃取效率的影响。结果显示,随着平衡时间从5 min增至10 min,萃取效率明显增加,且平衡时间10 min时的萃取效率最高,继续延长平衡时间达到15 min时,萃取效率呈下降趋势。因此,选取最佳平衡时间为10 min。
2.1.4 萃取时间的选择 目标物在样品溶液、顶空和纤维头涂层三相达到平衡之前,萃取时间会影响分配平衡状态,萃取时间过短,则吸附不完全;萃取时间过长,则吸附组分可能发生解吸。因此选择合理的萃取时间方能达到最佳的萃取效果[15]。实验考察了萃取时间分别为20、30、40、50 min时对萃取效率的影响,结果显示,萃取效率随着萃取时间的延长而逐渐增加,40 min后增幅不明显。因此,选取40 min为最佳萃取时间。
2.2 定性分析
通过目标物的保留时间、正反匹配度、准确分子量,利用NIST17谱库检索确定了PBAT生物降解膜中55种VOCs的组成,其保留时间、匹配度、准确分子量等参数如表1所示。

表1 55种VOCs定性与相关参数Table 1 Qualitative analysis and parameters of 55 VOCs
由表1数据可见,PBAT生物降解膜中共分离鉴定出55种主要VOCs,其正(SI)、反(RSI)匹配因子均在700以上。进一步利用准确质量数来确定元素的组成,以确保VOCs定性的准确度,如4-甲基联苯的理论质量数为168.093 9,实际质量数为168.093 8,质量数偏差仅为0.000 1,表明理论值与实际值具有很好的一致性。55种VOCs中包括苯系物21种、萘类11种、醛酮类8种、醇类4种、酯类3种、茚类2种、胺类2种、酚类1种、其它类3种,其典型色谱图如图2所示,充分体现了GC×GC-TOF MS在分离复杂成分中的优势。以PBAT生物降解膜中典型的VOCs——萘为例,GC×GC分离的二维轮廓图见图3,萘(C10H8)与癸醛(C10H20O)、松油醇(C10H18O)很难在常规一维色谱中达到基线分离,但在GC×GC中具有不同的二维保留时间,分别为2DtR=2.09 s、1.46 s和1.82 s,表明GC×GC能有效分离此3种化合物。因此,对于复杂化合物的分离,特别是同系物与同分异构体,全二维色谱能够达到较好的分离效果,有效解决了VOCs的相互干扰,提高了定性与定量的准确性。

图2 GC×GC-TOF MS鉴定PBAT生物降解膜中VOCs的分析色谱图Fig.2 GC×GC-TOF MS contour plot of VOCs in PBAT biodegradable film sample the peak number(1-55)was the same as that denoted in Table 1
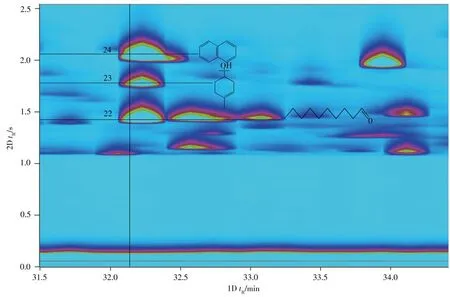
图3 GC×GC-TOF MS分离复杂VOCs的轮廓图Fig.3 GC×GC-TOF MS contour plot of the separating of VOCs 22:decanal;23:terpineol;24:naphthalene
2.3 相对定量及方法学验证
采用内标法以校正因子F=1对PBAT生物降解膜VOCs进行相对定量,对方法的日内(1 d内重复5次)和日间相对标准偏差(RSD,5 d内重复5次)进行考察,结果如表1所示。主要VOCs的日内RSD不高于13%,日间RSD不高于19%。由此可见,方法具有良好的稳定性和可重复性,能较好对不同来源PBAT生物降解膜中的VOCs进行相对含量组成分析。
2.4 实际样品分析
主成分分析(PCA)是一种无监督的模式识别方法,通过对数据进行降维处理后,可从整体上直观显示各组样品的差异[16]。为区分不同来源PBAT生物降解膜中VOCs的差异,采集不同厂家的PBAT生物降解膜(A、B、C与D),利用MetaboAnalyst 4.0对样品中VOCs进行主成分分析(图4A)。结果显示,PC1(主成分1)和PC2(主成分2)分别解释变量方差的51.8%和13.2%,PC1和PC2的累计贡献率为65.0%,可以解释原始变量的部分信息。不同降解膜在PC轴上出现了明显分化,PBAT A+B、PBAT C与PBAT D有明显差异,VOCs差异较大,PBAT A与PBAT B样品重叠,VOCs差异较小,表明该方法可区分不同来源的PBAT生物降解膜。为进一步找出对差异区分有重要贡献的VOCs,选择偏最小二乘判别分析模型变量投影重要度(Variable importance projection,VIP)值大于1.2的变量,结合方差分析Fisher's LSDp值小于等于0.01,获得13种(其中化合物No.28与No.23差异不显著)具有重要贡献的VOCs。对VIP值大于1.2的变量使用热图分析(图4B),发现PBAT C中的VOCs含量普遍偏低;PBAT D中1-甲基萘(No.32)、癸醛(No.22)、邻二甲苯(No.8)、六甲基苯(No.35)、对二甲苯(No.5)、1,3-二甲基-2-乙基苯(No.17)、1,3-二乙基-5-甲基苯(No.20)含量普遍较高,主要为苯系物;PBAT A+B中4,7-二甲基茚满(No.27)、1,2,3,4-四氢-2,5,8-三甲基-萘(No.36)、2-乙基萘(No.40)、2,6-二异丙基苯胺(No.42)、1,7-二甲基萘(No.43)、2,6-二叔丁基对甲苯酚(No.49)等萘、胺、酚类VOCs含量普遍较高。另外,2,6-二异丙基苯氰酸酯常作为封端剂使用,异氰酸酯能与水反应形成胺和二氧化碳,PBAT生物降解膜与一定湿度的空气接触,能对应生成水解产物2,6-二异丙基苯胺,而2,6-二叔丁基对甲苯酚主要作为抗氧化剂使用[17-18]。

图4 PBAT生物降解地膜中VOCs的主成分分析图(A)及其对差异区分有重要贡献的VOCs热图分析(B)Fig.4 PCA scores plot of VOCs from PBAT biodegradable films(A)and heatmap analysis of VOCs with important contribution to differentiation in PBAT biodegradable film(B)
3 结 论
本研究建立了一种HS-SPME结合GC×GC-TOF MS技术测定PBAT生物降解膜中55种VOCs的分析方法,优化了HS-SPME条件,并结合化学计量学分析了VOCs化学成分的变化,区分了不同来源4种PBAT生物降解膜中VOCs的差异。方法前处理简单、灵敏度高、分离能力强,可用于PBAT生物降解膜中VOCs的安全评价。
