外源植物激素对白枪杆幼苗生物量分配的影响
2021-08-05段华超郑鑫华李燕燕井卉竹
段华超,郑鑫华,李燕燕,叶 澜,井卉竹,董 琼
(西南林业大学 西南山地森林资源保育与利用教育部重点实验室,昆明 650224)
生物量是植物生物学特征和功能性状的基础之一,是植物的物质积累状况及对环境资源利用能力的体现[1]。在植物个体生长发育过程中,根、茎、叶等器官对环境中有限的资源配置存在分配权衡,其对植物个体生存、生长与繁殖起着重要作用[2]。这种权衡表现在植物各器官的生物量分配上,反映了植物对环境的适应和生存策略[3]。植物的个体大小、生长环境和种源影响着生物量分配[4]。有关研究表明,当水分和土壤养分受限或改变时,植物各器官之间的生物量分配会发生改变[5]。植物各器官的生物量分配随种源、发育阶段和空间位置的变化而改变[4,6-7]。通过异速生长分析不同环境下同一物种各器官的生长关系,判定植物各器官之间生物量分配方式是否发生了变化,揭示植物生长和生物量分配策略。
白枪杆(FraxinusmalacophyllaHems1)属木犀科(Oleaceae) 梣属(Fraxinus)双子叶植物,落叶小乔木[8]。根据李乡旺等[9]研究,白枪杆属滇东南地区特有种,主要分布于滇东南地区的山原峡谷常绿阔叶次生林中。白枪杆对石漠化山地具有很高的适应性,耐旱耐瘠薄,生长较快,造林成活率高,是石漠化地区植被恢复针阔混交林和其他阔叶混交林常用树种之一[10],在滇东南地区形成了以其为主要树种的针阔混交植被恢复治理模式[11]。白枪杆具有很高的药用价值,能清热降火、治疗癫痫[12],产业化前景高。
外源植物激素又称植物生长调节剂,根据其作用效果可分为生长抑制剂、促进剂和延缓剂三类[13]。外源植物激素在植物生长发育的不同阶段起调节作用,在植物抗逆性方面也起着重要作用[14-15]。玉米素(ZT)是一种最常见的细胞分裂素,该激素在植物体内主要起促进细胞分裂和增大作用[16]。吲哚乙酸(IAA)主要促进植物茎的伸长,提高植物的生长速率[17],而赤霉素(GA3)在植物生长发育过程中能有效促进细胞分裂和细胞的伸长[18]。合理使用外源植物激素能有效提高植物生长和生物量[19]。有关研究表明,一定浓度的外源激素能显著提高白枪杆种子发芽率和其幼苗生长量[20]。然而,对于外源植物激素对白枪杆生物量分配影响的研究尚少见文献报道。本文采用正交实验法研究不同外源植物激素交互作用对白枪杆幼苗生物量分配和异速生长的影响,以期为生物量分配和异速生长扩充研究范围,为西南岩溶石漠化区植被恢复提供参考。
1 材料与方法
1.1 实验地和材料
实验地位于昆明西南林业大学树木园(25°03′N,102°46′E),地处于亚热带高原季风气候区,海拔1 954m,霜期短,气候温和,年平均温度16.5℃,年平均降水量 1 035mm,年平均相对湿度67%。实验在25%左右遮阴棚下进行(透光率约75%)。
以1a生白枪杆实生营养袋苗(2018年11月采种,1月播种,3月移至实验地)为实验材料,苗高5.7cm、地径1.22mm;无纺布袋(直径11cm×高15cm);供试外源植物激素为3-吲哚乙酸(IAA)、赤霉素(GA3)、玉米素(ZT)。于实验地适应生长3个月。2019年6月将无病虫害、大小一致、生长良好的白枪杆幼苗定植于无纺布袋中,基质为黄红壤,理化性质如表1所示。每袋1株,定期浇水。2019年7—12月开展实验。

表1 实验地土壤理化指标
1.2 实验设计
采用正交实验设计(3因素3水平),9个外源植物激素处理组合(表2),实验期间每隔30 d喷施1次外源植物激素,每次喷施以叶面布满叶滴但不下滴为宜,外加1个清水喷施作对照(CK),共10个处理。每个处理3次重复,每个重复10株苗,共300株。
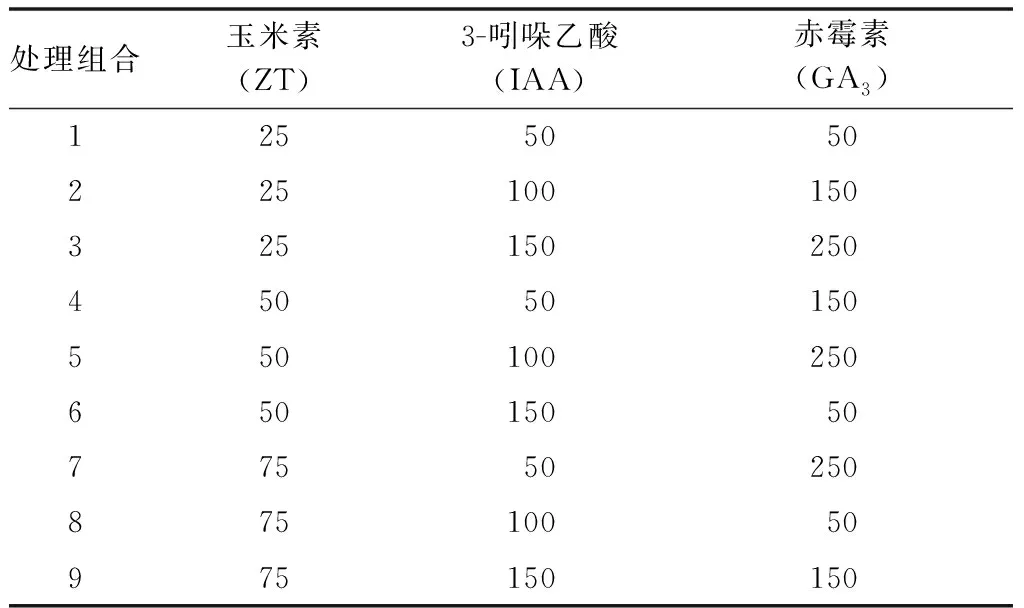
表2 外源植物激素浓度组合L9(34)正交实验设计
1.3 生物量测定
2019年12月,从每个处理组选取15株(每个重复5株)生长基本一致的苗木,共计180株,采用标准取样法将白枪杆苗从土壤中完整取出,用自来水将根系和植株叶片清洗干净,晾干幼苗表面附着水分,装入信封袋,带回实验室置于烘箱中,以120℃杀青30 min,然后以80℃烘干至恒重,电子天平称取生物量(精确度0.001 g)。
1.4 数据处理
通过Microsoft Office 2013整理、计算数据,并作图。利用SPSS 19.0进行方差分析和多重比较。以每个处理18株幼苗各器官生物量数据为基础,采用标准化主轴回归(SMA)分析[21]获得不同处理各器官干重与总干重异速生长方程的参数估测值,由软件(S)MATR Version 2.0计算和建立各器官生物量之间的异速生长方程。异速生长方程采用幂函数(Y=αXβ)形式表示[9],线性转化为logY=logα+β×logX,式中,Y与X代表不同器官干重生物量,α为方程的截距,β为方程斜率,即器官间的异速生长指数(β=SMA斜率)。该方法的优势在于用估测值斜率SMA与理论值1.0进行比较判断是否为存在差异性[22],若斜率存在显著差异则进行斜率间的post-hoc多重比较;若斜率间无显著差异,则给出共同斜率,并进一步用WALD检验处理是否沿共同主轴有显著位移,在有显著位移的情况下计算位移量。不同处理组合间植物生长速率沿共同主轴的位移表明了不同环境下植物性状值的差异。
2 结果与分析
2.1 对白枪杆幼苗生物量的影响
白枪杆幼苗生物量不同处理间的差异性如表3所示。经F检验,ZT对白枪杆幼苗生物量影响达到极显著(P<0.01)水平,IAA对白枪杆幼苗生物量影响除茎生物量外不显著外,其他均达到极显著(P<0.01)水平,GA3对白枪杆幼苗的叶、地上和总生物量影响显著(P<0.05),对其他部分作用不显著。进一步多重比较分析发现(表4),白枪杆幼苗各器官的生物量以4号处理最大,其次为1号和2号处理,各器官生物量均大于CK处理。6号处理除根、叶生物量小于CK,其余均大于CK。9号处理除茎之外,各器官生物量最小。各处理组合间地上部分生物量与总生物量一致,表明不同处理间白枪杆幼苗生物量差异取决于地上部分生物量。根、茎、叶最大生物量(4号处理)分别为根(9号处理)、茎(CK号处理)、叶(9号处理)最小生物量的2.43,2.45和2.30倍。从不同器官生物量来看,除5号处理生物量大小顺序为茎>叶>根之外,其余均为叶>茎>根。

表3 不同处理白枪杆幼苗生物量方差分析
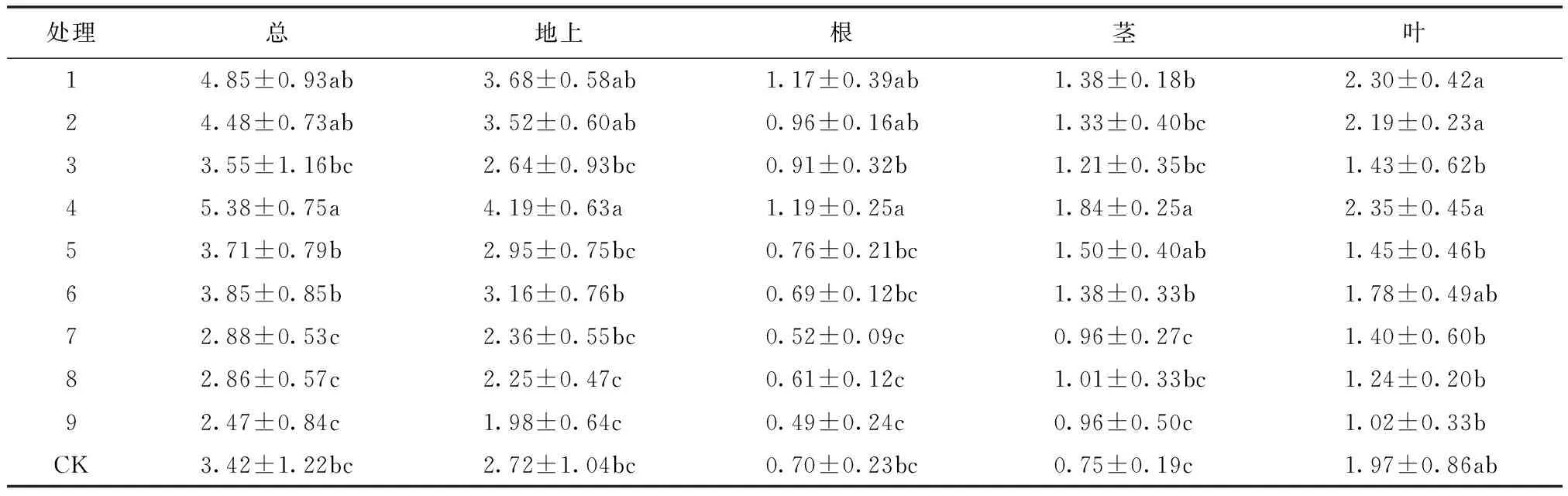
表4 不同处理白枪杆幼苗生物量
2.2 白枪杆幼苗生物量分配
不同处理组合白枪杆幼苗各器官生物量的分配比例大小基本遵循叶>茎>根的分配规律(图1)。不同处理组合之间,根、茎和叶生物量分配差异极显著,地上生物量分配差异显著(表5)。根生物量分配比中3号处理显著高于其他处理,为25.98%,6号处理最小,为18.16%;茎生物量分配比例CK显著低于其他处理,为22.69%,最高的为5号处理,为40.45%;叶生物量分配比例中CK显著高于其他处理,为56.36%,最小的为3号和5号处理,分别为39.12%,38.73%,其他处理差异不显著,为42.73%~49.36%;地上生物量分配比以6号、7号和9号处理较高,达80%以上,以3号处理较低,不到75%。10个处理中,生物量最大的4号处理各器官之间生物量分配比例与其他处理相比均无最大值,即幼苗各器官之间的分配比例与植物大小无明显联系。

注:不同字母分别表示各处理间差异显著(P<0.05)。
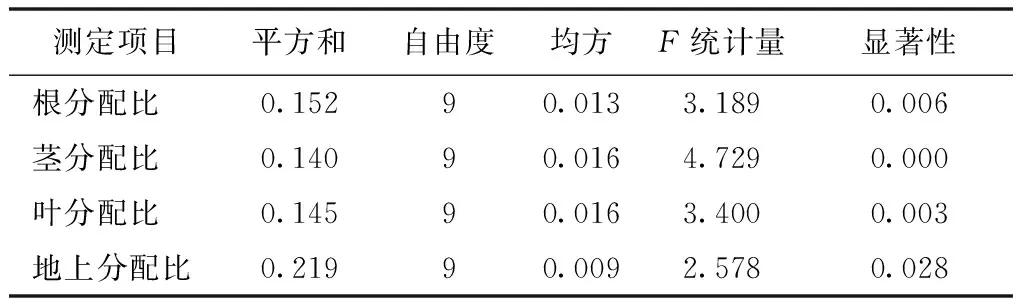
表5 白枪杆幼苗生物量分配比方差分析
2.3 白枪杆幼苗各器官之间的异速生长关系
白枪杆幼苗各器官间存在正相关关系(表6)。其中,叶和根之间,1号处理P1.0=0.032<0.05(P<0.01),呈极显著异速生长;叶与茎中,2号处理P1.0=0.026<0.05(P>0.05),呈异速生长;茎与根中,7号处理P1.0=0.038<0.05(P<0.01),呈极显著异速生长;地上和地下中,7号处理P1.0=0.034<0.05(0.01 表6 白枪杆幼苗各器官间标准化主轴回归(SMA)分析 表7 白枪杆幼苗各器官异速生长斜率异质性检验及共同斜率 进一步对沿主轴上的位移(截距差异显著性)进行多重比较(表8)。在幼苗各器官之间,位移量最显著的为4号处理,其次为1和2号处理,位移量最小为9号处理。表明在根和茎生物量一定,即有限资源下,4号处理的3种激素配比能显著促进茎和叶分生物量的积累。 表8 白枪杆幼苗不同器官沿共同主轴的位移 外源植物激素对植物幼苗的生物量有一定的促进作用[23],外源植物激素通过影响植物体内各激素平衡[24],引起植物体生长和生理代谢发生改变,外源激素的浓度对植物的调控作用也存在差异[25]。生物量是白枪杆幼苗对外源植物激素作用结果的综合体现,也是其对环境综合适应的结果,是外源植物激素处理最优组合的直接指标。本实验结果表明:ZT和IAA对幼苗生物量的影响起主导作用,能有效促进各器官的活力,进而影响植物的生长、无机盐的吸收和有机物的合成,增加白枪杆幼苗生物量的积累[26];GA3促进白枪杆幼苗生物量积累的作用次于ZT和IAA,可能原因是GA3仅促进白枪杆幼苗叶生物量的积累,导致其总体作用不明显[27],但具体原因有待进一步研究。通过对4号、9号和清水对照(CK)实验结果比较,发现9号处理生物量明显低于4号和CK,这表明当外源激素浓度超过一定浓度值时对白枪杆幼苗生物量的促进作用开始降低,甚至产生抑制作用,符合黄杰[28]和张旭等[19]研究结果。 在植物个体生长发育过程中,其不同器官的相互协调发展,是植物为维持其生长发育和繁殖的一个生活史对策。生物量在根、茎、叶等各器官中的分配方式受植株年龄、植物种类、植株大小、水分、温度和光照等外部环境的影响[29],最后以异速生长的形式表现出来。本实验采用标准化主轴回归分析白枪杆幼苗各器官干重之间的异速生长,发现不同外源植物激素处理下白枪杆幼苗各器官生物量分配比差异显著,各器官生物量分配方式为总体为叶>茎>根,与White 的研究结果一致[30],即茎越大,其所能够承载的叶生物量越大。白枪杆幼苗总体上呈等速生长,符合异速生长理论和Reich 等[31]的研究结果。1号、2号和7号等部分处理组合存在差异,也即其器官之间存在异速生长,1号和2号处理出现该种情况的原因可能是ZT和GA3浓度较低,显著促进了叶的生长[32],而7号处理ZT和GA3浓度高,抑制叶的生长,生物量更多分配于根中[33]。此外,2号、8号和9号处理叶与根的异速生长指数小于1(SMA<1),即叶生物量的增长速度小于茎生物量的增长速率,与Corner 法则不相符[24,34],原因可能是幼苗生长季枝叶脱落,实验中喷施外源IAA,离层两端浓度差异较小或无差异,离层形成,枝叶脱落,甚至是近轴端浓度远大于远轴端,加速枝叶脱落[35]。造成以上差异的具体原因有待进一步研究。各器官之间沿共同主轴的截距差异显著,说明不同浓度水平外源植物激素对各器官的生长速率具有显著影响。综合分析其位移趋势可得出:白枪杆幼苗各器官之间在不同外源植物激素处理下位移差异显著。其中,4号处理具有最大位移量,9号处理具有最小位移量,与生物量分析结果一致。不同外源植物激素处理下幼苗各器官之间生物量分配对策无显著变化,可能是多种因素共同作用的原因[26,33]。外源植物激素处理下白枪杆幼苗的异速生长分析为苗期优化培育提供了可能性。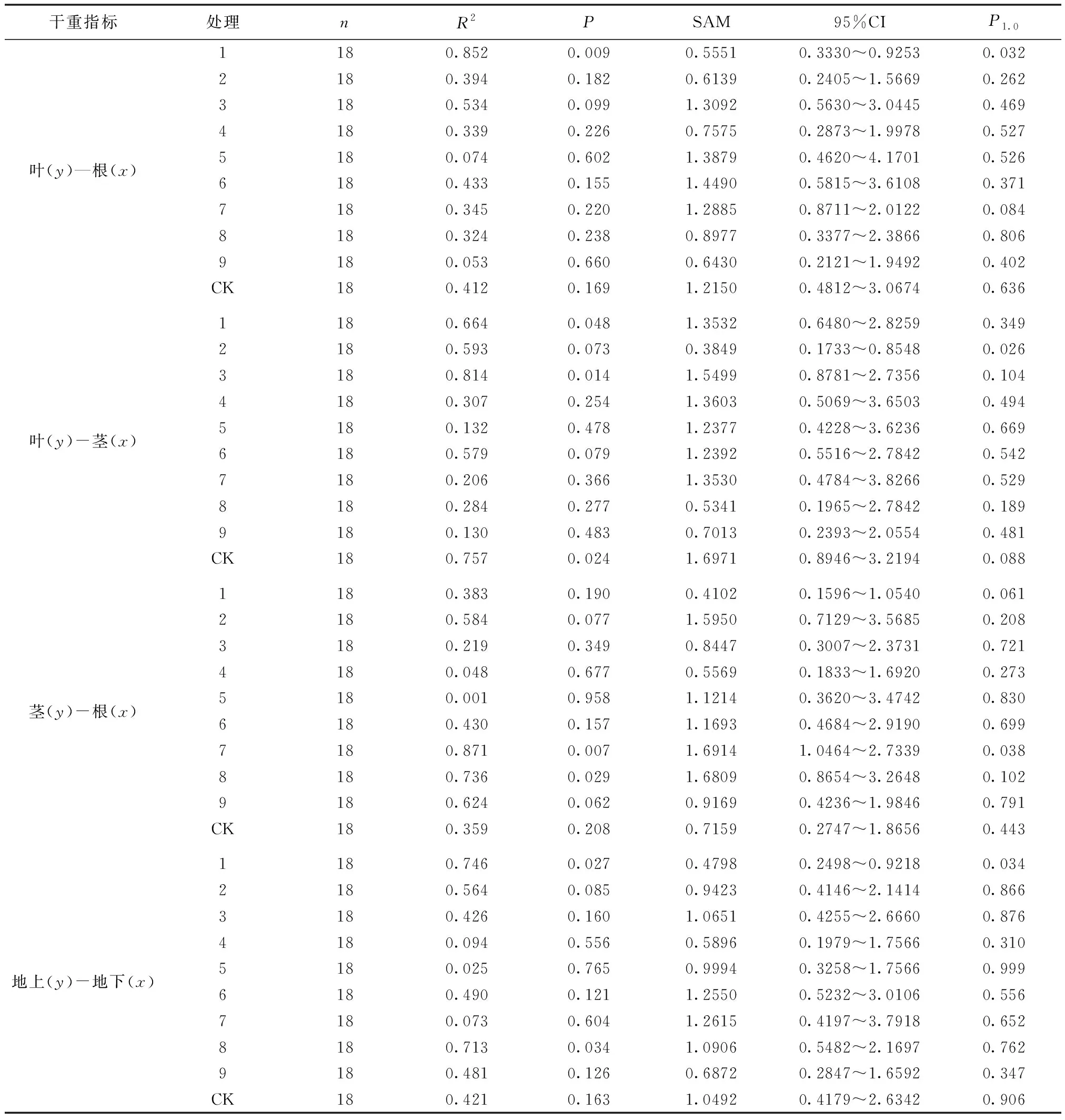


3 讨论与结论
3.1 外源植物激素对生物量及其分配的影响
3.2 外源激素处理下白枪杆幼苗的异速生长关系
