盐胁迫下水稻根系细菌群落多样性研究
2021-08-05李晓东胡建勇时春明张人铭
李晓东,高 攀,焦 飞,胡建勇*,时春明,张人铭
(1.新疆维吾尔自治区水产科学研究所,新疆 乌鲁木齐 830000;2.农业部西北地区渔业资源环境科学观测实验站,新疆 乌鲁木齐 830000)
【研究意义】新疆地处我国干旱半干旱地区,水资源时空分布不均,气候条件特殊,盐碱水域资源十分丰富。目前,这些盐碱水资源受制于技术而未得到有效开发利用,造成资源浪费。从国内外的实践和经验看,盐碱水域渔业是解决盐碱水域资源开发的主要手段,而渔业养殖尾水的资源化利用是现代渔业的主要研究方向[1]。在传统“鱼-菜”、“鱼-稻”综合种养基础上开发出适合盐碱水渔业的“鱼-植物”综合种养模式对盐碱水渔业的发展、渔业养殖尾水的处理具有重要意义。【前人研究进展】相比传统的淡水池塘养殖,盐碱水体复杂的离子结构与渔业生产产生的各类无机、有机代谢废物的共同作用对于共生植物生理生化的影响更重要,并且这些影响大部分是不利且机理不明的,而植物根系微生物群落结构与植物生长发育有密切关系,尤其是根系有益菌群能够促进植物对氮、磷等营养元素的吸收,增强对生物及非生物胁迫的抵御能力[2]。植物根系微生物群落包括存在于根内的内共生菌和根表的微生物菌群,其微生物种类包括细菌、放线菌、真菌、藻类和原生动物,就丰度而言,细菌含量最高,原生动物最低[3-4]。采用传统的微生物分离鉴定方法研究植物根系微生物群落结构多样性存在许多弊端。近年来,微生物宏基因组技术和高通量测序技术的发展为研究微生物群落结构多样性提供了有效手段。因此,利用高通量测序技术研究植物根系微生物群落结构尤其是逆境下植物根系微生物群落结构对植物生长发育的影响对于揭示植物的抗逆机理具有重要意义[5-6]。在盐胁迫条件下,植物根系微生物通过参与渗透调节、营养吸收等具体生理功能为共生植物提供保护,其本身群落结构的动态变化也受盐胁迫的影响[7]。【本研究切入点】相比传统的土壤-植物-微生物生态系统,“鱼-植物”共生模式下的水-植物-微生物生态系统的相关研究较为薄弱,尤其在盐碱渔业方面。【拟解决的关键问题】鉴于此,本研究通过利用高通量测序技术对盐胁迫下的水稻根系细菌群落结构进行研究,为盐碱水渔业发展“鱼-植物”共生模式奠定相关基础。
1 材料与方法
1.1 材料
以水稻品种秋田小町为研究对象,经育苗,大田生长,2019年7月10日移栽至新疆水生野生动物救护中心待用;选择高度一致的水稻幼苗定植于花盆,每个实验组定植9株。实验组使用国产“蜀盆”牌无土栽培营养液水培15 d后按照盐浓度0(样品名称OS-S0)、1 ‰(样品名称OS-S1)、2 ‰(样品名称OS-S2)、3 ‰(样品名称OS-S3)、4 ‰(样品名称OS-S4)、5 ‰(样品名称OS-S5)加入NaCl胁迫15 d。剪取一定长度的水稻根系经PBS(pH7.4)缓冲液漂洗后,置于20 mLPBS(pH7.4)缓冲液中,摇床震荡30 min后经4 ℃ 12 000 r/min离心5 min富集根系土壤备用。
1.2 方法
1.2.1 根系土壤DNA提取 使用OMEGA公司E.Z.N.ATMMag-Bi-nd Soil DNA 试剂盒提取根系微生物DNA后凝胶检测备用。
1.2.2 PCR扩增及高通量测序 根系微生物DNA使用 Life公司Qubit2.0 DNA试剂盒精确定量后使用上海生工的细菌16S rDNA通用引物进行第一轮扩增。引物序列。341F:CCCTACACGACGCTCTTCCGATCTG (barcode) CCTACGGGNGGCWGCAG;805R:GACTGGAGTTCCTTGGCACCCGAGAATTCCA(barcode) GACTACHVGGGTATCTAATCC。
上述PCR产物经引入Illumina桥式PCR兼容引物进行第二轮扩增后使用0.6倍磁珠(AgencourtAMPure XP)富集后经Life公司Qubit2.0 DNA试剂盒精确定量后委托上海生工使用Illumina MiseqTM平台测序。
2 结果与分析
2.1 根系细菌群落多样性测序数据处理
测序结果使用Cutadapt去除接头引物序列后使用PEAR拼接测序结果;Prinseq对拼接序列进行过滤后得到高质量的测序结果;Usearch去除预处理后序列中非扩增区域序列,随后对序列进行测序错误校正,并调用Uchime鉴定嵌合体。随后,去除嵌合体的序列与数据库代表性序列进行Blastn比对,低于阈值(97 %)的比对结果认为是靶区域外序列,并剔除掉该部分序列,最终得到可用于划分操作分类单元( Opera-tional taxonomic units,OTU)的序列数(表1)。
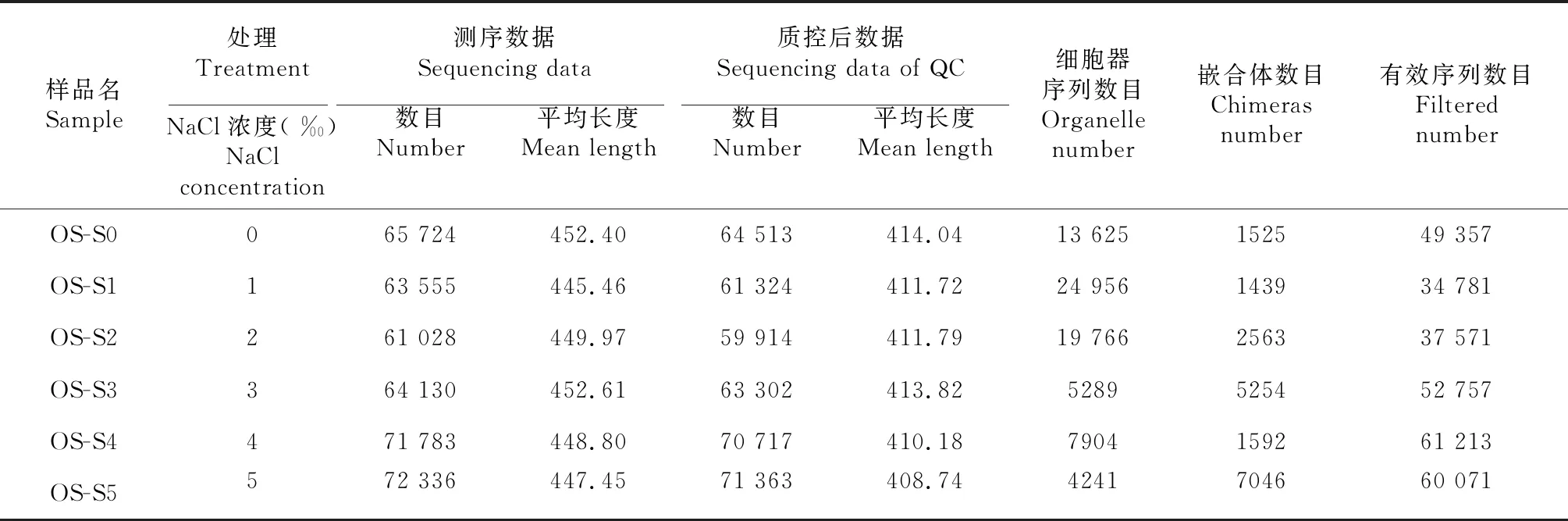
表1 测序数据处理结果
2.2 根系细菌群落多样性
Usearch对前述有效序列按照序列间的距离进行聚类,以序列之间的相似性不低于97 %的序列定义为一个OUT,最终得到的样品OTU用韦恩图表示(图1),不同盐浓度胁迫处理下水稻根系微生物OTU绝大部分为共有类型,特有类型数量在不同样品间差异较大;为更好表示出本研究不同处理间样品OTU的相似性和差异关系,基于Beta多样性距离矩阵进行层次聚类分析后使用非加权组平均法UPGMA算法构建树状结构(图2),不同盐浓度胁迫下相似浓度均聚于一个分支,说明OUT相似性较高。
样品的多样性研究可通过多样性分析(Alpha多样性)反映微生物群落的丰度和多样性,本研究使用Mothur计算不同处理样品间多样性指数(表2)。为更好地表示不同处理间样品的菌群丰富度、测序数据量是否合理及不同样品所含物种的丰富程度和均匀程度,分别构建了稀释曲线(图3)和Rank-abundance曲线(图4),发现随着扩增数的增加稀释曲线逐渐平缓说明测序数据合理,而Rank-abundance曲线较为粗糙,说明不同处理水稻根系微生物群落组成均匀程度低,不同类群差异较大。
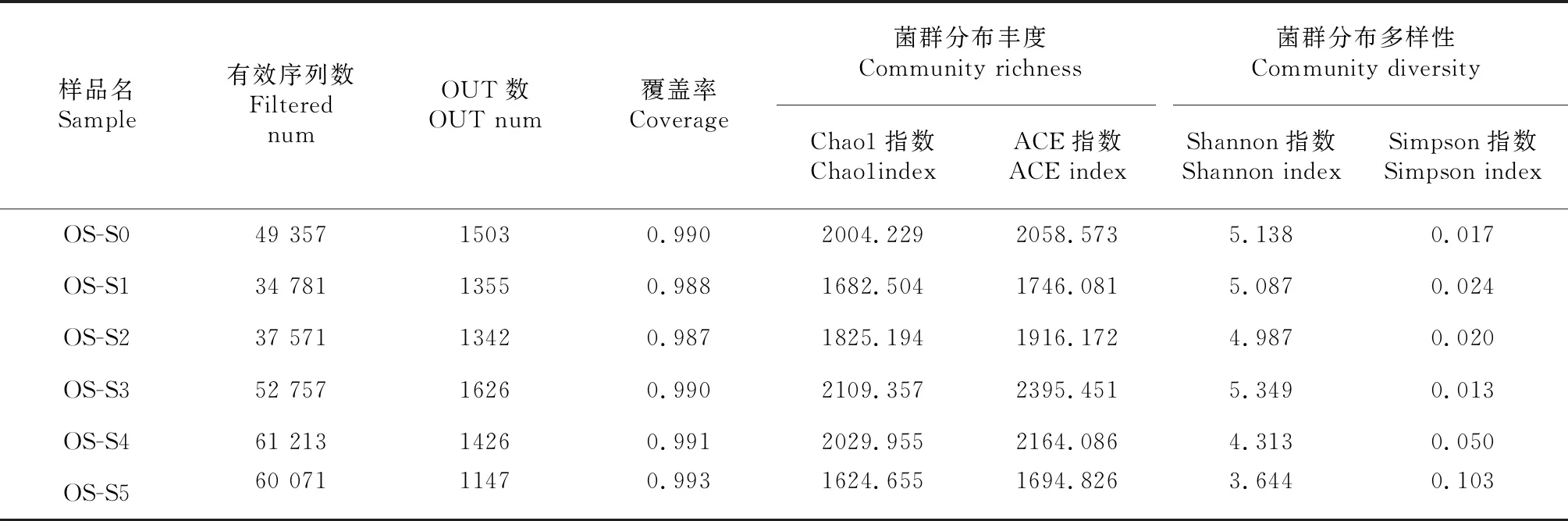
表2 不同处理间样品多样性指数
对OUT进行物种分类信息分析是群落多样性研究的常用手段,本研究采用RDP classifier分类方法,在科 (family,图5)、属 (genus,图6)水平上对各处理组细菌菌群含量均高于0.1 %的优势菌群进行了分类分析。
2.3 根系细菌不同群落相关性分析
通过分析科属水平上各处理组细菌菌群含量均高于0.1 %的菌群与盐度的相关性。发现在科水平上,Rhodobacteraceae科、Phyllobacteriaceae科与盐度有显著的正相关性,而Planctomycetaceae科、Pseudomonadaceae科、Verrucomicrobiaceae科、Caldilineaceae科、Anaerolineaceae科、Rhodospirillales科与盐度有显著的负相关性,Comamonadaceae科、Chitinophagaceae科、Acidobacteria_Gp4科与盐度的相关性不显著;在属水平上,Gemmobacter属与Aquisphaera属与盐度有显著的正相关性,而Pirellula属、Rhizobacter属、Luteolibacter属、Rubinisp-haera属、Caldimonas属、Reyranella属与盐度有显著的负相关性,Litorilinea属与盐度的相关性不显著。
3 讨 论
根系细菌群落结构多样性与生长发育阶段、生长环境密切相关[7-9],在不同盐浓度处理下,水稻根系细菌群落OUT数随着盐浓度的增加呈现出先高后低的态势,在盐浓度为3 ‰时所获得的OUT数最高,而韦恩图也呈现出相同的结果;同样,代表样品菌群多样性的Shannon指数、Simpson指数及代表样品菌群丰度的Chao1指数、ACE指数均在盐浓度为3 ‰时根系细菌群落丰度及多样性最高。根据Rank-abundance曲线可知,不同处理间根系细菌群落均具有较大的丰度(横轴长度)且曲线不够平滑,说明细菌群落的均匀程度较低。在盐碱条件下,植物根系微生物群落结构多样性与植物的种类、品系、生长发育阶段有密切关系[10-12],Yaish[12]研究发现,海枣在300 mmol/L NaCl溶液处理下,根系细菌处理组OUT数、Shannon指数、Simpson指数、Chao1指数均比对照组低,表明盐处理能够降低植物根系细菌群落丰度及多样性;但也有研究者认为,低浓度盐处理能够增加土壤细菌群落数量[13]。基于本研究的结果,笔者认为盐处理对植物根系细菌群落多样性的影响与盐浓度密切相关,高浓度处理(OS-S5)能够显著降低植物根系细菌群落的结构和数量,该结论已在多种植物的相关研究中获得证实[14];而在3 ‰盐浓度处理时根系细菌群落丰度及多样性最高。在盐耐受范围内,耐盐植物能够通过一些当前不明的机理促进有益菌群生长,以维护其正常生理功能[15],对于非盐碱植物,笔者认为出现该结果的原因在于对任何植物而言,如果盐浓度在其可耐受范围内(OS-S1、OS-S2、OS-S3),或许存在类似于盐碱植物的生理生化活动,Yang[16]研究菊芋时获得了与本研究相似的结果。
高通量测序结果经生物信息学分析获得不同处理间分类学上的细菌群落结构组成及结构的差异是本研究的核心所在,对各处理组细菌菌群含量均高于0.1 %的优势菌群在科、属水平上进行分类分析,在科水平上获得11科;属水平上获得9属。获得的菌群科属经相关性分析共有8科、8属与盐浓度具有显著相关性(P<0.05),其中Rhodobacteraceae科、Phyllobacteriaceae科、Gemmobacter属、Aquisphaera属与盐浓度具有显著正相关性(P<0.05)。Rhodobacteraceae科菌种绝大多数分离自海洋、盐碱湖泊及盐碱土中,少量分离自淡水环境中,其在海洋细菌群落中占30 %以上,并且常和真核生物共生[17],现有研究表明Rhodobacteraceae科菌种可以通过促进共生藻类维生素合成以保证其在盐碱环境下生存[18],与盐浓度显著相关的Gemmobacter属属于该科[19]。Phyllobacteriaceae科菌种广泛分布于各类环境中,在黄豆和苜蓿中该科菌种能够促进植物生长[20];在盐胁迫条件下,Phyllobacteriaceae科菌种可通过ACC脱氨酶基因的表达促进植物生长[21]。相比前述科属,Aquisphaera属为本研究获得的最具特殊的,就当前而言,该属仅有一种为Aquisphaeragiovannonii(https://lpsn.dsmz.de/),其是否有利于提高植物的抗盐碱能力目前未见报道,需要进一步研究。
4 结 论
植物根系微生物群落结构采用水培方式研究植物根系微生物群落结构,可为后续的盐碱水渔业“鱼-植物”综合种养模式提供技术支持,因为当前我国“鱼-植物”综合种养模式广泛采用生物浮床进行生产,这样的生产系统对植物而言其实就是改进版的水培系统,总而言之,在不同盐浓度胁迫下,水稻根系细菌群落丰度及多样性随着盐浓度的增加呈现出先高后低的态势,3 ‰盐浓度胁迫下最高,5 ‰盐浓度胁迫下最低;Rhodobacteraceae科、Phyllobacteriaceae科、Gemmobacter属、Aquisphaera属与盐浓度具有显著正相关性(P<0.05)。因此,这些科属所属菌种在今后盐碱水渔业发展“鱼-植物”综合种养具有潜在利用价值。
