不同海拔地区4种叶类蔬菜及土壤中灭幼脲的残留及消解动态分析
2021-08-05代艳娜刘青海杨晓凤
代艳娜,潘 虎,刘青海*,杨晓凤
(1. 西藏自治区农牧科学院农业质量标准与检测研究所, 西藏 拉萨 850032;2. 四川省农业科学院分析测试中心,四川 成都 610066)
【研究意义】根据中国农业农村部市场预警专家委员会统计分析,2018年我国蔬菜种植面积约2043.89万hm2,产量约7.035亿t,人均占有量为504.14 kg,普通白菜和大白菜等叶类蔬菜是我国播种面积较大、产量较高、种植户喜植的省工蔬菜品种[1]。叶类蔬菜的大面积种植导致菜青虫、小菜蛾和甜菜夜蛾等虫害频发,造成叶类蔬菜产量和品质的降低[2]。灭幼脲(Chlorbenzuron)是一种苯甲酰脲类昆虫几丁质合成抑制剂,该药可妨碍昆虫内表皮中几丁质的沉积和生物合成,抑制昆虫蜕皮,最终导致幼虫死亡[3]。目前,该药主要用于潜叶蛾、菜青虫、毒蛾类及夜蛾类等鳞翅目害虫的防治[4],但其使用量较大、药效慢、果蔬残留检出率较高、对水生甲壳动物和节肢动物毒害较大[5-6],故其残留消解动态和生物安全性需持续关注。【前人研究进展】目前,有关灭幼脲在果蔬和土壤中的残留及消解动态的报道较少,国内仅针对大白菜[7-8]、甘蓝[9]、苹果[10]、桃[11]等少数果蔬开展了相关研究,且上述研究主要集中在北京、上海、山东、湖北等低海拔地区,而尚无西藏等高海拔地区的相关研究报道,灭幼脲在高海拔地区蔬菜上的残留安全性有待进一步探讨。【本研究切入点】农药的残留及消解动态与生态环境、气候有着密切关系[12-13],西藏自治区拉萨市是地处青藏高原腹地,海拔约3667 m,高寒、缺氧、强日照等特殊的自然环境导致灭幼脲等农药的残留及消解动态与四川等温和、湿润、多雾的低海拔地区存在较大差异,但目前尚无开展相关研究报道。本文采用UPLC-MS/MS法分析了灭幼脲在西藏自治区拉萨市和四川省彭州市设施蔬菜种植基地的4种叶类蔬菜和土壤中的消解动态及最终残留量的差异。【拟解决的关键问题】以期明确蔬菜品种和不同海拔地区的种植环境对灭幼脲的残留及消解动态的影响,为将灭幼脲用于高海拔地区叶类蔬菜虫害的防治提供基础数据,促进西藏地区蔬菜等净土健康产业的可持续发展。
1 材料与方法
1.1 材料与试剂
1.1.1 供试材料 供试农药:20 %灭幼脲悬浮剂(京博农化科技有限公司)。供试作物:四季王大白菜和法国皇后西芹(凤鸣雅世种业有限公司),意大利生菜和寒春快菜(昆明市华兴种业有限公司)。
1.1.2 试剂和耗材 灭幼脲标准溶液(1000 μg/mL,农业农村部环境环境保护科研监测所),甲醇、乙腈(进口色谱纯,美国Fisher公司),氯化钠(分析纯,成都市科隆化学品有限公司),乙酸铵(色谱纯,迪马科技有限公司),有机系滤膜(0.22 μm,岛津技迩上海商贸有限公司),CAPCELL PAK MG-Ⅲ C18色谱柱 (100 mm×2.0 mm×3 μm,日本资生堂)。
1.2 仪器
美国Waters公司的ACQUITY UPLC H-class超高效液相色谱系统(包括二元梯度泵、真空在线脱气机、柱温箱和自动进样器),美国AB SCIEX公司的4500 Qtrap三重四级杆串联质谱仪(配置TurbolonSprap离子源、HARVARD pumpⅡ针泵及安装Analyst软件的计算机),德国BRAUN公司的CombiMax K600型蔬菜粉碎机,德国IKA公司的T18型匀浆机,电子天平(d=0.001 g、上海菁海仪器有限公司),美国Millipore公司的Milli-Q超纯水制备系统。
1.3 试验设计
2018年3月至2020年3月在西藏自治区拉萨市堆龙德庆区羊达蔬菜种植专业合作社(海拔3667 m)和四川省彭州市濛阳镇四川农科院植物高技术育种试验基地(海拔593 m)设施蔬菜基地开展相关残留试验,试验设计参照农业农村部《农作物中农药残留试验准则》[14]和《植物源性农产品中农药残留贮藏稳定性试验准则》[15]。
1.3.1 最终残留试验 设3个重复试验小区,每个小区面积约50 m2,各试验小区间设保护隔离区,另设清水空白对照区。按照采收期倒推施药时间,按照灭幼脲570 mL/hm2[114 mL(a.i)/hm2,最大推荐剂量)]的剂量喷雾施药2次,施药间隔7 d,于末次施药后7、14、21 d采集蔬菜整株样待测。
1.3.2 消解动态试验 植株。设3个重复试验小区,每个小区面积约50 m2,各试验小区间设保护隔离区,另设清水空白对照区。4种叶菜约生长到成熟个体1/2时,按灭幼脲855 mL/hm2[171 mL(a.i)/hm2,最大推荐剂量1.5倍]的剂量均匀喷雾施药1次,于施药后2 h,1 d、2 d、3 d、5 d、7 d、10 d、14 d、21 d采集整株蔬菜待测。
土壤。选择在种植地附近的空地中进行,试验小区面积为 50 m2(分3个重复小区); 施药剂量855 mL/hm2[171 mL(a.i)/hm2],施药后 2 h、1 d、3 d、5 d、7 d、14 d、21 d采样,另设清水对照。
1.3.3 样品采集、运输、制备和储存 植株采样。随机采集2份蔬菜样品,每份样品不少于12个个体且不少于2 kg。小区边行和每行距离两端0.5 m 内不采样。蔬菜鲜样2 h内运至实验室,去除表面泥土和明显腐坏、萎蔫部位后切段、匀浆,留取约250 g样品于-20 ℃冷冻保存、备用。
土壤采样。随机选取5~10个样点,用土钻采集0~10 cm 的土壤1~2 kg,除去土壤中的碎石、杂草和植物根茎等杂物,混匀后采用四分法留样250 g,于-20 ℃冷冻保存、备用。
1.4 分析方法
1.4.1 样品前处理[16]植株。称取25.00 g(精确至±0.01 g)蔬菜样品于250 mL烧杯中,加入50 mL乙腈,12 000 r/min高速匀浆2 min,用定量滤纸快速过滤至装有5~7 g 氯化钠的具塞试管中,剧烈振荡1 min,室温静置30 min,精确吸取上层乙腈相溶液1 mL,加入1 mL甲醇水溶液(1∶1/v∶v),涡旋混匀后过0.22 μm微孔滤膜,装瓶待测。
土壤。称取10.00 g(精确至±0.01 g)土壤样品于50 mL离心管中,依次加入10 mL水、20 mL乙腈,涡旋混匀1 min后,超声提取10 min,放入水浴振荡器中振荡30 min,用定量滤纸快速过滤至装有5~7 g 氯化钠的具塞试管中,剧烈振荡1 min,室温静置30 min,精确吸取上层乙腈相溶液1 mL,加入1 mL甲醇水溶液(1∶1/v∶v),涡旋混匀后过0.22 μm微孔滤膜,装瓶待测。
1.4.2 仪器条件[17]色谱条件:进样体积3 μl;柱温40 ℃;流动相A相为含0.1 %甲酸的0.2 mmol/L乙酸铵水溶液,B相为甲醇,流速0.3 mL/min;洗脱梯度程序:A∶B=70∶30(v/v),2.0 min;A∶B=60∶40(v/v),5.5 min;A∶B=5∶95(v/v),6.5 min;A∶B=3∶97(v/v),9.0 min;A∶B=70∶30(v/v)。质谱条件:采用ESI正离子MRM监测模式,雾化气流速50.0 L/h,辅助加热气流速50.0 L/h,气帘气流速30.0 L/h,喷雾电压5500 V,辅助加热气温度550 ℃。离子对和碰撞能量参数见表1。

表1 灭幼脲的特征监测离子
1.4.3 标准工作曲线制作和添加回收试验 标准工作曲线:精确移取0.5 mL的灭幼脲标准溶液(1000 μg/mL)于10 mL棕色容量瓶中,乙腈定容,得到50 mg/L 标准储备液,再移取1.0 mL的灭幼脲标准储备液于10 mL棕色容量瓶中,乙腈定容,得到5 mg/L的标准溶液。分别用4种叶菜空白基质和土壤空白基质稀释标准溶液,得到质量浓度分别为 0.001、0.002、0.005、0.08、0.1、0.2、0.3、0.5和1.0 mg/L的混合标准工作液,以质量浓度为横坐标、峰面积为纵坐标,绘制标准工作曲线。添加回收试验:在4种叶菜空白样品和土壤空白样品中添加一定量的灭幼脲标准溶液,添加水平为 0.01、0.1 和 0.5 mg/kg,重复5次,按1.4.1 和 1.4.2所述方法进行样品前处理及上机测定。
2 结果与分析
2.1 基质效应的消除及典型色谱图
在实际样品分析中共洗脱基质成分会引起分析信号的抑制或增强,是LC-MS/MS 定量分析中产生误差的根本原因[18-19]。本试验采用基质配制标准样品来补偿实际样品溶液对目标农药产生的基质效应,在1.4.2液相色谱-质谱条件下未出现杂质干扰峰(图1),灭幼脲的响应值较好,能够确保检测结果的准确性。
2.2 方法线性范围和检出限
标准曲线在0.005~0.5 mg/L范围内灭幼脲呈现良好的线性关系, 相关系数r为0.9985~0.9996,检出限为3.34×10-6~2.55×10-5mg/kg,定量限均为0.01 mg/kg,能够满足仪器分析相关系数要求(表2)。

表2 灭幼脲在4种叶类蔬菜和土壤中的回归方程、相关系数、检出限和定量限
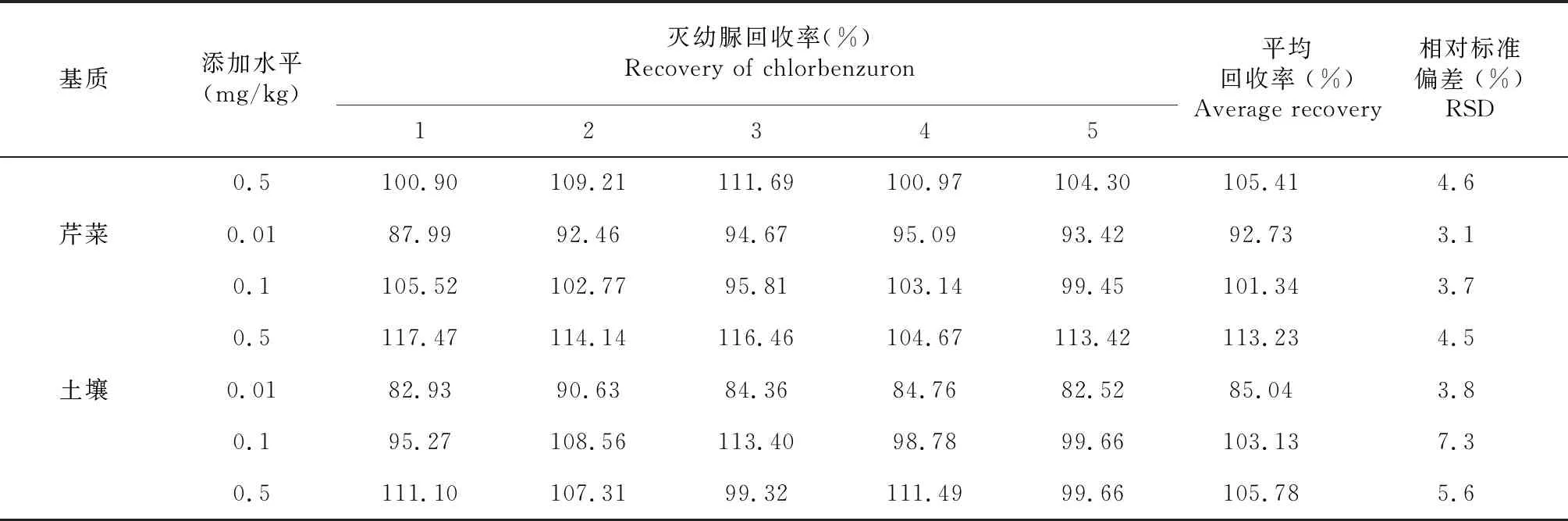
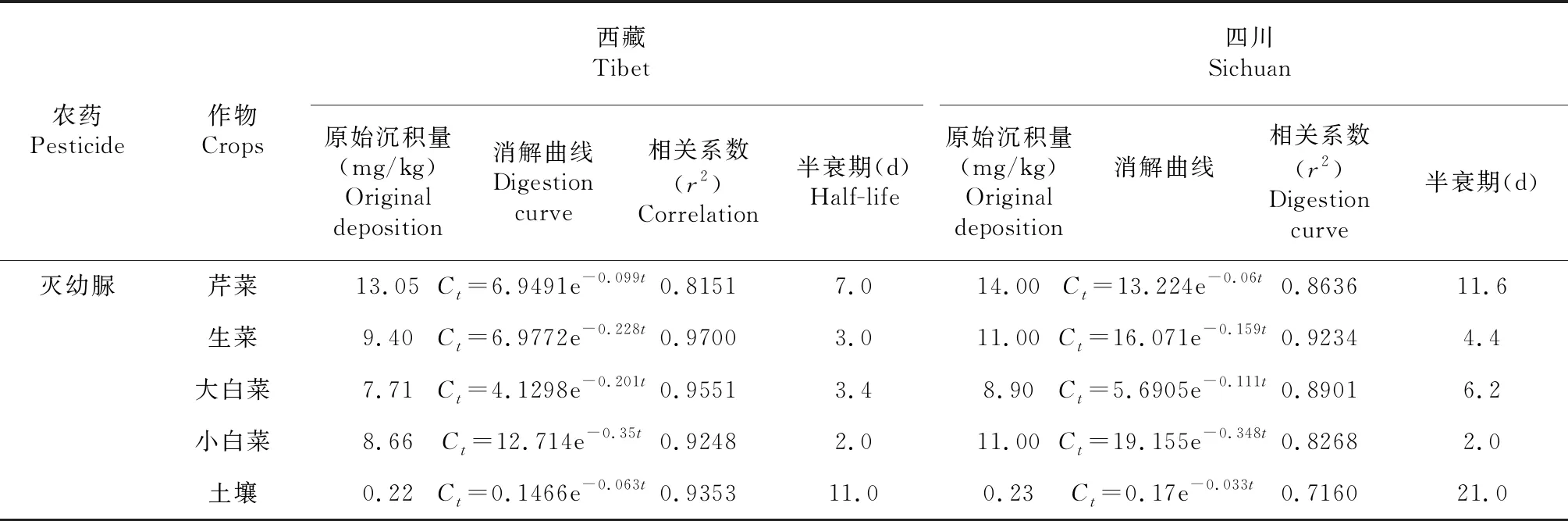
2.3 方法准确度和精密度
添加回收试验结果表明,灭幼脲在小白菜、生菜、大白菜、芹菜和土壤中的回收率分别为82.31 %~117.28 %、77.25 %~117.87 %、84.59 %~111.69 %、87.99 %~117.47 %和82.52 %~113.40 %(表3)。RSD在3.1 %~8.2 %,结果均符合《农作物中农药残留试验准则》要求。当添加浓度0.005 mg/kg 表3 灭幼脲在4种蔬菜和土壤基质中回收率及相对标准偏差(n=5) 续表3 Continued table 3 在西藏拉萨市和四川彭州市设施蔬菜基地开展的消解动态试验结果显示,两地4种叶类蔬菜和土壤中灭幼脲的消解动态曲线均呈指数函数关系,满足一级动力学方程Ct=C0e-kt(图2)。灭幼脲在高海拔设施蔬菜基地的4种叶菜和土壤中的原始沉积量低于在低海拔设施蔬菜基地的4种叶菜中的原始沉积量(表4),但灭幼脲在不同海拔地区的4种叶类蔬菜和土壤中的原始沉积量总体上差异性较小,说明农药原始沉积量跟海拔高度没有明显相关性。但同一地区4种叶类蔬菜上灭幼脲的原始沉积量由大到小依次为芹菜、生菜、小白菜和大白菜。半衰期结果显示,灭幼脲在蔬菜中的半衰期比土壤中半衰期短,且高海拔地区4种叶类蔬菜及其土壤中灭幼脲的半衰期均短于低海拔地区,灭幼脲在4种蔬菜中的半衰期由短到长依次为小白菜、生菜、大白菜、芹菜,其中灭幼脲在拉萨设施基地的芹菜和大白菜中的消解半衰期为7.0和3.4 d,而在彭州设施蔬菜基地的芹菜和大白菜中消解半衰期为11.6和6.2 d,差异较大,可能是由于拉萨地区日照强度大,导致该地区设施蔬菜中的农药降解速率较快。 表4 灭幼脲在4种作物和土壤中的消解动态及半衰期 最终残留量与施药次数和施药量均有关,农药残留量随着施药次数和施药量的增加,残留量增大。最终残留试验结果表明,间隔 7、14、21 d 采集样品,灭幼脲在4种叶菜中的残留量分别为 0.160~0.576、0.002~0.284 和 ND~0.175 mg/kg,拉萨市和彭州市小白菜中的灭幼脲残留量均符合最大残留限量(MRL)标准[20],灭幼脲在小白菜菜中的安全风险较小。第2次施药7 d后,灭幼脲在芹菜中的残留量最大,在相同施药条件下,拉萨市4种叶类蔬菜中灭幼脲的残留情况优于彭州市(表5)。由于我国尚未制定灭幼脲在芹菜、大白菜、生菜中的最大残留限量值,此次残留试验的结果,可以作为制定芹菜、大白菜、生菜中灭幼脲最大残留限量值数据参考。 表5 灭幼脲在4种叶菜和土壤中的残留量 本研究建立了UPLC-MS/MS 测定叶类蔬菜及其种植土壤中灭幼脲的消解动态方法,该方法前处理操作简便,具有较好的精密度、灵敏度和准确度,能够满足不同海拔地区灭幼脲的残留检测要求。残留消解动态试验结果表明,灭幼脲在拉萨市和彭州市的四种叶类蔬菜及其土壤中的消解符合一级动力学方程,灭幼脲的年际间消解动态及最终残留差异较小,但高、低海拔地区的消解动态及最终残留差异较大。作物本身对农药吸附能力和生物稀释作用影响农药的降解速率,芹菜对灭幼脲的吸附能力强于其他3种蔬菜,因此灭幼脲在芹菜上的原始沉积量大于其他3种蔬菜,半衰期相对长于其他3种蔬菜。2018 和2019年灭幼脲在拉萨市的4种叶类蔬菜及其土壤中的半衰期和最终残留量均小于彭州市,其中芹菜、大白菜和土壤中差异尤为显著,上述结果表明地域环境(温差、光照等)、土壤类型(有机质、pH、阳离子代换率)等因素对灭幼脲的残留有着较大影响[21-22]。目前,有关灭幼脲在果蔬和土壤中的残留及消解动态的报道较少,而尚无西藏等高海拔地区的相关研究报道,农药降解速率与光照强度有很大关系,毕望富等[8]研究发现低海拔地区灭幼脲在大白菜上半衰期为13.2~14.0 d,在土壤中为8.8~27.0 d。而灭幼脲在高海拔地区在大白菜上的半衰期仅为3.4 d,土壤中11 d,可能是西藏地区光照强度大的原因。因此,根据本文的研究结果,在西藏地区可以适当缩短灭幼脲的安全间隔期。同时,灭幼脲在4种不同叶类蔬菜上的降解半衰期也有较大差异,这可能与不同作物的生长速率、对药物的吸收性等差异有关[23-24]。本文首次探讨了蔬菜品种和不同海拔地区的种植环境对灭幼脲的残留及消解动态的影响,为将灭幼脲用于高海拔地区叶类蔬菜虫害的防治提供了详细的研究数据。 灭幼脲在拉萨市4种叶类蔬菜和土壤中的半衰期均短于彭州市,但其半衰期的长短在不同地区的4种叶类蔬菜中无差异,即小白菜<生菜<大白菜<芹菜。在相同施药条件下,拉萨市4种叶类蔬菜的灭幼脲残留情况优于彭州市,高海拔地区较低海拔地区为灭幼脲的残留低风险区域。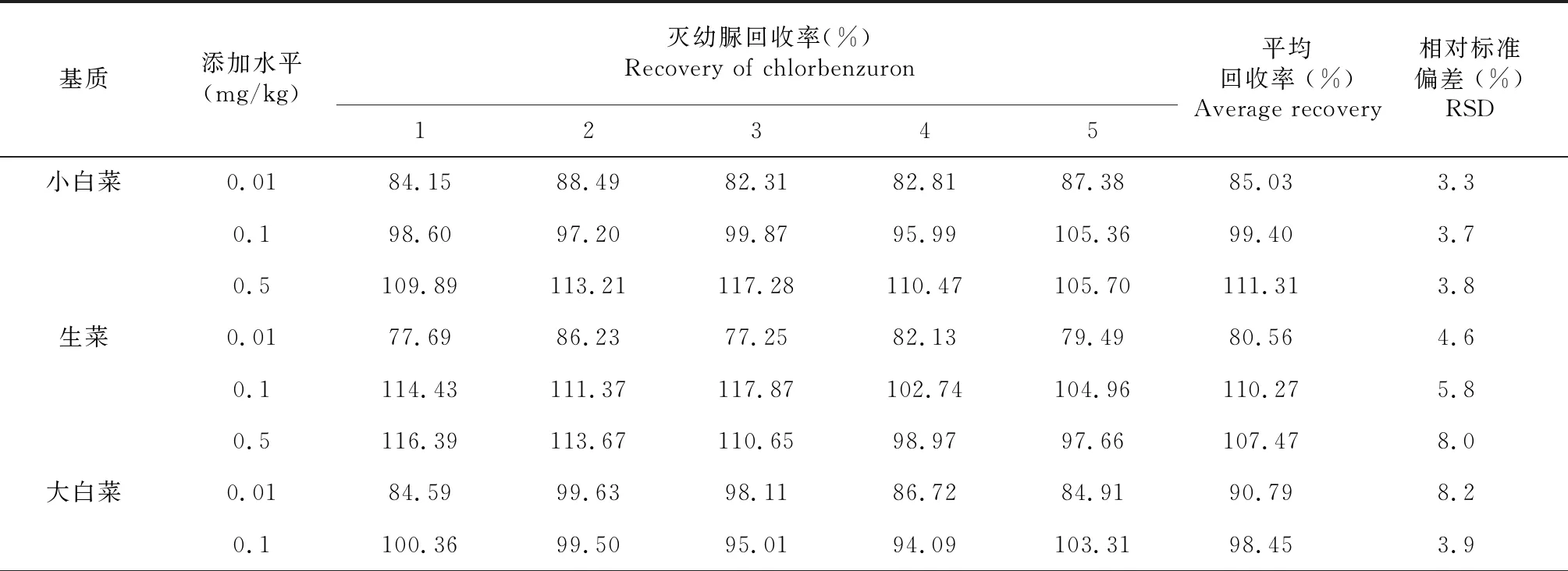
2.4 消解动态试验结果
2.5 最终残留试验结果

3 讨 论
4 结 论
