正常雌雄大鼠椎间盘微细结构差异的MRI研究
2021-08-05焦占营李洋方纪成朱文珍李丽周治国
焦占营 李洋 方纪成 朱文珍 李丽 周治国
研究表明人群中49%至80%的成年人会受到腰背痛的困扰[1]。其中,椎间盘退行性病变(Degenerative Disc Disease,DDD)被认为是导致腰背痛的重要原因[2]。随着对DDD 研究的深入,人们提出了多种新型治疗方法,但在应用于临床之前,新的治疗方法需要经过动物模型的验证。大鼠椎间盘退行模型具有廉价,易饲养等优点,并且大鼠的椎间盘结构和成分与人类相似程度很高,因而广泛地应用于DDD的研究之中[3]。使用大鼠DDD 动物模型进行研究时,应该使用单一性别的大鼠还是混合使用雌雄性大鼠,没有明确的答案及可遵循的依据。如何在体地、动态地显示雌雄大鼠之间是否存在椎间盘差异,并进行持续性观察,也是亟待解决的重要问题之一。
MRI作为一种无创的检测方法,是检测DDD的最好的在体方法。其中,T2 mapping 和T2*mapping技术能够很好地反映椎间盘的微观生化变化。T2 mapping 使用多回波自旋回波序列采集,能够反映水和细胞外基质的相互作用,在关节软骨、椎间盘形态发生明显变化之前就能够检测到水合作用的变化,对检测早期软骨疾病、椎间盘退变具有重要作用[4-5]。T2*mapping 使用的是多回波梯度回波序列,不仅能够对软骨进行生物化学方面的评价,而且成像时间更短,可以提供高分辨率的三维图像[5]。
本研究使用T2 mapping 和T2* mapping 技术对不同性别正常大鼠的椎间盘进行观察和比较,从而探究正常雌雄大鼠的椎间盘是否存在差异,为大鼠作为DDD研究动物模型时的性别选择提供依据,并探索这两种技术应用于DDD 的在体持续性观察的可能性。
材料与方法
一、实验动物
研究中使用了22只正常的Sprague-Dawley大鼠(重250~300克,10只雄性和12只雌性),年龄为3个月(骨性成熟),购自华中科技大学同济医学院实验动物中心(武汉,中国),均饲养在温度为24 ℃,湿度为50%的环境中,光照时间为12 h的日光,另12 h为黑暗。本研究由华中科技大学同济医学院附属同济医院伦理委员会批准(TJ-IRB20160923)。
二、扫描序列及参数
所有大鼠的尾椎(第6、7尾椎椎间盘C6/7、第7、8尾椎椎间盘C7/8)均采用3T MRI 扫描系统(GE Discovery MR 750,GE Healthcare,美国)进行扫描,线圈为3 cm 直径的表面接收线圈(上海辰光,中国),分别进行T2加权矢状位、T2 mapping和T2*mapping矢状位扫描。参数如下:
(一)T2加权矢状位
T2 加权矢状位的设置如下:重复时间(TR)为2 000 ms,回波时间(TE)为36 ms 的快速自旋回波序列;矩阵256;视野(FOV)为8.0×1.0 cm;层厚为1 mm,层间距为1 mm。
(二)T2 mapping矢状位
TR为1 500 ms,TE分别为7.8 ms、15.5 ms、23.3 ms、31.1 ms、38.8 ms、46.6 ms、54.3 ms、62.1 ms。矩阵256;FOV为8.0×1.0 cm;层厚为2 mm,层间距为2 mm。
(三)T2*mapping矢状位
TR为150 ms,TE分别为2.7 ms、6.5 ms、10.3 ms、14.1 ms、18.0 ms、21.8 ms;矩阵256;FOV为8.0×1.0 cm;层厚为2 mm;层间距为2 mm。
三、图像分析
大鼠尾椎的磁共振图像数据由两名放射科医师(具有8年及10年脊柱MRI 成像分析和放射学诊断经验)分析。在T2 加权矢状图像上,使用Pfirrmann分级法(五级分级法)[6]对每个椎间盘(C6/7,C7/8)进行分级评价。
同时,在T2 加权矢状位相上测量椎间盘高度(disc height index,DHI)。方法如下:测量两个椎体相向面终板之间的侧边缘的1/4,1/2 和3/4 处的间距,取其平均值。
利用工作站(Advantage Workstation,版本4.6,GE Healthcare,美国)处理T2 mapping、T2*mapping数据。以T2 mapping 数据处理为例,将感兴趣区域(region-of-interest,ROI)圆圈放置在椎间盘髓核中,测量T2 mapping 矢状相中ROI 的T2 值。为了选择髓核的正确解剖位置,与T2 加权矢状相进行匹配,将椭圆形ROI 的中心均匀地放置在椎间盘髓核上。T2*mapping 的参数T2*值在T2*mapping 矢状相中也以相同的方式测量。
四、病理组织学分析
将所有大鼠安乐死,并截取C6~C8椎体及其C6/7,C7/8椎间盘进行病理组织学检查。解剖脊椎时,避免损伤椎间盘,固定在10%中性缓冲福尔马林中,并使用Cal-Ex 脱钙溶液HCL(Fisher Scientific,美国)脱钙。然后将样品在流动自来水下漂洗并转移至75%乙醇。随后,将它们包埋在石蜡中。将椎间盘中段进行连续矢状位切割成5 μm厚度的切片,并进行苏木伊红(HE)染色和阿利新蓝染色[7]。在显微镜下分析病理组织学图像。
五、统计学分析
使用SPSS 25.0软件(IBM公司,美国)对数据进行分析,计量资料表示为均数±标准差(±s)。使用独立样本t检验对不同性别大鼠间Ⅰ级椎间盘的T2值、Ⅱ级椎间盘的T2值、Ⅰ级椎间盘的T2*值和Ⅱ级椎间盘的T2*值进行比较,P<0.05为差异有统计学意义。
结 果
根据Pfirrmann分级法将大鼠椎间盘进行分级,雌性大鼠24个椎间盘中14个(58%)属于Ⅰ级,10个(42%)属于Ⅱ级。雄性大鼠20 个椎间盘中14 个(70%)属于Ⅰ级,6个(30%)属于Ⅱ级。
HE 染色结果表明,相较于雌性大鼠,雄性大鼠的椎间盘更加的细长,而雌性大鼠较为粗短。雌性大鼠椎间盘中的纤维含量比雄性大鼠要多(图1 a、c)。阿利新蓝染色结果表明,雌性大鼠的纤维较雄性大鼠粗大,均匀,髓核细胞分布稍显聚集(图1 b、d)。
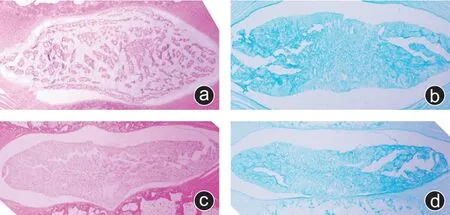
图1 正常雌雄大鼠椎间盘的HE 染色和阿利新蓝染色结果 a:雌性大鼠的HE染色结果;b:雌性大鼠的阿利新蓝染色结果;c:雄性大鼠的HE染色结果;d:雄性大鼠的阿利新蓝染色结果
通过MRI扫描和后期处理获得雌雄大鼠尾椎的T2WI矢状位图像(图2 a、b)、T2 mapping矢状位伪彩图(图2 c、d)和T2*mapping矢状位伪彩图(图2 e、f),为了测量椎间盘髓核的T2 值和T2*值,选择正中矢状位,将椭圆形ROI的中心放置在椎间盘髓核上,并尽量包全椎间盘。
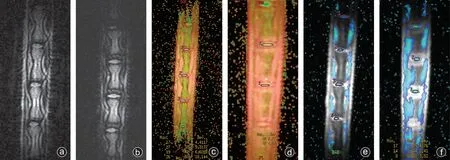
图2 正常雌雄大鼠椎间盘的MRI图像和髓核ROI的测量 a、b:雌性大鼠和雄性大鼠椎间盘的T2加权矢状位图像;c、d:雌性大鼠和雄性大鼠椎间盘的T2 mapping矢状位的伪彩图;e、f:雌性大鼠和雄性大鼠椎间盘的T2* mapping矢状位的伪彩图(ROI选取椎间盘中心层面的完整结构)
从T2 mapping 伪彩图上测量大鼠椎间盘的T2值,在Ⅰ级和Ⅱ级椎间盘中,雌性大鼠的T2 值均明显小于雄性大鼠(P均<0.05,表1)。从T2*mapping伪彩图上测量大鼠椎间盘的T2*值,T2*值结果和T2值结果相似,在Ⅰ级和Ⅱ级椎间盘中,雌性大鼠的T2*值均明显小于雄性大鼠(P均<0.05,表1)。
讨 论
和其它器官相比,椎间盘更容易发生退变[8]。即使在正常的大鼠中,也存在着较大比例的Ⅱ级椎间盘。在雌性大鼠的椎间盘中,有42%属于Ⅱ级。而在雄性大鼠中,Ⅱ级椎间盘占了30%。而且,不同级别的椎间盘在MRI 检测中也具有不同的表现,和Ⅰ级椎间盘相比,Ⅱ级椎间盘T2加权图像中结构不均一,同时可能具有水平带[6],并且Ⅱ级椎间盘具有更低的表观弥散系数(Apparent Diffusion Coefficient,ADC)值、更高的部分各向异性值和平均峰度系数(Mean Kurtosis,MK)值[9]。本研究中还发现,在雌雄大鼠中,Ⅱ级椎间盘的T2值明显小于Ⅰ级椎间盘。所以在进行大鼠的DDD动物实验时,应当先对所有实验大鼠进行MRI 扫描,剔除已经出现Ⅱ级椎间盘的大鼠。
Marinelli 等[10]曾经对人类尸体的椎间盘进行MRI检查,探究了T2信号强度和椎间盘中水含量的关系,发现T2信号强度可以反映出椎间盘中水含量的变化,T2 值随着椎间盘中水含量的增加而升高。T2*值能较好地反映出椎间盘中胶原蛋白的完整性,椎间盘的完整性受到破坏时T2*值便会降低[11]。龚静山等[11]和Welsch 等[12]将T2 mapping 和T2*mapping 用于研究腰痛病人的椎间盘退变情况,证明了在不同Pfirrmann分级的椎间盘中T2值和T2*值存在明显的差异,T2 值和T2*值可以很好地反映出椎间盘的退变程度。在Ⅰ级和Ⅱ级椎间盘中,雌性大鼠的T2 值都明显小于雄性大鼠(表1),表明雌性大鼠椎间盘中的水含量低于雄性大鼠。在Ⅰ级和Ⅱ级椎间盘中,雌性大鼠的T2*值低于雄性大鼠,说明雌性大鼠椎间盘中胶原蛋白的完整性低于雄性大鼠(表1)。而在之前的研究中我们也发现,在大鼠的Ⅰ级椎间盘中,雌性大鼠的MK值、轴向峰度系数值和径向峰度系数值都明显小于雄性大鼠,并且雌性大鼠具有更高的ADC值[9]。这些结果表明不同性别正常大鼠的椎间盘具有明显不同的MRI表现。
表1 不同Pfirrmann分级的雌雄性大鼠的T2值和T2*值(±s,ms)
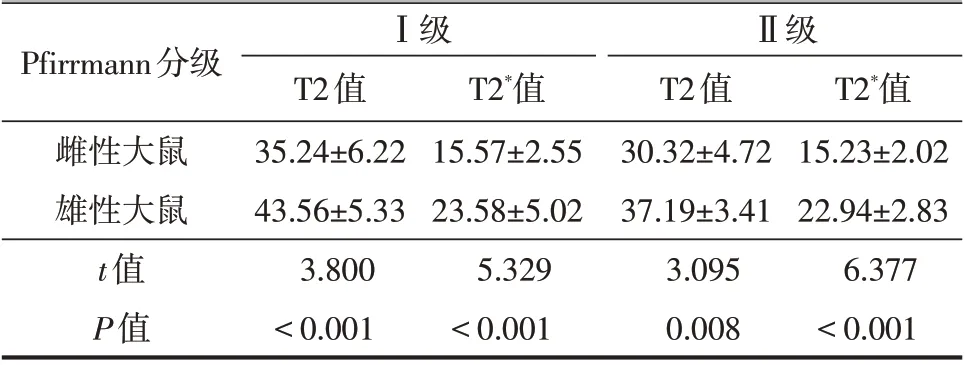
表1 不同Pfirrmann分级的雌雄性大鼠的T2值和T2*值(±s,ms)
Pfirrmann分级雌性大鼠雄性大鼠t值P值Ⅰ级T2值35.24±6.22 43.56±5.33 3.800<0.001 T2*值15.57±2.55 23.58±5.02 5.329<0.001Ⅱ级T2值30.32±4.72 37.19±3.41 3.095 0.008 T2*值15.23±2.02 22.94±2.83 6.377<0.001
组织学染色结果发现雄性大鼠的椎间盘更长并且更窄,而雌性大鼠较为粗短(图1 a、c)。雌性大鼠椎间盘比雄性大鼠的椎间盘含有更多的纤维。并且雌性大鼠椎间盘的胶原蛋白分布较雄性椎间盘而言是不均匀的,髓核细胞是成团的,而雄性椎间盘的基质及髓核细胞是散在分布的(图1 b、d)。椎间盘中纤维含量的增加往往伴随着水含量和胶原完整性的降低,进而减低T2值和T2*值[11],而雌性大鼠椎间盘中胶原蛋白分布不均匀和髓核细胞成团也会使得T2值及T2*值降低,这与MRI检测结果中雌性大鼠椎间盘的T2值和T2*值明显小于雄性大鼠相一致。和雌性大鼠相比,雄性大鼠椎间盘的高度明显更大[9]。这些结果表明,雌雄大鼠的椎间盘在形态和成分上存在明显差异。
本研究的不足之处主要是样本数量较少。人类椎间盘随着蜕变程度的升高,T2*值会明显降低[13],而本研究中,和Ⅰ级椎间盘相比,大鼠的Ⅱ级椎间盘的T2*值只有降低的趋势,但两者之间的差异没有统计学意义,可能就是由于样本数量较少导致的。
综上,正常成年大鼠的椎间盘中也会发生退变,实验之前应将这部分大鼠检测出来并排除掉,或者将这一重要因素考虑进去。再者,不同性别正常大鼠的椎间盘的T2 值和T2*值存在显著差异,组织染色结果也表明雌雄大鼠的椎间盘在形态和成分上存在不同,两者证实不同性别的正常成年大鼠的椎间盘具有明显的微细结构的差异,在大鼠椎间盘退变模型相关的研究中应尽量选择相同性别的大鼠。此外,T2 mapping 及T2*mapping 是两种灵敏、快速检测DDD的方法,可以用于检测大鼠椎间盘微细结构的动态变化,从而对大鼠椎间盘退变模型相关的研究提供持续的在体信息。
