ATP6AP2基因的克隆与其表达载体的构建
2021-08-04孙宜琳刘淑芹蒋扬帆曾玲玲杨细凤
孙宜琳,刘淑芹,蒋扬帆,曾玲玲,杨细凤,刘 杰
(湖北理工学院 肾脏疾病发生与干预湖北省重点实验室,湖北 黄石 435003)
0 引言
ATP6AP2基因(ATP酶辅助蛋白2)定位在 Xp11.4 染色体,编码一种与腺苷三磷酸酶(ATP酶)相关的I型跨膜蛋白,对许多细胞过程至关重要,如蛋白质运输、成熟、再循环或降解[1-2]。ATP6AP2蛋白与ATPases- V(液泡型蛋白质转位ATP酶)的跨膜区功能有关,又称为蛋白素受体(PRR)。作为V-ATPase辅助蛋白,参与了V-ATPase在内质网(ER)中的组装[3-4]。ATP6AP2最初被确定为肾素受体,在肾素-血管紧张素系统(RAS)中起到血压调节的作用[5]。此外,ATP6AP2在中枢神经系统中高度表达,其可能参与多种神经精神疾病的发生[6-7]。人类ATP6AP1和ATP6AP2的突变会导致多系统疾病,包括脂肪性肝炎、免疫缺陷和精神运动障碍[8-9]。我们的前期研究发现,ATP6AP2作为泛素化的底物之一参与了免疫调节类药物抗肿瘤作用。为了确认与ATP6AP2蛋白相结合的E3泛素连接酶,本文构建了ATP6AP2-GFP表达载体,旨在为ATP6AP2的生物学功能提供研究基础。
1 材料与方法
1.1 cDNA 的合成
1 mL TRIZOL 试剂裂解1皿293T 细胞,加入200 μL氯仿,剧烈震荡,通过异丙醇沉淀法获得RNA。1%琼脂糖凝胶检测RNA的完整性,Agilent Technologies 2100检测RNA的质量。取总RNA 3 μg,依次加入 Oligo(dT)1 μL,10 × BUFFER 2 μL,25 mmol/L MgCl22 μL,10 mmol/L dNTP mix 1 μL,0.1 mol/L DTT 2 μL,RNA酶抑制剂0.5 μL,加ddH2O至总体积达到30 μL,混匀 42 ℃温水浴 2 h,反转录合成cDNA,-80 ℃分装,保存。
1.2 PCR 扩增ATP6AP2基因的片段
人源的ATP6AP2 基因CDS序列(NM_005765.3)来源于NCBI 数据库( http://www.ncbi.nlm.nih.gov/)。引物序列如下: ①上游引物 5'-CCGCTCGAGATGCAGTCTTTCCTGTCT-3'( 下划线部分为 XhoⅠ酶切位点) ; ②下游引物5'-GCACTGCAGATCCATTCGAATCTTCTGGGTC -3'(下划线部分为PST I酶切位点),扩增片段大小为1 053 bp。
以 293T 细胞 cDNA 为模板,PCR 扩增获得 ATP6AP2 基因的蛋白质编码区 DNA 序列。 PCR 扩增条件为: 94 ℃预变性 5 min ; 95 ℃变性 30 s,59 ℃退火 30 s,72 ℃ 延伸 30 s,35 个循环;72 ℃延伸 5 min;1% 琼脂糖凝胶电泳回收 DNA 产物。
1.3 重组质粒的构建
1.3.1酶切、酶连
ATP6AP2基因的PCR扩增产物通过 XhoⅠ和 PST双酶切后与线性化的eGFP-N1载体连接。T4 DNA 连接酶 4 ℃过夜连接。酶切体系和连接体系见表1。

表1 酶切体系和连接体系 μL
1.3.2转化
感受态大肠杆菌 TOP 10冰上放置待融化,取5 μL连接产物与感受态细胞混匀,冰上孵育30 min,42 ℃热激120 s,之后冰上孵育3 min,加入600 μL无抗性LB液体培养基,37 ℃摇床上培养2 h,取出,离心,倒掉上清,涂布平板。
1.3.3重组子鉴定
超净台中用灭菌牙签挑取10个重组菌落于1.5 mL EP管中,加800 μL LB液体培养基于37 ℃摇床上摇菌培养3 h。菌液 PCR扩增条件为: 94 ℃ 预变性 5 min ;95 ℃ 变性 30 s,59 ℃ 退火 30 s, 72 ℃延伸 30 s,重复 28个循环。PCR产物经琼脂糖凝胶电泳检测阳性克隆,取阳性重组子进一步用XhoⅠ和 PST酶对质粒进行酶切验证,将阳性重组质粒送测序鉴定。菌液PCR体系见表2。

表2 菌液PCR体系 μL
1.4 重组质粒的转染
将293T细胞接种到6孔板中,待细胞密度为80%时开始转染,用100 μL无血清培养基在EP管中稀释2 μg重组质粒,轻微混匀。取另一EP管用无血清培养基将4 μL脂溶液稀释至100 μL,轻轻混匀,静置5 min后与前一管混匀,静置25 min, 然后于每孔中加入1 mL无血清培养基,置于5%CO2,37 ℃恒温培养箱。DNA脂溶液孵育25 min后,转移各管DNA脂溶液至6孔板中,摇匀,将6孔板放于5%CO2,37 ℃恒温培养箱孵育4 h后取出6孔板,吸取每孔中原培养基,加入2 mL新鲜的含血清培养基,48 h后取出6孔板,收获细胞及上清液。
1.5 Western blot检测ATP6AP2的表达
在收集转染后6孔板中的细胞样品中加入1 mL SDS-蛋白裂解液抽提蛋白,经SDS-PAGE凝胶电泳后转移至PVDF膜上,用封闭液封闭1 h,浸泡在含GFP一抗的牛奶中,室温摇床上孵育1 h,之后4 ℃ 孵育12 h。第2 d取出PVDF膜,将一抗洗去,浸泡在含相应二抗的牛奶中,室温摇床上孵育1 h,洗膜,经显影、定影后拍照。
2 结果
2.1 扩增目的基因片段
从NCBI数据库中检索得到人源ATP6AP2基因的信息(Gene ID: 10159),其mRNA 序列号为NM_005765.3,基因全长为2 242 bp,CDS区起止位点为 97-1149 bp, 其序列如下:


从293T细胞提取RNA,反转录出cDNA后,PCR扩增人源ATP6AP2目的基因CDS序列。对照DNA分子Marker,扩增出预期大小1 053 bp的目的片段。目的基因的扩增产物如图1所示。图1中,5个泳道分别是5管PCR样品,右侧分子Marker显示片段大小在1 000 bp左右。
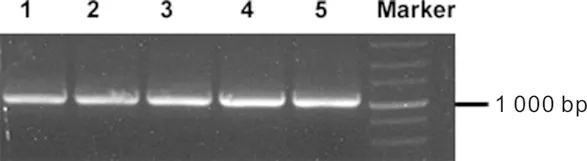
图1 目的基因的扩增产物
2.2 PCR产物和载体酶切、酶连、转化
回收后的PCR产物与pEGFP-N1载体经双酶切后连接,转化大肠杆菌。转化重组子涂布平板如图2所示。图2中,白色斑点为重组DNA菌落,LB固体培养基(卡那抗性)。
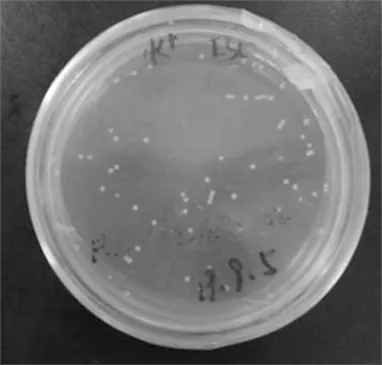
图2 转化重组子涂布平板
2.3 pEGFP-N1-ATP6AP2阳性重组子的鉴定
重组子中挑取2个菌斑摇菌后进行菌液PCR鉴定,将菌液PCR呈阳性的菌落摇菌、提质粒, 再经XhoⅠ和 PST双酶切后电泳,显示酶切后线性化的载体以及插入的DNA片段。重组质粒双酶切验证如图3所示。从图3可以看出,重组质粒经双酶切,得到一条4 700 bp的条带以及1 053 bp的条带,即ATP6AP2基因片段。酶切验证显示,ATP6AP2 基因成功地插入到pEGFP-N1载体中。将2个重组子提质粒、送测序,测序结果通过 NCBI 上Blast比对分析显示与 ATP6AP2基因编码序列完全一致,阳性克隆命名为 pEGFP-N1-ATP6AP2。

图3 重组质粒双酶切验证
2.4 重组真核表达质粒的表达
真核表达载体pEGFP- N1空载对照质粒和pEGFP-ATP6AP2 重组质粒分别转染293T细胞后提取蛋白,用 Western blot 免疫印迹法检测pEGFP-N1-ATP6AP2 融合蛋白的表达。pEGFP-N1-ATP6AP2融合蛋白的免疫印迹结果如图4所示。图4中,一抗为兔多抗GFP抗体;pEGFP-N1-1和pEGFP-N1-2分别表示转染了pEGFP-N1空载的2个样品;ATP6AP2-1 和ATP6AP2-2分别表示转染了pEGFP-N1-ATP6AP2 重组质粒的2个样品。与 pEGFP-N1空载的对照样品相比,在转染了pEGFP-N1-ATP6AP2 重组质粒的细胞中观察到 63.5 kD处有1条特异条带,即EGFP-ATP6AP2 融合蛋白,说明真核表达载体 pEGFP -N1 转染细胞后显著增加了ATP6AP2 蛋白的表达(内参蛋白GAPDH 作为参照物)。

图4 pEGFP-N1-ATP6AP2融合蛋白的免疫印迹结果
3 讨论
多亚基泡型H+-ATPase(V-ATPase)腺苷三磷酸酶的生物合成是在内质网中启动的,由一组核心亚单位包括质子孔(V0区)和ATP水解域(V1区)组成,此外,还有2个辅助亚单位命名为ATP6AP1和ATP6AP2。V-ATPase控制分泌和内吞途径中的一系列过程,如蛋白水解过程、蛋白降解、自噬和糖基化。此外,V-ATPase也参与了非酸化作用,如膜融合或分泌。
V-ATPase辅助亚基ATP6AP1的突变导致先天性糖基化障碍(CDG)、低丙种球蛋白血症以及肝功能异常等临床表现[10-11]。另一个辅助亚单位ATP6AP2的缺失导致小鼠心肌细胞、肝细胞或足细胞V0亚单位的显著减少、血清蛋白糖基化不足和自噬缺陷[12-13]。此外,ATP6AP2突变与帕金森病、痉挛、癫痫和智力残疾等认知障碍相关[14]。众多研究表明,ATP6AP2外显子跳跃突变通常会导致迟发性脑病例,如帕金森病和癫痫。然而,这些患者中没有表现出任何明显的肝脏、免疫或皮肤缺陷,其中一名患者的糖基化几乎正常。与外显子跳跃突变相比,错义突变对ATP6AP2整体功能的影响更大。ATP6AP2管腔结构域的不同点突变导致V-ATP酶组装受损以及随后的糖基化和自噬缺陷。患者出现肝病、免疫缺陷、皮肤松弛和精神运动障碍等临床症状。这些结果表明,ATP6AP2缺乏症的临床表现取决于突变的严重程度[15]。然而,ATP6AP2如何在机制上促进V-ATP酶功能从而影响糖基化以及自噬过程仍有待确定。
为了进一步研究ATP6AP2的生物学功能,通过定向克隆的方法将人源ATP6AP2 连接到真核表达载体PEGFP-N1,转染293T细胞。试验结果表明,转染后的293T细胞高效表达EGFP-ATP6AP2 融合蛋白,为进一步研究 ATP6AP2参与V-ATP酶功能的机制奠定了基础。
