抗酸化复合菌系强化堆肥优势微生物演替规律分析*
2021-08-03宋彩红张亚丽席北斗夏训峰
宋彩红 齐 辉 张亚丽 席北斗 夏训峰#
(1.聊城大学生命科学学院,山东 聊城 252000;2.中国科学研究院地理科学与资源研究所,北京 100101;3.中国环境科学研究院,北京 100012)
中国餐厨垃圾产量从2010年的3 667万t提升至2018年的4 552万t,按此增速推算,2025年全国餐厨垃圾产量有望达到5 500万t。数量如此庞大的餐厨垃圾如不妥善处理,势必会造成资源浪费和环境污染[1]。堆肥是一种有效的资源化手段[2],也是餐厨垃圾处理的有效方法之一[3]29。
由于餐厨垃圾有机质含量高,极易酸化腐败,在堆肥初期往往存在由于堆料酸化导致的堆体温度延滞上升,甚至发酵崩溃等问题[4-5]。针对上述问题,常采用的解决策略是添加化学缓冲剂调节堆料pH[6-7]或接种微生物菌剂促进小分子有机酸降解[3]29。前者成本较高,可能不适用于大型堆肥厂。后者常用的微生物菌剂有单一菌种[8]和复合菌剂[9]1124,相对于单一菌种而言,复合菌剂适应性更强、效果也更稳定。本课题组前期研究表明,接种抗酸化复合菌系(AAMC)可有效克服餐厨垃圾堆肥初期密集酸化问题[10]1,但接种该菌系对餐厨垃圾堆肥优势微生物演替规律影响机制不明确,直接限制该菌系的实际应用。本研究突破聚合酶链式反应/变性梯度凝胶电泳等传统微生物群落检测技术的固有限制[11],采用元蛋白质组学技术,通过检测不同堆肥样品中提取的蛋白质,探讨AAMC对餐厨垃圾堆肥优势微生物群落的影响,以期为抗酸化接种剂的实际应用提供理论参考。
1 材料与方法
1.1 堆肥物料
餐厨垃圾取自聊城大学某餐厅,堆肥前对其进行预处理,具体方法参见本课题组前期研究[9]1134。麸皮购自聊城大学东校区附近农户,作为调理剂使用,用以调节堆料含水率和碳氮质量比(C/N)。餐厨垃圾pH为5.42、含水率为75.3%、有机质为78.7%(质量分数)、C/N为22.1;麸皮含水率为11.5%、有机质为88.9%、C/N为33.6。
1.2 试验设计
将餐厨垃圾与麸皮按比例充分混合均匀,得到的堆肥混合物C/N为25.6、含水率为60.6%。设置3个堆肥组:(1)接种组,堆肥前于堆肥混合物中接入处于对数期的AAMC(菌体浓度为1×108cfu/mL,AAMC的筛选、驯化和构建方法及其菌种组成见本课题组前期研究[10]2),菌液接种量为1.25 mL/kg(以单位质量堆料干基计);(2)加碱组,添加MgO和K2HPO4以缓解堆肥初期密集酸化导致的pH下降,MgO、K2HPO4添加量分别为0.05、0.1 mol/kg(以单位质量堆料干基计);(3)设立自然堆肥组为空白对照。堆肥采用在线监测反应器[12]进行,试验过程中通风量保持在0.5 L/(min·kg),实时监测堆体温度和含水率,定期翻堆。
取样时间为堆肥0、3、8、13、19、35、47 d,采用四分法[13]取样,确保样品具有代表性。每个样品分成两份,一份立即用于pH检测(重复3次),另一份-20 ℃保存,用于元蛋白质组学测定。
1.3 理化指标分析
1.4 元蛋白质组学分析
总蛋白质提取、纯化、分离和鉴定依照本课题组前期研究[10]3进行。所有蛋白质采用BLASTP人工注释,包括来源微生物的名称。代谢通路查询采用KEGG网站(http://www.kegg.jp)。
1.5 数据分析
数据采用Origin 2019b软件进行试验原始数据的整理、示图制作,采用SPSS 20软件对pH数据进行单因素方差分析。
2 结果与分析
2.1 温 度
温度对堆肥效率有明显影响,在一定范围内,温度每升高10 ℃,生物体的新陈代谢速率会提升1倍[14]。不同堆肥组温度变化见图1。本研究主要关注堆肥初期酸化抑制阶段,仅显示30 d内的温度变化(堆肥30 d后,所有堆肥组温度均低于30 ℃)。接种组仅32 h即可达高温(>50 ℃),不存在堆体温度升高的延滞期,这说明添加AAMC可克服堆料酸化对微生物活性的抑制作用。加碱组最高温度(59 ℃)低于接种组(67 ℃),但堆肥32 h也可进入高温阶段,说明堆肥pH的改善也可避免堆体温度升高的延滞。对照组整个堆肥过程均低于50 ℃。接种组和加碱组分别在第5、6天满足美国环境保护署固废无害化标准[15],而对照组则未能满足标准。
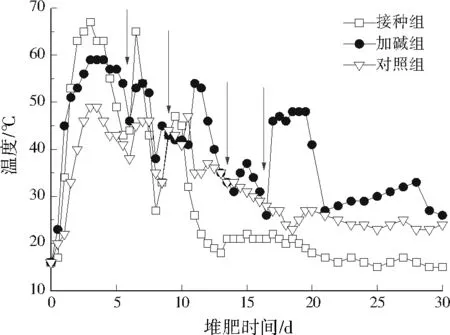
注:箭头代表翻堆。图1 不同堆肥组温度变化Fig.1 Changes of temperature in different composting treatments
2.2 pH
一般来说,当pH为6.7~9.0时,微生物对有机质的降解活性最高[16]。不同堆肥组pH变化见图2。接种组pH呈持续升高状态,最终达到稳定。因为小分子有机酸的密集产生,堆肥初期会出现明显的pH下降。接种AAMC可有效消除小分子有机酸对堆肥pH的降低作用,表明小分子有机酸一旦产生即可被AAMC快速降解。加碱组中由于碱性化合物的加入,初始pH明显高于其他组。堆肥前8天,由于小分子有机酸的大量产生,加碱组pH有所降低,此后随着小分子有机酸逐渐消耗殆尽,堆肥pH逐渐升高,并在第13天开始高于接种组。对照组出现了明显的酸化过程,pH总体走向虽然呈升高趋势,但整个堆肥过程中均呈酸性,酸性条件不利于堆肥微生物对有机物的降解,这可能是对照组堆肥效率低的原因。
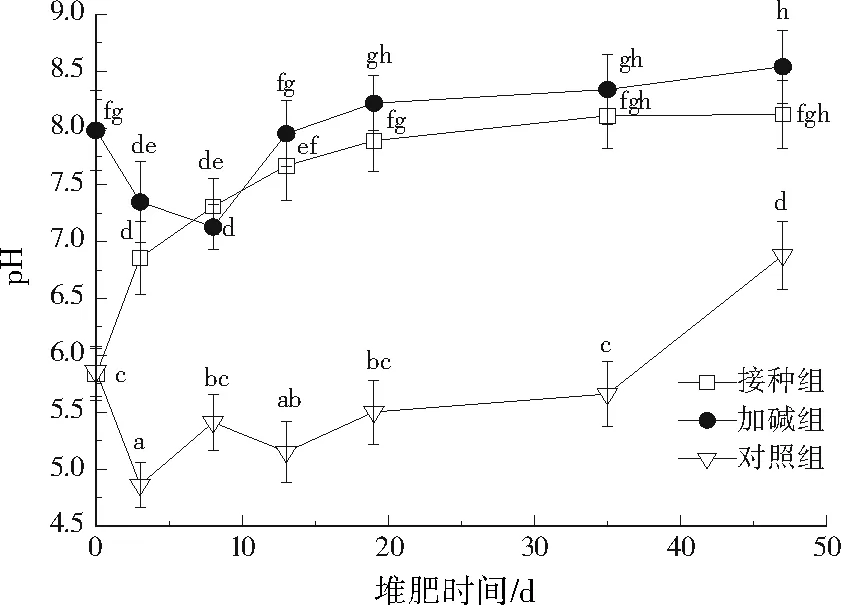
注:不同字母表示差异显著(p<0.05)。图2 不同堆肥组pH变化Fig.2 Changes of pH in different composting treatments
2.3 细菌演替规律分析
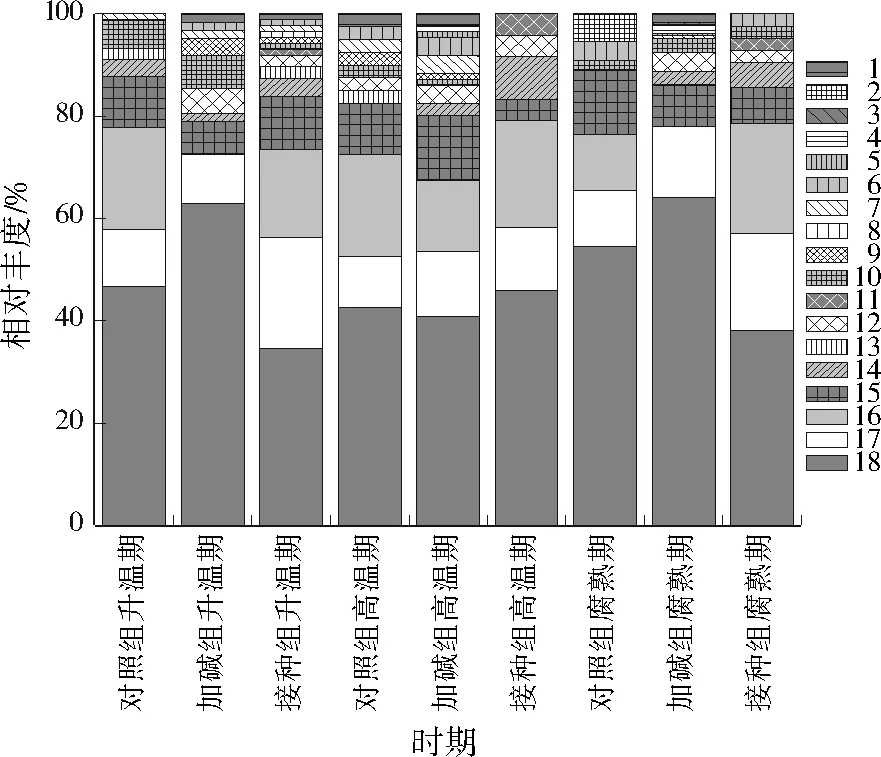
细菌群落组成见图3。83.9%~94.1%的细菌群落集中在γ-变形菌纲、芽孢杆菌纲、放线菌纲、α-变形菌纲、β-变形菌纲、δ-变形菌纲和梭菌纲。γ-变形菌纲相对丰度最高(19.6%~57.8%)。接种和加碱组中γ-变形菌纲相对丰度均呈降低趋势;对照组中γ-变形菌纲相对丰度在高温期降低,但腐熟期升高。γ-变形菌纲富含病原菌,对照组高温期温度较低(<50 ℃),只能暂时抑制γ-变形菌纲致病菌的生长,不能杀死它们,在温度下降后的腐熟期,致病菌的活性又恢复。堆肥过程中,芽孢杆菌在数量和功能上都占据较大优势。接种组芽孢杆菌纲相对丰度最低(8.75%~11.70%),加碱、对照组则分别为20.12%~28.46%、11.34%~28.57%,表明接种AAMC可改变优势微生物的相对丰度。与对照组相比,芽孢杆菌纲在加碱组表现出完全不同的变化趋势,说明添加MgO和K2HPO4可明显改变细菌群落的演替规律。在堆肥过程中,接种组放线菌纲相对丰度较大(7.28%~27.00%),加碱、对照组则分别为3.66%~6.12%、2.70%~10.71%,这说明接种AAMC能显著提高放线菌纲比例。放线菌纲微生物在堆肥过程起重要作用,其具有较强的木质纤维素降解能力,可作为堆肥腐熟度评价的有用指标[17]952。

注:1—其他;2—衣原体(Chlamydiae);3—拟杆菌纲(Bacteroidia);4—热袍菌纲(Thermotogae);5—产水菌纲(Aquificae);6—螺旋体(Spirochaetes);7—原绿藻目(Prochlorales);8—黄杆菌纲(Flavobacteriia);9—噬纤维菌纲(Cytophagia);10—绿菌纲(Chlorobia);11—柔膜菌纲(Mollicutes);12—颤藻亚纲(Oscillatoriophycideae);13—δ-变形菌纲(Deltaproteobacteria);14—梭菌纲(Clostridia);15—β-变形菌纲(Betaproteobacteria);16—芽孢杆菌纲(Bacilli);17—α-变形菌纲(Alphaproteobacteria);18—γ-变形菌纲(Gammaproteobacteria);19—放线菌纲(Actinobacteridae)。图3 细菌群落组成Fig.3 Bacterial community compositions
2.3.1 芽孢杆菌纲
本课题组前期研究表明,元蛋白质组学数据揭示18个属的细菌能分泌乙酸和丙酸降解关键酶[10]8,其中芽孢杆菌纲中包含葡萄球菌属(Staphylococcus)、地芽孢杆菌属(Geobacillus)、链球菌属(Streptococcus)和芽孢杆菌属(Bacillus)。此4个属相对丰度为5.50%~19.23%,在接种组中最低(5.50%~7.73%),加碱、对照组中则分别为13.99%~19.23%、9.19%~16.07%,说明此4个属可能对缓解堆料酸化贡献较小。在升温期,不同堆肥组芽孢杆菌属均在芽孢杆菌纲占据主导地位,接种、加碱、对照组中占芽孢杆菌纲蛋白质的比例分别为37.74%、31.71%、40.74%。除具有乙酸和丙酸降解功能外,芽孢杆菌属还与纤维素的降解密切相关[18],本课题组前期研究也证实了这一点[10]8。纤维素的降解贯穿于整个堆肥过程,在堆肥中后期降解效率最高。接种、加碱、对照组芽孢杆菌属相对丰度分别为3.08%~4.42%、7.93%~11.73%、5.95%~8.93%,接种组最低,说明接种AAMC未增加优势细菌芽孢杆菌属的数量。然而,与对照组相比,加碱组芽孢杆菌属相对丰度明显较高,尤其在升温期和高温期,可能是因为加碱组较高的pH有利于芽孢杆菌属生长。SALIM等[19]研究表明,对堆料进行碱处理可促进芽孢杆菌TMF-1蛋白酶、α-淀粉酶和纤维素酶的生成。芽孢杆菌纲包含乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)和明串珠菌属(Leuconostoc)3个产乳酸菌属,在升温期,接种组中此3个属占芽孢杆菌纲蛋白质的比例(18.87%)明显高于加碱组(4.88%)和对照组(14.81%)。本课题组前期研究表明,乳酸可能不是堆肥初期酸化问题的主要原因[10]6,也就说明,在堆肥过程中检测到的产乳酸菌株并非都能产生乳酸。
与基因数据不同,元蛋白质组学数据不能直接计算多样性指数,因此本研究以属数或目数来衡量不同纲微生物多样性。接种、加碱组中芽孢杆菌纲微生物多样性(8~12、11~16属)均高于对照组(4~10属)。
如何保证油烟机平稳安静地运行,其实电机很重要。得益于直流变频电机先天的产品结构优势和相关技术优势,搭载上直流变频电机的吸油烟机相较于非直流变频的吸油烟机,在品质和性能等诸多方面都有显著的优势。在整个家电行业中,直流变频技术正不断渗透在各类家电产品中,中国的直流变频技术虽然起步晚,但是近年来发展迅速。
2.3.2 放线菌纲
在放线菌纲中,棒状杆菌属(Corynebacterium)、分支杆菌属(Mycobacterium)和红球菌属(Rhodococcus)能分泌乙酸和丙酸降解关键酶。此3个属在所有堆肥组放线菌纲中均占主导地位,占放线菌纲蛋白质的50%~60%。在升温、高温、腐熟期,此3个属在接种组中相对丰度(4.19%、16.15%、19.25%)均明显高于加碱组(1.83%、1.46%、2.88%)和对照组(1.62%、3.57%、1.03%)。接种组升温、腐熟期和加碱组高温、腐熟期均检测到热酸菌属(Acidothermus),而对照组未检测到。解纤维热酸菌(Acidothermuscellulolyticu)是本研究检测到的唯一热酸菌属种。研究表明,其能分泌热稳定的纤维素酶,如内切葡聚糖酶[20]。然而,在本研究中并未发现此功能。前期元蛋白质组学数据表明,高温双岐菌属(Thermobifida)可分泌纤维素降解关键酶,在接种组升温、腐熟期和加碱组高温、腐熟期均检测到,而在对照组未检测到。
接种、加碱组中放线菌纲微生物多样性(10~16、5~13属)均高于对照组(3~6属)。
2.3.3 γ-变形菌纲
肠杆菌目(Enterobacteriales)和假单胞菌目(Pseudomonadales)是γ-变形菌纲的主要目。经历47 d的堆肥后,肠杆菌目占γ-变形菌纲蛋白质的比例在接种组(从53.78%到26.97%)和加碱组(从67.24%到32.62%)中明显降低,对照组却从堆肥起始的27.10%上升到42.11%。假单胞菌目占γ-变形菌纲蛋白质的比例在不同堆肥组也表现出完全不同的变化趋势,整个堆肥期间,在加碱组(13.79%~30.50%)和接种组(25.90%~31.46%)中均增加,然而对照组从堆肥起始的42.06%下降到15.79%。在γ-变形菌纲中,假单胞菌属(Pseudomonas)、埃希氏杆菌属(Escherichia)、布赫纳氏菌属(Buchnera)、耶尔森氏菌属(Yersinia)和军团菌属(Legionella)都能分泌乙酸和丙酸降解关键酶。在升温期,接种组全部检测到这5个属,加碱组检测到3个属,对照组检测到4个属;相对丰度在接种组中(28.70%)明显高于加碱组(12.19%)和对照组(18.92%)。在高温期,接种组检出3个属,加碱组检出全部5个属,对照组仅检出1属;相对丰度在接种组中(16.92%)明显高于加碱组(10.50%)和对照组(1.79%)。在腐熟期,接种组检测到全部5个属,加碱组检测到3个属,对照组检测到4个属;相对丰度在接种组中(9.00%)和加碱组中(9.23%)相似,在对照组中最高(14.43%)。可见,在升温、高温期,接种AAMC可显著提高乙酸和丙酸降解菌相对丰度;在腐熟期,对照组乙酸和丙酸降解菌相对丰度较高,这表明在腐熟期堆肥物料酸化可能仍然是对照组的主要问题。
2.3.4 α-变形菌纲
根瘤菌目(Rhizobiales)是α-变形菌纲的优势类群,占α-变形菌纲蛋白质的40.00%~73.33%。不同堆肥组根瘤菌目相对丰度具有相似的变化趋势,在高温期明显降低,表明高温对根瘤菌目细菌群落具有筛选作用。与加碱组的持续下降相比,接种和对照组根瘤菌目相对丰度在腐熟期有所恢复。在α-变形菌纲中,慢生根瘤菌属(Bradyrhizobium)、红假单胞菌属(Rhodopseudomonas)和立克次氏体(Rickettsia)能分泌乙酸和丙酸降解关键酶。在不同堆肥组,此3个属相对丰度均处于较低水平(0~3.50%),这表明α-变形菌纲中乙酸和丙酸降解菌可能不是克服堆料酸化抑制问题的关键菌株。
在升温期,接种组α-变形菌纲细菌种类明显比加碱和对照组丰富,然而加碱和对照组之间没有明显差异;在高温期,微生物多样性排序为加碱组>接种组>对照组;在腐熟期,接种和加碱组微生物多样性明显高于对照组。
2.4 真菌演替规律分析
真菌群落组成见图4。79.03%~89.09%的真菌群落集中在酵母纲、散囊菌纲、裂殖酵母纲和粪壳菌纲。其中,酵母纲相对丰度最高(34.48%~64.17%),表明酵母纲是堆肥处理过程中主要的真菌群落,这与GU等[21]的研究结论一致。在加碱和对照组中,酵母纲相对丰度在高温期先降低,在腐熟期再升高,表明高温对酵母纲真菌具有筛选作用。接种组变化趋势则完全不同,酵母纲在高温期表现出最高的相对丰度,这表明接种AAMC可克服高温对酵母纲的筛选效应。
注:1—其他;2—担子菌纲(Basidiomycota);3—柄锈菌纲(Pucciniomycetes);4—毛霉菌目(Mucorales);5—球囊菌纲(Glomeromycetes);6—锤舌菌纲(Leotiomycetes);7—银耳纲(Tremellomycetes);8—盘菌纲(Pezizomycetes);9—新美鞭菌纲(Neocallimastigomycetes);10—小孢子虫目(Microsporidia);11—肺孢子菌纲(Pneumocystidomycetes);12—伞菌纲(Agaricomycetes);13—座囊菌纲(Dothideomycetes);14—黑粉菌纲(Ustilaginomycetes);15—粪壳菌纲(Sordariomycetes);16—裂殖酵母纲(Schizosaccharomycetes);17—散囊菌纲(Eurotiomycetes);18—酵母纲(Saccharomycetes)。图4 真菌种群组成Fig.4 Fungal community compositions
酵母属(Saccharomyces)是优势真菌属,占酵母纲蛋白质的29.03%~58.82%。LIU等[17]952表明,在酵母纲中,51%的蛋白质来自于酵母属。在升温、高温期,接种组中酵母属相对丰度(10.01%、15.28%)均低于加碱组(29.21%、20.93%)和对照组(18.89%、25.00%)。酵母属能分泌乙酸和丙酸降解关键酶,此结果表明,酵母属对克服接种组早期酸化问题的贡献较小。在腐熟期,加碱、对照、接种组中酵母属相对丰度分别为29.99%、23.64%、16.67%。
假丝酵母属(Candida)也可分泌乙酸和丙酸降解关键酶。不同堆肥处理假丝酵母属相对丰度均呈先降低后升高的趋势。在升温期,接种组中假丝酵母属相对丰度(5.56%)与对照组(5.56%)无明显差异,加碱组中较低(4.49%),这些结果也表明,假丝酵母属对缓解接种和加碱组堆肥早期酸化现象的贡献较小。CHOI等[22]发现,在50 ℃恒温条件下,克鲁维酵母菌属(Kluyveromyces)可降低堆料酸性,增加嗜热菌的数量。本研究发现,在高温期,克鲁维酵母菌属相对丰度在接种组中(11.46%)明显高于加碱组(1.16%)和对照组(0),这可能是接种组高温期具有较高温度的原因。
3 结 论
(1) 接种AAMC和添加化学缓冲剂均可规避由于堆料酸化导致的堆体温度升高延滞问题,接种、加碱组分别在第5、6天即可满足固废无害化标准。
(2) 元蛋白质组学数据显示,83.9%~94.1%的细菌群落集中在γ-变形菌纲、芽孢杆菌纲、放线菌纲、α-变形菌纲、β-变形菌纲、δ-变形菌纲和梭菌纲。79.03~89.09%的真菌群落集中在酵母纲、散囊菌纲、裂殖酵母纲和粪壳菌纲。
(3) 接种组放线菌纲相对丰度较大(7.28%~27.00%),加碱、对照组则分别为3.66%~6.12%、2.70%~10.71%。接种AAMC可显著提高乙酸和丙酸降解菌相对丰度和微生物多样性。
