差速离心法提取血小板来源的外泌体及其鉴定
2021-08-02陈文科操龙斌陈雨薇冯杰娥
陈文科,操龙斌,陈雨薇,冯杰娥
南方医科大学南海医院医学检验科,广东佛山 528244
多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中,主要分布于细胞上清液,例如血浆、血清等。外泌体内含有丰富的蛋白质、mRNA等,因此能够广泛参与细胞间的物质交换。人体正常状态下,血液中血小板来源的微粒占据所有微粒的70%以上。近年来,成分输血逐渐引起了医学界的重视和关注,成为了治疗肿瘤患者的重要措施,外泌体不仅在细胞间信息传递发挥着重要作用,而且在肿瘤治疗、药效研究等众多领域具有关键作用[2]。对于血小板来源外泌体的提取与鉴定的研究具有重要价值,对于日后血小板的研究具有借鉴指导意义[3]。该次于2020年6—9月期间,方便选取实验样本100份展开研究,现报道如下。
1 材料与方法
1.1 检测仪器
该次实验所需的检测仪器以及试剂:超速离心机:WX100;离心水平转头:SW32TI;透射电镜:LVEM25;全能型化学发光成像系统;血小板震葛仪:PL-11;BCA蛋白质定量试剂盒;HSP70抗体ALXI抗体。
1.2 样本来源
方便选取该市血站2019年内献血志愿者捐赠的单采血小板,献血者均符合中华人民共和国卫生部所规定的献血者健康标准,检验合格后在血小板震荡仪上进行保存留用[4]。
1.3 样本处理
选择当天采集的同一单采血小板样本,分A、B、C、D、E共5组,3袋/组, 其中A、B组分别标为A1、A2、A3、B1、B2、B3号。A组在血小板振荡器上存放1 d后进行提取,B组在血小板振荡器上震荡存放3 d后进行提取;C、D、E组在振荡器存放1 d,离心,C组上直接提取外泌体,D组(不加任何试剂)、E组(加入5%的DMSO)-80℃冻存3 d后提取外泌体[5]。
1.4 外泌体提取
①将震荡的血小板装入15 mL无菌离心管中,4℃,500 g离心力条件下离心10 min,弃沉淀;
②将上一步离心所得的上清装入新的15 mL无菌离心管中,4℃,1 500 g离心力离心10 min,弃沉淀[6]。
③将上一步离心所得的上清液装入新的15 mL无菌离心管中,4℃,3 200 g离心15 min,可见血小板沉淀至管底,弃上清。
④将上一步离心所得的沉淀用1 mL PBS溶液重悬,再装入新的1 mL无菌离心管中,加入0.1 U/mL凝血酶,37℃孵育15 min,得到完全激活的血小板。
⑤将激活的血小板4℃,3 200 g离心15 min,可见血小板沉淀于离心管底,取上清[7]。
⑥将上一步离心所得的上清液放入1 mL无菌离心管中,用预冷的PBS溶液1 mLA重悬后,4℃,110 000 g离心力条件下离心90 min,弃上清后,用200 L的PBS溶液重悬,-80℃保存备用[8]。
1.5 外泌体鉴定
1.5.1 透射电镜检测外泌体形态及大小 取分离提取的外泌体各20μl重悬液于塑料薄膜上。将铜网状物翻转到液滴表面,放置10 min[9]。然后,将铜网状物转移到1%的戊二醛液滴中,液体慢慢地被滤纸吸收,用双蒸馏水滴将铜网清洗3次,3 min/次,再用滤纸将铜网上的液体慢慢吸收,此时液体不能完全吸收干净,对此使用白炽灯照射10 min。等铜网充分干燥时将铜网转移到样品区,并在80 kV透射电子显微镜下观察[10]。
1.5.2 免疫印迹法验证 首先,选取之前分离备好的外泌体20μl,两管分别加入体积相同的RIPA细胞裂解液(含1%PMSF),裂解30 min后进行离心操作,时长5 min。随后取适量上清液加人适量的4×蛋白上样缓冲液,煮沸10 min。取处理后外泌体样本各10μl于12%SDS-PAGE凝胶上电泳,结束后转移蛋白至PVDF膜上,采用200 mA的恒定电流,转膜80 min[11]。转膜结東后,用5%脱脂奶粉封闭PVDF膜2 h,再加入HSP70抗体ALXI抗体一抗。摇床上孵育1 h,再TBST洗膜4次,每次清洗4 min加二抗,最后在膜上加入适量ECL化学发光液,并用全能型化学发光成像系统分析即可。
1.5.3 外泌体总蛋白浓度测定 取分离提取的外泌体各20μl,并分别加入20μl RIPA细胞裂解液(含1%PMSF),冰上裂解30 min,1 000 rpm离心5 min;分别取25μl新鲜配置的BSA标准液和处理后外泌体样本,加入到96孔板中;再每孔加入200μl新鲜配置的BCA工作液;加盖,37C孵育30 min,在562 nm处检测各孔的吸光度值后换算。
2 结果
2.1 透射电镜下外泌体的形态
随着保存时间的增加,单采血小板来源外泌体的含量也在增加。见图1。

图1 透射电镜下血小板源外泌体的形态
2.2 外泌体免疫印迹法验证结果
血小板来源外泌体蛋白标志验证。见图2。

图2 血小板源外泌体蛋白标志验证
2.3 不同保存时间对单采血小板来源外泌体的蛋白浓度的影响
实验样本100份。存放3 d的血小板源外泌体蛋白质的浓度为(1 096.1±10.5)μg/mL,存放1 d的的血小板源外泌体蛋白质的浓度为(709.5±9.5)μg/mL,存放时间长的血小板来源外泌体的蛋白质浓度明显高于存放天数短的。差异有统计学意义(t=273.030,P<0.001),见图3。未冻存组蛋白浓度(1 820.1±10.5)μg/mL明显高于不含DMSO冻存组(1 155.3±2.5)μg/mL和含5%DMSO冻存组(1 402.5±6.2)μg/mL,差异有统计学意义(t=615.930、342.470,P<0.05),见图4。

图3 不同保存时间的血小板源外泌体总蛋白提取量
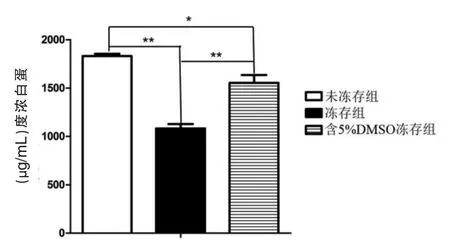
图4 不同样本保存方式下血小板源外泌体总蛋白提取量
3 讨论
外泌体的提取方式有许多,其中超速离心法提取物的提取纯度比较大,提取量可观,同时便于操作且成本低廉,因此该研究采用超速离心法进行提取,对于影响单采血小板来源外泌体的影响因素进行了探讨,其他方式不予探究。
在外泌体的提取过程中,处理提取纯度,提取量也是关键问题。在该次实验中,首先研究了不同存放时间对于血小板来源外泌液的影响,实验结果得存放3 d的血小板源外泌体蛋白质的浓度为 (1 096.1±10.5)μg/mL,存放1 d的的血小板源外泌体蛋白质的浓度为(709.5±9.5)μg/mL,显示存放1 d的单采血小板的外泌液浓度明显低于存放3 d的(P<0.05)。程骁赪等人[11]研究结果显示存放3 d的血小板源外泌体蛋白质的浓度为(1 100.4土9.6)μg/mL,存放1 d的的血小板源外泌体蛋白质的浓度为(707.3±9.6)μg/mL。表明实验结果较为准确。这是由于在存放过程中,血小板不断释放外泌液。也就是随着存放时间的增加,血小板活化增加,释放的微粒也随之增加[12]。
在医学操作中,所有样本不可能做到取样后直接完全采取使用,因此冻存样本是必不可少的过程,但是目前还没有关于冻存对样品的影响相关方面的报道。所以,在该次研究中进行了关于冷冻条件对外泌液提取产量的影响,实验结果表明,经过冷冻处理的样本其外泌体提取产量会明显少于冷冻之前。其原因是冷冻后融化会导致外泌体破裂,超速离心法又难以得到破碎后的外泌体,使得提取产量严重较少。细胞冻存是细胞培养、引种、保种和保证实验顺利进行的重要技术手段。DMSO是一种常见的细胞冻存液的组成成分,DMSO在4℃时对细胞无明显毒性,分子量小、溶解度大、易透过细胞膜,降低细胞外未结冰溶液中溶质浓度,使细胞免受高浓度溶质的损伤,细胞内水分也不会过分外渗,避免了细胞过分脱水皱缩;DMSO与水分子结合,可使冰点下降,减少细胞内冰晶的形成,从而减少冰晶损伤。在该次研究中加入5%的DMSO能够有效保护细胞,提升血小板分泌液提取物产量。
综上所述,样本保存时间越长,外泌体的提取量越多;冷存处理会降低外泌体的提取量,而DMSO能够有效保护细胞。该次研究对于血小板来源外泌体提取与鉴定的影响因素做出了指示,为日后线管工作的开展指明了道路。
