Kcnh6点突变单基因糖尿病家系的小鼠模型构建及表型分析
2021-07-31熊枫然张英超谢荣荣赵儒轩杨金奎
熊枫然 卢 晶 张英超 谢荣荣 赵儒轩 李 奇 杨金奎
(首都医科大学附属北京同仁医院内分泌科 糖尿病防治研究北京市重点实验室 北京市糖尿病研究所,北京 100730)
糖尿病是由多种病因引起的以慢性高血糖为临床特征的代谢性疾病。糖尿病在中国是一个重要的健康问题,成年人中的患病率从2007年的9.7%上升到2017年的11.2%,中国的糖尿病疾病负担在持续增加[1]。世界范围内,糖尿病病例数已超过4亿,据估计将会在2030年达到5亿[2]。糖尿病已经成为严重威胁人类健康的重大公共卫生问题。
本课题组[3]在前期工作中发现了1个KCNH6钾通道杂合突变的糖尿病家系。KCN基因(human ether-a-go-go related gene)家族编码的KCN通道属于电压门控钾通道(voltage-gated potassium channel,Kv)中的一员,在调节人和小鼠胰岛β细胞胰岛素分泌方面起着至关重要的作用。KCN钾通道家族有3种亚型: KCNH2、KCNH6、KCNH7,他们在Kv家族中排名 11位,因此又被称为Kv11家族[4]。研究[5]显示,KCNH2通道突变的患者患有2型长QT间期综合征(long-QT syndrome)且有胰岛素分泌水平升高的表现。但KCNH6参与胰岛素分泌的具体机制及与糖尿病发病之间的关系还知之甚少。
前期研究[6]中使用转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALEN)技术删除了Kcnh6基因的19个碱基对,构建了KCNH6基因敲除小鼠模型。为了更精确地研究KCNH6的作用,把基因突变控制在单个碱基上,完全模拟糖尿病家系中的单基因位点突变,排除大段基因编辑可能引入的混杂因素的影响。CRISPR/Cas9系统是近年来新兴的一种基因定点编辑工具,它最初是细菌用来对抗病毒入侵的一种防御机制,包括成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)及临近相关基因(CRISPR-associated gene,Cas)。该技术已经成功运用于细菌、水稻、小鼠、大鼠、斑马鱼等物种的基因编辑与改造[7]。小向导RNA(small guide RNA,sgRNA)是一段人工设计的RNA复合体,它可以通过碱基互补配对靶向定位到含有前间隔序列邻近基序(protospacer adjacent motif,PAM)序列(即NGG)的待编辑的目标DNA片段附近[8]。Cas9蛋白是一种能与sgRNA结合的特殊的核酸内切酶,在sgRNA的定位作用下,细胞基因组DNA双链将会被Cas9精确剪切,在此基础上如果为细胞引入一个携带靶片段同源臂和突变位点序列的模板质粒(供体DNA),被打断的DNA双链将会通过同源重组修复机制、按照所提供的模板在修复过程中实现片段插入(knock-in,KI)或定点突变[9]。
本研究采用CRISPR/Cas9技术成功构建了Kcnh6基因定点突变小鼠,为进一步研究糖尿病发病机制提供了动物模型。
1 材料与方法
1.1 实验动物
实验所用的小鼠均为C57BL/6J品系,体质量18~24 g,购自南京集萃药康生物科技有限公司,实验动物许可证号:SYXK(苏)2018-0027。小鼠饲养于北京大学医学部SPF级实验动物中心,恒温恒湿,12 h光照,12 h黑暗,自由采食。实验所使用的所有动物均经过首都医科大学附属北京同仁医院动物委员会批准。
1.2 根据靶序列设计sgRNA及供体DNA质粒
从NCBI小鼠基因组网站得到Kcnh6基因(Gene ID:192775)的序列和结构信息。遵从CRISPR/Cas9介导的基因组定点突变靶点设计原则,根据小鼠Kcnh6基因第5个外显子序列进行分析,设计得到两段sgRNA序列(靶点序列:5′-CTGCTAGGAAGACCGGTCTATGG-3′;5′-GAAGCCATGGGTGGTCAGTGGG-3′)。根据sgRNA序列设计含有靶片段同源臂和定点突变的供体DNA质粒,设计策略见图1。
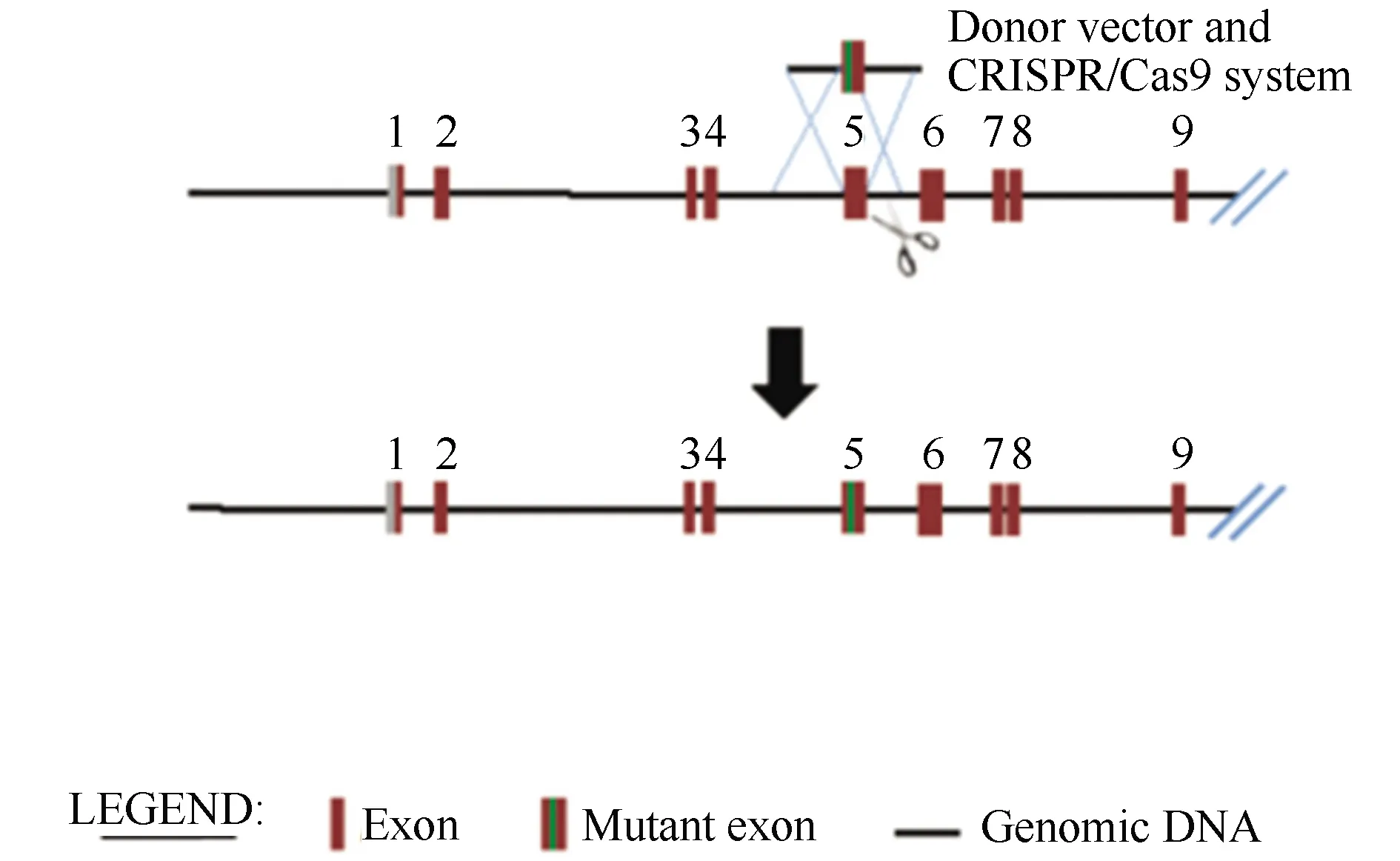
图1 CRISPR/Cas9设计策略Fig.1 Design strategy of CRISPR/Cas9
1.3 小鼠基因型的鉴定
剪取小鼠尾尖0.5 cm置于1.5 mL的EP管内,加入400 μL裂解液和1 μL蛋白酶K储存液,将上述EP管置于55 ℃恒温水浴锅水浴过夜,待消化完全,使用酚/氯仿法抽提基因组DNA。下列反应物构成20 μL的反应体系:模板DNA 2.0 μL,10×缓冲液 (含Mg2+) 2.0 μL,dNTP 混合物(10 mmol/L) 0.5 μL,引物混合物(10 mol/L) 0.5 μL,DNA聚合酶(5 U/μL) 0.5 μL,超纯水14.5 μL。PCR反应条件:预变性95 ℃ 5 min;变性95 ℃ 30 s;退火58 ℃ 30 s;延伸72 ℃ 30 s;共40个循环,最后再延伸70 ℃ 10 min,之后25 ℃保存。PCR之后通过琼脂糖凝胶电泳进行鉴定。制备2%(质量分数)琼脂糖凝胶,取PCR反应终产物5 μL进行电泳,135 V,20 min。电泳后利用凝胶成像系统进行电泳图片分析。为进一步验证,将PCR产物进行TA克隆测序(测序由诺赛基因公司完成)。
1.4 显微操作和F0代鉴定
将上述sgRNA、Cas9及供体DNA质粒共同注射入小鼠受精卵胞质,存活受精卵移植入假孕小鼠子宫,经发育、分娩得到F0代小鼠。取小鼠尾尖进行PCR扩增,利用初筛引物筛选出突变基因插入的样品,排除未插入的阴性样品。选择其中的雄性阳性小鼠样品进行测序确认。
初筛引物:Nicemice-TF: 5′-AACATCTGCGAGATGATTTGTGAG-3′; Kcnh6-Donor-5′out-tR1: 5′-GTGGTTCGGAAGTTGATGAC-3′。
1.5 繁育纯合突变小鼠
将含KI片段的雄性F0代小鼠与野生型C57BL/6J雌性小鼠进行繁育,得到F1代小鼠。经PCR扩增及测序筛选出F1 代杂合子,然后以基因型为杂合子的F1代小鼠作为亲本,交配繁育得到F2代小鼠,再对F2代小鼠进行基因型鉴定,筛选出纯合基因KI小鼠,从而完成纯合突变群体的建立。
引物:Kcnh6-Donor-5′in-tF1:5′-CATCAGATATCCTGCATGTC-3′;Nicemice-TR:5′-CTCACAAATCAT- CTCGCAGATGTT-3′;Nicemice-TF:5′-AACATCTGCG- AGATGATTTGTGAG-3′;Kcnh6-Donor-3′in-tR1:5′-CTATGGCCCATATGGAAATC-3′。
1.6 小鼠分组
根据喂养饲料不同,将繁育鉴定完成的纯合小鼠分为两组:普饲组以普通饲料喂养,高脂组以高脂饲料喂养。每组内再根据小鼠基因型不同分为两组:点突变组和野生型组。分别在小鼠4、8、12周测量小鼠体质量。
1.7 小鼠腹腔葡萄糖耐量实验(intra-peritoneal glucose tolerance test,IPGTT)及第一时相胰岛素浓度测定
小鼠禁食12~14 h后,腹腔注射20%(质量分数)葡萄糖溶液,注射体积为小鼠体质量(g)×10 μL,用固定器固定小鼠,分别测定葡萄糖负荷后0、15、30、60和120 min时小鼠尾静脉血糖浓度。血糖测定用美国强生公司One-Touch血糖仪及配套试纸。
小鼠禁食12~14 h后,腹腔注射20%(质量分数)葡萄糖溶液,注射体积为小鼠体质量(g)×10 μL,于0、2、5、15、30 min自眼眶静脉丛采血。4 ℃,3 000 r/min 离心10 min后,收集血清。采用小鼠超敏胰岛素ELISA试剂盒(美国Millipore公司)测定血清胰岛素浓度。
1.8 小鼠原代胰岛细胞提取及纯化
颈椎脱臼法处死小鼠后,将小鼠置于无菌手术台并用75%(体积分数)乙醇消毒。打开腹腔并暴露胆总管,左手持弯镊夹闭胆总管,右手持注射器沿胆总管逆行注射约3 mL胶原酶P消化液(1 mg/mL)。待胰腺充分膨胀后,摘除胰腺组织置于含4 ℃预冷胶原酶P消化液的15 mL离心管中。在37 ℃恒温培养箱消化10 min至呈泥沙样,立即向离心管加入10 mL预冷的终止液[90%(质量分数)HBSS+10%(质量分数)FBS]终止消化,4 ℃,300 g离心5 min,弃上清,重复2次。弃上清后,依次缓慢加入2 mL 25%,1 mL 23%,1 mL 21%和1 mL 13%的Ficoll溶液,4 ℃,2 500 g 离心20 min。吸取13%~21%Ficoll层面细胞沉淀物,加溶液重悬,4 ℃1 000 g离心5 min洗涤2次。将离心后产物加入含有10%(质量分数)胎牛血清的1640培养基,并保持在37 ℃孵箱[95%(体积分数)O2/5%(体积分数)CO2]培养。
1.9 葡萄糖刺激的胰岛素分泌(glucose stimulated insulin secretion,GSIS)
12孔板中,每孔15个胰岛,加入含有2.8 mmol/L葡萄糖的Krebs-Ringer碳酸氢盐缓冲液(Krebs-Ringer bicarbonate buffer, KRBB)平衡30 min,吸去平衡液,加入含有2.8 mmol/L葡萄糖的KRBB溶液,37 ℃孵育1 h,吸取上清,每孔分别加入含有16.7 mmol/L葡萄糖的KRBB溶液,37 ℃孵育1 h,吸取上清。采用小鼠超敏胰岛素ELISA试剂盒(美国Milipore公司)测定上清液中胰岛素浓度。
1.10 统计学方法
2 结果
2.1 成功构建Kcnh6基因敲入点突变小鼠模型
将sgRNA、Cas9 mRNA、供体DNA质粒的混合物通过显微注射注入小鼠受精卵胞质中,将受精卵移植入假孕小鼠子宫,经发育、分娩得到124只F0代小鼠。对这124只小鼠进行DNA提取,用初筛引物进行PCR扩增,通过琼脂糖凝胶电泳分离鉴定,筛选出45只突变基因插入的样品,排除其他未插入的阴性样品(图2)。再对初筛阳性样品中15只雄性小鼠样品进行测序确认,得到10只基因KI点突变阳性F0代小鼠,测序结果见图3。
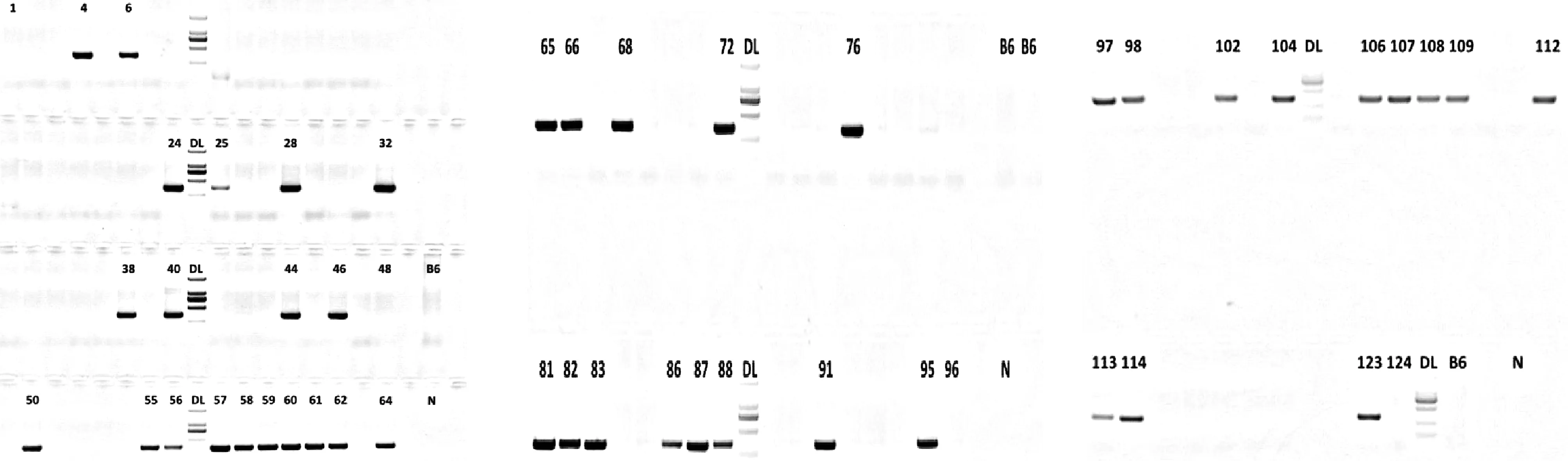
图2 F0代小鼠插入序列PCR扩增产物电泳图Fig.2 Electrophoretic pattern of inserted sequence polymerase chain reaction(PCR) amplification product from F0 generation mice
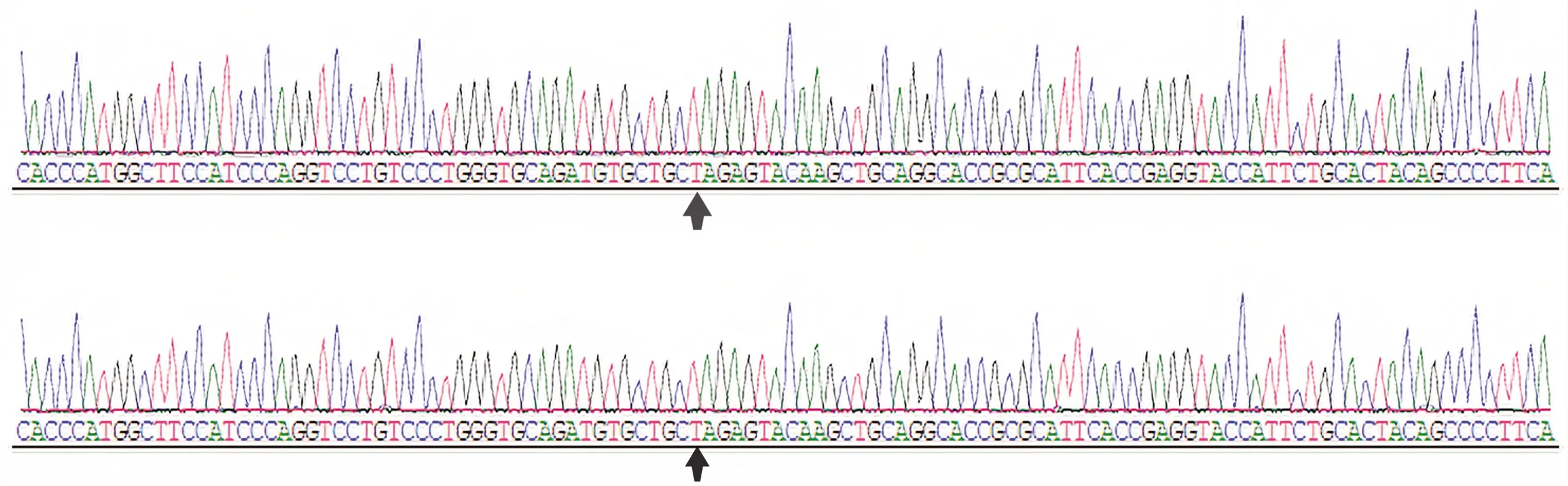
图3 F0代小鼠基因测序Fig.3 Gene sequence of F0 generation mices Arrow represent the specific mutant site.
10只KI阳性F0小鼠与野生型雌鼠交配得到F1,经PCR扩增及测序鉴定得到KI阳性F1代杂合子小鼠(图4)。F1与F1交配繁育得到F2,鉴定出纯合基因敲入(KI)点突变纯合小鼠(图5)和纯合野生型小鼠,用于后续实验。
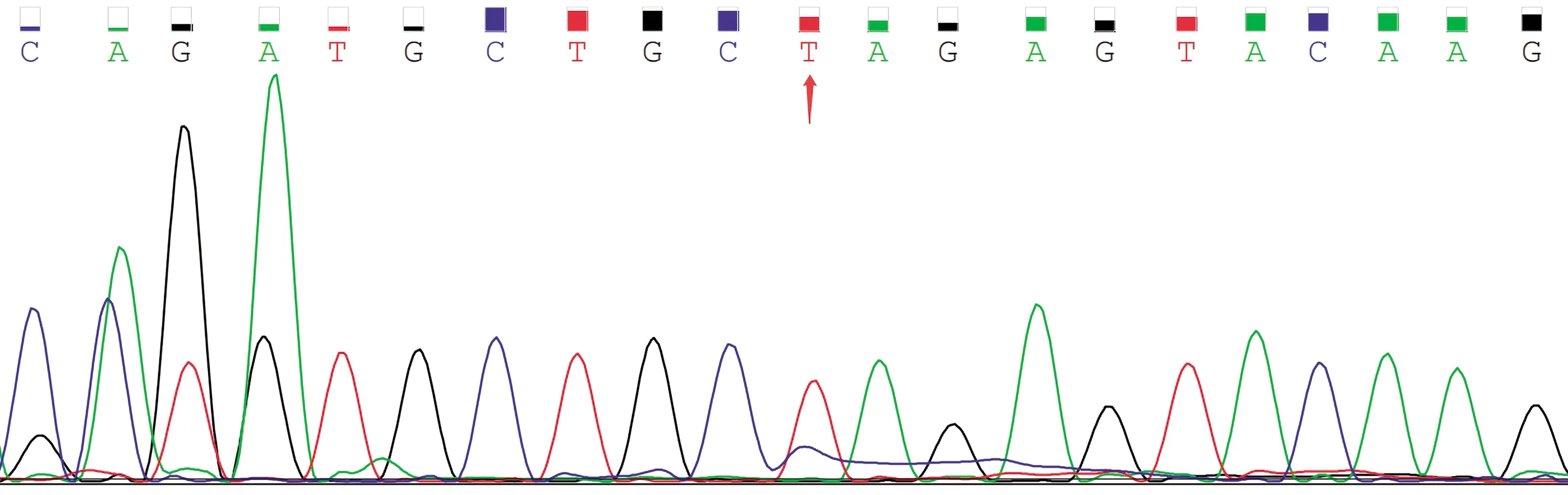
图4 F1代杂合子小鼠基因测序Fig.4 Gene sequence of F1 heterozygous mices Arrow represent the specific mutant site.
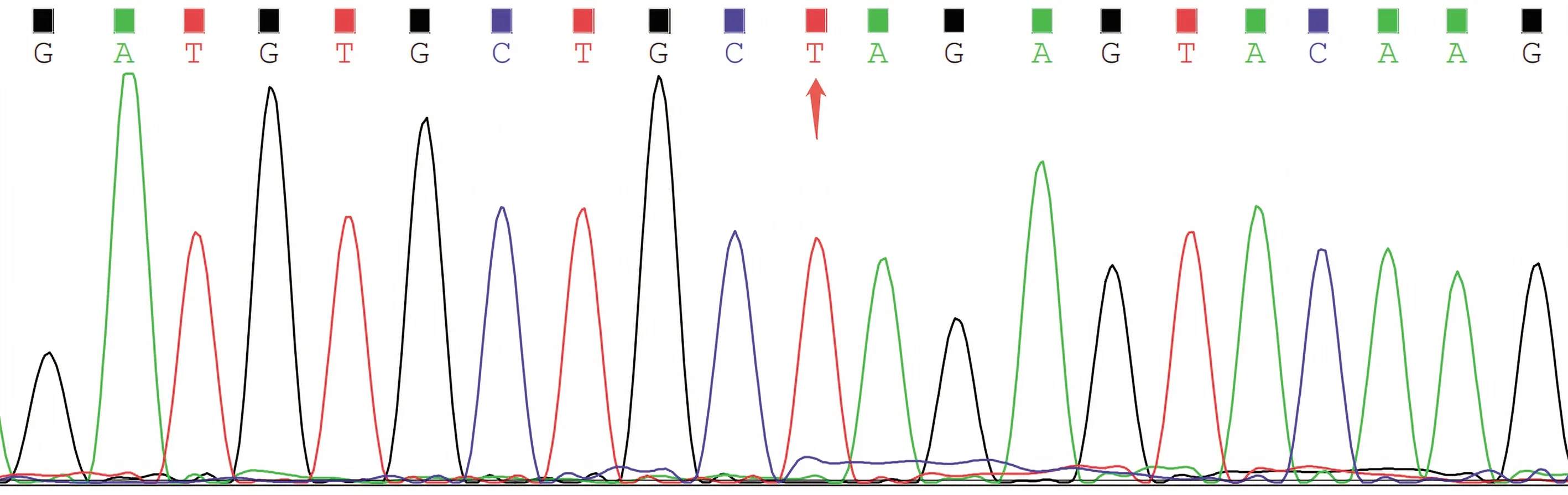
图5 F2代纯合子小鼠基因测序Fig.5 Gene sequence of F2 homozygous mices Arrow represent the specific mutant site.
2.2 Kcnh6基因敲入点突变小鼠与C57BL/6J野生型小鼠体质量监测
两组小鼠体质量均随喂养时间均稳定增长,普饲组中点突变组和野生型组小鼠体质量未见明显区别,组间差异无统计学意义(P>0.05);高脂组中点突变组小鼠体质量在第4周时比野生型小鼠低,在第8周、第10周超过野生型小鼠,组间比较差异有统计学意义(P<0.05),详见图6。
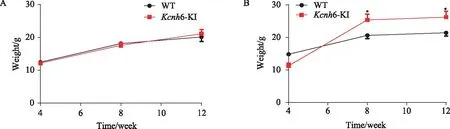
图6 体质量监测Fig.6 Weight monitoring A: standard diet; B: high fat diet; n=6, *P<0.05 vs WT group; WT: wildtype; Kcnh6-KI: Kcnh6 knock-in.
2.3 Kcnh6基因敲入点突变小鼠经高脂喂养后糖耐量和胰岛素分泌功能受损
分别对高脂饲养的24周龄的Kcnh6基因插入点突变(KI)小鼠和野生型(WT)小鼠进行IPGTT实验,Kcnh6 KI小鼠血糖水平在糖负荷后15、30、60、120 min均高于野生型小鼠,且在60 min时差异有统计学意义(P<0.05)。但同周龄普通饲的Kcnh6基因插入点突变(KI)小鼠和野生型(WT)小鼠IPGTT比较,差异无统计学意义(P>0.05)(图7)。
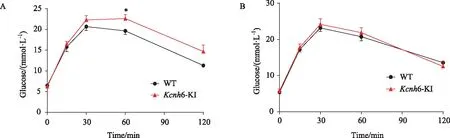
图7 腹腔内注射葡萄糖耐量实验 Fig. 7 Intra-peritoneal glucose tolerance test A: high-fat diet; B: normal chow diet; n=8,*P<0.05 vs WT group; WT: wildtype; Kcnh6-KI: Kcnh6 knock-in.
分别测量高脂饲养的28周龄Kcnh6 KI小鼠与WT小鼠的第一时相胰岛素分泌水平。Kcnh6 KI小鼠在糖负荷后2 min和5 min的胰岛素分泌水平明显低于WT小鼠,差异有统计学意义(P<0.05)。为进一步研究Kcnh6点突变对胰岛功能的影响,在体外对小鼠原代胰岛做了葡萄糖刺激的胰岛素分泌实验,Kcnh6 基因点突变抑制了小鼠胰岛在高糖刺激下的胰岛素分泌,组间比较差异有统计学意义(P<0.05)(图8)。

图8 胰岛素分泌功能Fig. 8 Insulin secretion functionA: the first phase of insulin secretion(n=6); B: glucose stimulated insulin secretion test(n=6); *P<0.05, **P<0.001, ***P<0.0001 vs Kcnh6-KI group; WT: wild type; Kcnh6-KI: Kcnh6 knock-in, KI: knock in.
3 讨论
胰岛素生物作用的绝对或相对不足是糖尿病代谢紊乱的中心环节。胰岛素分泌受多种因素调节,其中血糖是调节胰岛素分泌最重要的因素。以ATP敏感钾通道(ATP-sensitive potassium channel,KATP)为开关的葡萄糖刺激的胰岛素分泌(glucose stimulated insulin secretion,GSIS)的具体机制已较为清楚:进入胰岛β细胞的葡萄糖与血糖水平成正比,进入细胞后葡萄糖经一系列氧化过程在线粒体产生ATP,使ATP/ADP比例增加[10],进而导致β细胞膜ATP敏感钾通道(KATP)关闭[11],使细胞膜去极化,激活电压门控L型钙通道,导钙离子内流增加,触发胰岛素释放[12-13]。
本课题组[3]在前期工作中发现了1个KCNH6钾通道杂合突变的糖尿病家系,家系中新生儿表现为低血糖症和高胰岛素血症,成年人均表现为糖尿病或糖耐量异常。KCNH6钾通道属于Kv,研究[14]显示,电压门控钾通道能影响葡萄糖刺激的胰岛素分泌过程。课题组前期采用TALEN技术成功构建了Kcnh6基因全身性敲除(global knock out)小鼠动物模型,发现敲除小鼠存在糖耐量异常[6],验证了除ATP敏感钾通道(KATP)以外,Kv同样参与了胰岛素分泌的调控,且发挥着重要作用。前期构建基因敲除小鼠所使用的TALEN技术删除了Kcnh6基因的19个碱基对,造成移码突变,从而使基因丧失原有功能。而与基因大段敲除不同,本研究所采用的KI方法可以精确控制单个碱基对的突变,能完全复制出现在人类糖尿病家系中的Kcnh6基因点突变,排除了大段基因编辑可能引入的混杂因素的影响。
所以为了更精确地研究Kcnh6参与糖尿病发病的具体机制,在本研究中利用CRISPR/Cas9技术,经过反复筛选、繁育最终获得了纯合Kcnh6基因KI点突变小鼠。对成功构建的小鼠模型做了一系列初步实验,包括体质量监测、腹腔葡萄糖耐量实验(intra-peritoneal glucose tolerance test,IPGTT)、第一时相胰岛素浓度测定和葡萄糖刺激的胰岛素分泌实验(glucose stimulated insulin secretion,GSIS)。结果发现Kcnh6 KI小鼠在普通饲料喂养条件下,体质量、糖耐量与野生型小鼠相比差异无统计学意义,但在高脂饲料喂养的诱导下,Kcnh6 KI小鼠出现了体质量增高、糖耐量及胰岛素分泌受损的表现,成功复制了人类糖尿病的临床表型。
本次研究证实了Kcnh6基因在胰岛素分泌和糖尿病发病过程中的重要作用,但还未具体探究Kcnh6发挥作用的具体机制。Kcnh6基因P235L位点点突变是否影响了钾离子通道的通道功能、是否影响了钾通道蛋白的亚细胞定位还不得而知,后续可以利用膜片钳、免疫组织化学染色等技术进一步验证和探究。本次研究所构建出的Kcnh6基因KI点突变小鼠模型可继续用于往后研究,为深入揭示Kcnh6基因在胰岛素分泌中的具体机制提供新的基础研究数据和实验结果。
