基于微流控技术实现严格厌氧条件下的细菌单细胞培养与实时观测
2021-07-30马智鑫邓宇芳李思宏黄术强
马智鑫 邓宇芳 于 跃 李思宏 梁 帆 夏 霖* 黄术强*
1(中国科学院深圳先进技术研究院 深圳合成生物学创新研究院 中国科学院定量工程生物学重点实验室广东省合成基因组学重点实验室 深圳 518055)
2(中国科学院大学 北京 100049)
1 引 言
近年来,得益于 DNA 测序技术的不断迭代优化,微生物组研究取得了蓬勃发展[1]。微生物培养方法是微生物相关研究的绝对基础,是不可绕开的关键一环[2]。传统的微生物培养方法包括选择培养法、平板单克隆培养法、基于密度/细胞尺寸筛选法和有限稀释法等,均为微生物实验室的常用基础方法。微生物学家通过各种培养方法能够获得特定细胞株系的纯培养,进而为各种细胞生理学实验提供准确而充足的研究对象。但由于某些微生物相关培养方法的缺失,大大阻碍了研究者对其一些基本属性的认知,进而影响到相关生态以及生物学现象的研究[3]。
传统细菌培养方法所得到的纯培养物,理论上应是来源于同一菌株,几乎不存在明显的遗传变异[4],通过对其进行测量能够获得许多生理学参数,包括生长速率、死亡率、细胞尺寸分布和基因表达强度等,也能够获得类似Monod 方程这样对工业生产有着一定指导意义的经验公式[5]。而随着对细胞生理状态噪声与随机波动相关研究的逐渐深入[6-7],研究者们越来越意识到细胞异质性的存在与重要性[8],即从某种角度来讲每个单细胞都可能与其他细胞有所区别。若要对细菌进行单细胞水平的培养与研究,则传统的群体培养方法已不能满足要求,需要开发新的实验培养技术[2]。
在细菌单细胞水平进行生理学研究的重要技术手段之一是利用基于微流控技术的高分辨显微镜延时拍摄方法[9]。其中,微流控技术可以实现单细胞培养,并且有着高度的可设计性和对实验条件的可控性[10];而显微镜延时拍摄方法则是在不影响细胞生理活动的前提下,实时采集各种参数,与“下一代细菌生理学技术”的理念高度符合[11]。目前相关技术的报道仍主要集中于常规条件的有氧培养,对于与人类健康息息相关的大量厌氧菌与兼性厌氧菌的厌氧生理学的研究则相对较少。该技术的主要难点在于既要确保培养装置的气密性,又要将整个培养系统(包括微流控装置、气体控制装置等)与相关商业化显微镜进行适配。此外,由于厌氧条件下细菌生长相对较慢[12],需要确保整个系统能够长期稳定的运行。
本研究提供了一种厌氧微生物培养与实时观测装置。该装置包括:底座、上盖、微流控芯片和培养液储存室。其中,培养装置上盖水平面上设有亚克力板或玻璃板视窗,与微流控芯片底部盖玻片相对设置,便于显微成像;培养基储液池上设有出液孔,可与微流控芯片相连为细胞培养提供充足的营养;培养装置上盖的侧壁上设有气体入口、气体出口和出液口,以便维持培养装置内的厌氧氛围、气压稳定以及液体的流通。该装置具有优异的气密性,能够为厌氧微生物提供长时间稳定的厌氧气体氛围且气体氛围可控;同时可以满足高通量、大范围多位点采样,高放大倍数拍摄等实验需求。
2 材料与方法
2.1 实验材料与主要设备
2.1.1 实验试剂
微流控芯片制作所用的材料与试剂如表 1 所示;细菌培养所用的材料与试剂如表 2 所示;单细胞实验所用的材料与试剂如表 3 所示。
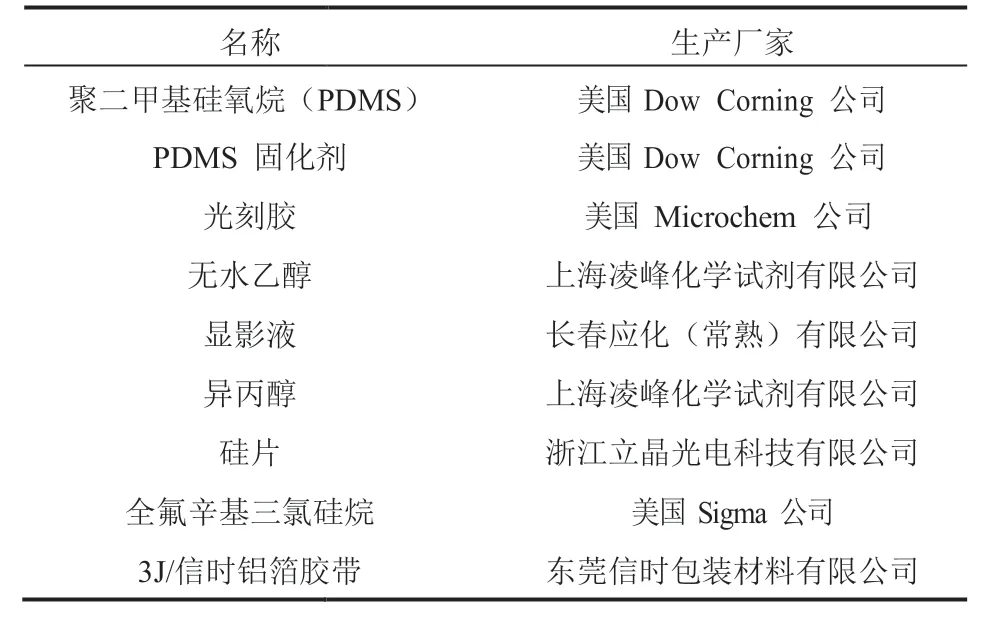
表1 微流控芯片相关实验材料与试剂Table 1 Experimental materials for microfluidics
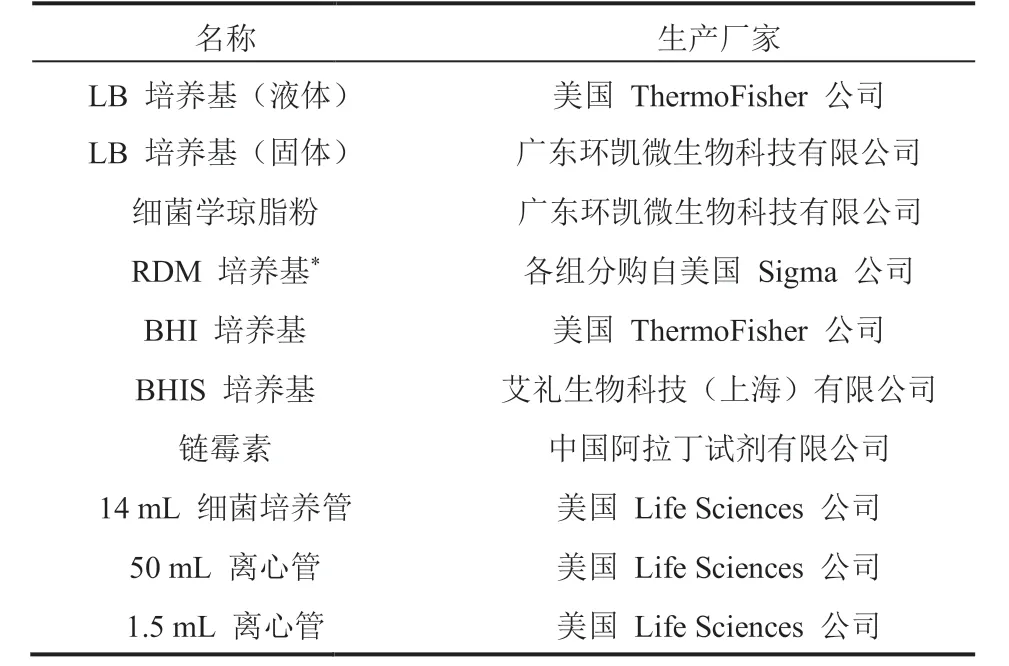
表2 细菌培养实验材料与试剂Table 2 Experimental materials for bacterial culture
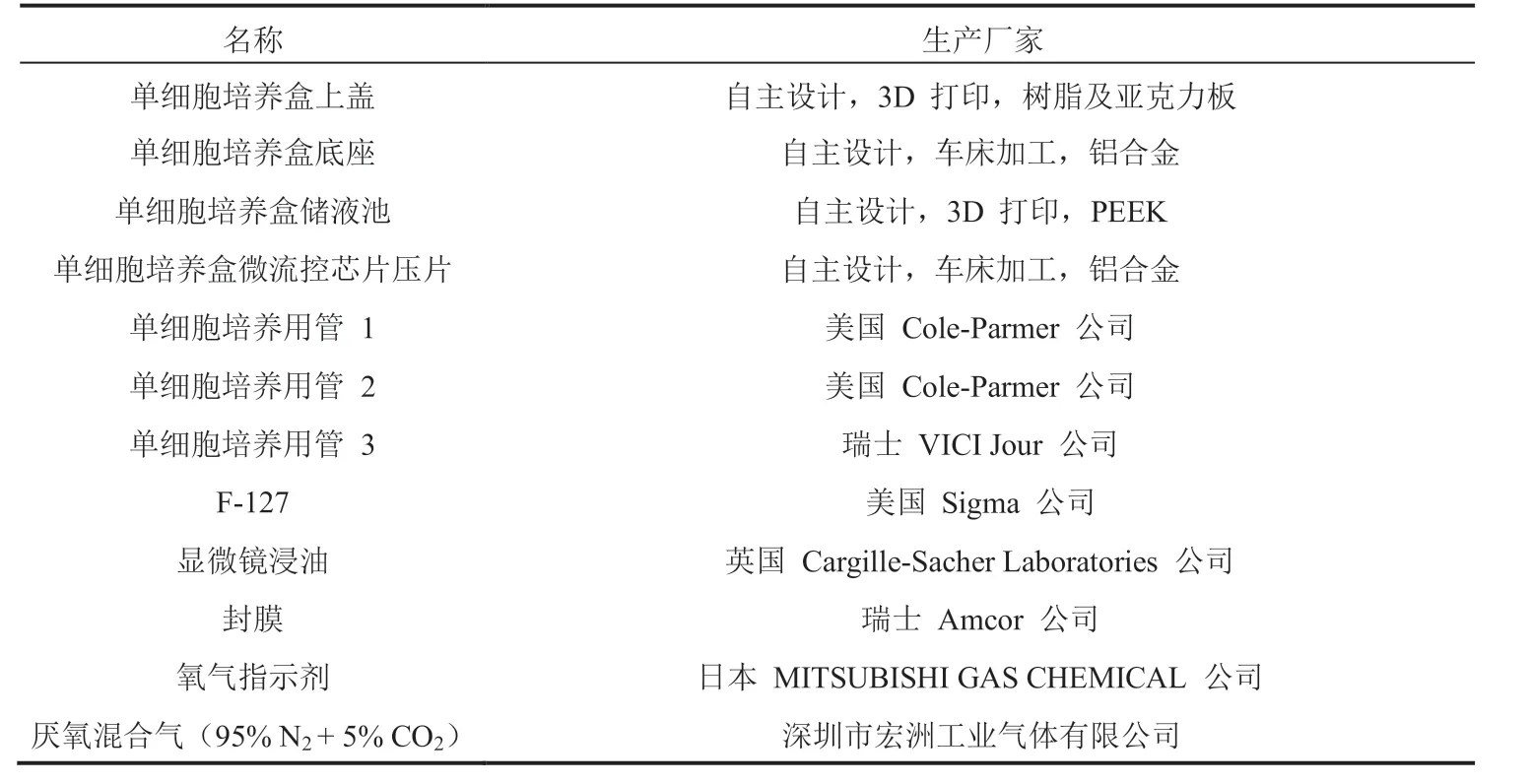
表3 单细胞实验材料与试剂Table 3 Experimental materials for bacterial culture
2.1.2 实验仪器与设备
本实验使用的仪器与设备如表 4 所示。

表4 仪器与设备Table 4 Instruments and equipments
2.1.3 实验菌株
本实验使用的菌株如表 5 所示。

表5 实验菌株Table 5 Bacterial strains for experiment
2.2 实验方法
2.2.1 微流控芯片的设计
本实验所使用的微流控芯片被称为母细胞芯片(Mother Machine)[14],即指其关键功能在于将细菌许多单个母细胞(Mother Cell)保持在固定位置持续生长,具体设计如图 1 所示。其中,图 1(a)中单细胞生长通道总数 4 000,宽度为 0.8~2.6 μm (以 0.2 μm 的梯度增加),高度为 1.2 μm,长度为 25 μm;培养基通道宽度为100 μm,高度为 100 μm,箭头表示其中液体培养基流动。采用聚二甲基硅氧烷(PDMS)制作的芯片整体封接在盖玻片(尺寸 24 mm×50 mm)上,具体内部结构处于 PDMS 与盖玻片之间:细菌细胞单层生长于较窄、较低的众多生长通道内,这些单细胞生长通道一端为封闭端,另一端开口与更宽、更高的培养基通道相接,培养基通道两侧开头通过持续不断的液体培养基流动,以及营养物质的扩散作用,为单细胞生长通道内的细胞提供源源不断的营养成分。在营养充分的条件下,通道内的细菌细胞随着时间推移逐渐沿着生长通道分裂生长为一条线,多余细胞通过分裂生长自然伸出生长通道,被培养基通道内的高速液体流动冲走。此时,处于生长通道封闭段的母细胞在微流控芯片内的相对位置不变,其营养条件也是稳定的,因而整个微流控芯片设计可被看作一种单细胞水平的微量培养恒化器。
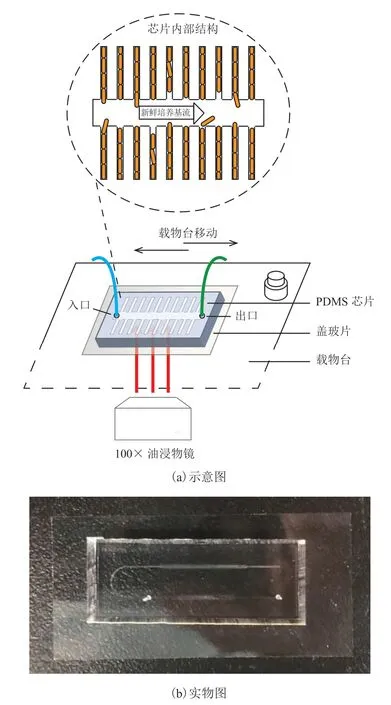
图1 母细胞芯片微流控芯片图Fig. 1 Mother machine as microfludics
2.2.2 硅片模板
(1)单细胞生长通道的制作
a. 准备 76.2 mm 的硅片,用低强度等离子处理 30 min。
b. 从冰箱中取出 SU-8 2002 光刻胶和 SU-8 2000.5 光刻胶,待光刻胶温度与室温一致时,按V(SU-8 2002)∶V(SU-8 2000.5)=8∶2(体积比)将两种胶在离心管中混匀。
c. 设定匀胶机程序:预甩 600 r/min,9 s;匀胶 4 000 r/min,30 s。
d. 将表面洁净的硅片置于匀胶机吸盘上,在硅片上添加室温混合胶 2 mL,运行程序。
e. 将硅片置于平整的热板上 95 ℃ 烘 2 min。
f. 在曝光机的吸盘周围套入橡胶圈,将第一层铬板掩膜清洁干净后放在台架上(镀铬面向下),并开启真空,将一块较大的锡箔纸盖在掩膜上。
g. 将硅片放在吸盘上,待冷却后推入(记录此时硅片的位置,确保在后续可以对准结构)。
h. 上升吸盘,用锡箔纸遮盖,执行真空曝光,观察真空表读数——如果漏气,则复位吸盘后再次上升,确保橡胶圈与掩膜贴合良好不漏气。
i. 曝光量为 70 mJ/cm2,需要根据曝光机的功率调整曝光时间。其中,预设曝光时间应长于真实曝光时间(如需曝光 4 s,则设置 30 s 曝光时间)。启动曝光时先用锡箔纸遮挡,当剩余时间等于需曝光时间时,快速撤下锡箔纸,结束曝光。
j. 曝光后于 95 ℃ 烘 1 min,取下硅片,冷却。
k. 用丙二醇甲醚醋酸酯(PM)显影液显影;随后用异丙醇冲洗残留显影液,接着用氮气吹干表面,于体视显微镜下观察显影效果。
l. 若显影后结构清晰,则用烘箱 180 ℃ 坚膜1 h,否则重复上一步。m. 冷却后取出,用台阶仪测量子通道高度并记录。
(2)培养基通道的制作
整体实验流程与上部分单细胞生长通道的制作相同,但需要修改一些具体的实验参数:使用SU-8 3025 光刻胶,离心 3 000 r/min,前烘30 min,需要进行校准使其与第一层对齐,曝光量为 150 mJ/cm2,后烘 5 min。
2.2.3 PDMS 芯片制作
(1)固定硅片模板
a. 将硅片模板用透明胶贴在玻璃板中间(勿贴到结构),同时在玻璃板四周竖着贴上锡箔胶带密封,防止倒入 PDMS 单体后在热固化时泄漏;
b. 将 PDMS 单体和引发剂以 10∶1 的质量比混合,搅拌(5 min)均匀,然后抽真空 15 min,再用洗耳球吹除表面剩余气泡;
c. 将上一步无气泡 PDMS 与引发剂的混合液体,适量倒入第(a)步制作好的贴有硅片模板的玻璃板容器内,放入烘箱内的水平台上,80 ℃、烘 30 min 以上。
也可以直接用无尘胶带将模板贴到玻璃板容器中间后,直接倒入 PDMS 和引发剂进行 PDMS芯片固化。
(2)PDMS 芯片固化
a. 将 PDMS 单体和引发剂以 10∶1 的质量比混合,搅拌(5 min)均匀后抽真空(10 min),最后用洗耳球吹除表面剩余气泡;
b. 根据硅片模板表面积及所需微流控芯片厚度计算 PDMS 和引发剂混合液体用量(这里芯片厚度约为 5 mm,PDMS 和引发剂混合液体需22 g 左右),倒在硅片模板上,整体放入烘箱,80 ℃ 烘 1 h 以上。
(3)PDMS 芯片切割
使用手术刀将固化好的芯片从硅片模板上切下,注意不要太靠近芯片结构,刀落到硅片上,切到底可见空气进入的痕迹,然后将芯片放在LED 灯上进一步切割。
(4)PDMS 芯片打孔
将 PDMS 芯片放在 LED 灯上操作,选择合适孔径(这里为 0.8 μm)的打孔器从结构面向下打,拔出时要小心缓慢,可双向旋转拔出,注意不要裂口,然后用氮气气流清理打好的孔(注意打孔器的针头最好频繁更换,以避免打孔时产生过多的 PDMS 碎屑对单细胞培养时产生堵塞通道,可在正式打孔前测试一下)。
(5)PDMS 芯片与盖玻片封接
a. 先用异丙醇清洗盖玻片,然后氮气吹除异丙醇液体;b. 用无尘胶带粘去 PDMS 芯片结构面灰尘及碎屑;
c. 将盖玻片和 PDMS 芯片结构面向上放置,一起进行等离子清洗——HI 档(18 W,气压266 Pa,气流 25 mL/h),2 min(等离子处理时间可调整,一般不要超过 2 min);
d. PDMS 芯片依靠重力贴在玻璃板上(多块芯片考虑排布以合理利用空间),若贴合过程迅速则表明等离子处理后 PDMS 芯片和盖玻片表面性质良好;
e. 贴合后的芯片放入烘箱 80 ℃ 烘 10 min。
(6)通道修饰及镜检
a. 将已过滤除菌的 1% F-127 水溶液,通过培养基通道入口缓慢注入芯片(戴护目镜),修饰至少 30 min;
b. 10 倍镜或 20 倍镜下检查芯片通道(是否完好)、打孔及封接情况,无误后放入厌氧工作站。2.2.4 单细胞实验
(1)细菌培养与预处理
在厌氧箱内进行平板划线,挑选 5 个单菌落于 3 mL 液体培养基内进行活化过夜,过夜培养所得的菌液与培养基按 1∶100 转接至 120 mL培养基培养至对数后期。用封膜封住离心管口后,将菌液以 5 000 r/min 离心 10 min。倒出上清液,重悬沉淀再次离心,以 5 000 r/min 离心5 min。使用含 0.01 g/mL F-127 的上清液重悬菌体,涡旋混匀。其中,固体培养基为 LB 琼脂(E. coli)和 BHI 琼脂(B. fragilis),液体培养基为RDM+glucose (E. coli)和 BHIS (B. fragilis)。
(2)细菌装载
将混匀的浓缩菌液注入芯片,采用无尘胶带贴上芯片出入口,将芯片固定在培养皿内,封膜,以 2 000~2 500 r/min 离心 5 min。在厌氧工作站内将芯片固定于自制厌氧培养盒内,密封好后架设到显微镜上,连接气路和液路。
(3)单细胞延时拍摄
待厌氧盒内氧气指示剂保持粉色,使用 100×油镜观察荧光场——若无可见荧光激发(E. coli),则开始选点进行延时拍摄。实验完成后,使用自主研发的相关软件进行图像处理与数据分析。
3 实验结果
3.1 厌氧程度评估
本实验体系的关键点在于单细胞培养时厌氧条件的维持,这里从培养气体氛围与细胞学水平证据(荧光蛋白激发)来进行评估。
3.1.1 气体氛围
厌氧培养盒在实验中会持续通入厌氧混合气——95% N2+5% CO2,以营造并长期维持盒内厌氧环境。其中,N2为模拟空气主要成分,生理意义不大,一定浓度的 CO2为细菌正常生长所必需[15]。该气体组成与常用的厌氧工作站基本相同,只是缺少 H2,而 H2在厌氧工作站的主要作用是便于在催化装置的作用下与 O2反应生成H2O 以达到除氧的目的,但由于厌氧培养盒并不像厌氧工作站一样体积巨大,需要时常取放实验物品或者进行实验操作而出现 O2进入的风险;反之,厌氧培养盒具有优秀的气密性,并且在整个厌氧培养实验中一直维持密封,整体组装也在厌氧工作站内进行,故无需除氧。
实验中,厌氧培养盒内放置有氧气指示剂,当盒内气体氛围达到厌氧状态时,氧气指示剂会维持粉色(图 2),表明此时厌氧培养盒内气体中O2浓度低于检测下限(≤0.1%)。这种状态会在厌氧盒密封并持续通入厌氧混合气时长期维持,只有在实验中切换所通入的气体,将厌氧混合气换成压缩空气时,指示剂才会较快地变为蓝紫色(超过检测上限 0.5%),表明厌氧培养盒内气体中的氧气浓度迅速提升至与空气相同。

图2 培养 48 h 后厌氧培养装置内氧气指示剂Fig. 2 Oxygen indicator in anaerobic box after 48 h
3.1.2 细胞水平
在细胞学水平,本实验采用荧光蛋白作为严格厌氧指示剂。荧光蛋白基因位于细菌染色体上,属于组成型表达基因,这意味着荧光蛋白在稳态生长的细菌细胞中始终处于动态平衡状态[16]。而作为常规的荧光蛋白,其成熟发光除了特定光激发之外,还有一个基础条件就是氧气的存在[17],除非是特定改造专门适用于厌氧环境激发的荧光蛋白[18]。
如图 3(d)所示,在有氧培养下,微流控芯片中细菌细胞表达的荧光蛋白受激发产生明显的荧光;而在厌氧培养下,虽然对明场延时拍摄图片的分析表明细菌细胞生长状态稳定(图 4(b),左半部分),但是细胞中的荧光蛋白在相应波长激发光激发下,并无明显的可见荧光产生(图 3(b),LUTs 打开增强敏感度,故视野并非黑白),说明此时细胞内氧气浓度不足以保证荧光蛋白成熟而受激发光。Hansen 等[17]研究表明,1×10-7浓度的溶解氧足以使荧光蛋白受激发产生荧光,而2.5×10-8浓度的溶解氧则不足以支持荧光蛋白受激发而发光。本实验结果表明,在厌氧培养盒持续通入厌氧混合气进行厌氧培养时,微流控芯片内溶解氧浓度至少低于 1×10-7,达到了优秀的严格厌氧程度,完全满足兼性厌氧菌与严格厌氧菌的厌氧培养,实际上 0.1% 的氧气组成已不会对一些严格厌氧菌的正常生长产生影响[12]。

图3 大肠杆菌厌氧及有氧条件下明场相差及对应荧光场图像(LUTs 打开)Fig. 3 E. coli under bright field and corresponding fluorescence photos under anaerobic and aerobic conditions (LUTs ON)
3.2 细菌单细胞稳定生长
在单细胞实验完成后,采用自主研发的分析程序进行图像分析与数据处理。通过对大量单细胞的生长速率进行分析可知(图 4):对于严格厌氧菌(B. fragilis),此实验方法可以保证其长期稳定地进行生长与分裂;对于兼性厌氧菌 (E. coli),此实验方法既可以提供厌氧环境确保厌氧稳定生长,又可以将通入的厌氧混合气改为空气使其实现常氧生长。
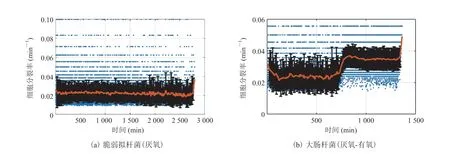
图4 芯片内细菌细胞在严格厌氧条件下稳定生长与分裂Fig. 4 The robust growth and division of bacterial cells in microfluidic chips under strictly anaerobic condition
4 结果与讨论
当下对细菌生理学的研究越来越关注单细胞的细胞异质性[8],如细菌群体中基因回路的动态表达[19]、细胞生理状态对抗生素的敏感性[20]、对细菌耐药性产生过程中起重要作用的持留性细胞[21]等。除了方兴未艾的微生物单细胞基因组和转录组研究外[22-23],往往仅采用传统的群体分批培养方法,而这在研究的时空“分辨率”上是远远不够的。基于微流控芯片的单细胞技术为研究细胞异质性提供了可能,这些方法中比较重要的一大类就是基于高分辨率显微镜的延时拍摄技术。对于在常氧条件下进行常规细菌培养,已经有许多相关培养方法,包括基于琼脂糖平板培养[24]、基于微流控芯片培养等[25-26],其中后者能够在保证稳定生长分裂前提下,实现上百代细菌的单细胞谱系追踪,但对于厌氧条件下的单细菌长期培养的研究甚少。
厌氧菌在自然界广泛存在,而且人体肠道本就是一种厌氧环境。现在普遍认为肠道微生物对人类的健康具有很大的影响[27-28],如疟疾[29]、肥胖[30]、糖尿病[31]、癌症的免疫应答[32]、神经(脑肠轴)[33]等,甚至有望基于肠道微生物进行个性化医疗[34]。基于此,在进行单细胞实验时,需要考虑到厌氧这一条件对细菌细胞生理的影响。针对以上需求,需要开发一种对培养环境氧气氛围有着严格控制的实验装置。无论是琼脂糖平板培养还是微流控芯片培养,在不需要控制氧气组成比例的前提下,所需实验空间都不大,可以便捷地与商业化显微镜标本夹相结合使用。但是,目前商业显微镜移动平台与细胞培养装置并不能营造厌氧环境,因为这需要额外提供具有优秀气密性的培养装置。这种装置需能够同时容纳单细胞培养微环境与液体培养基,在装置外还需要相应的气体调节与维持系统,最后为了方便实验数据的实时采集、提高数据可信度、降低实验复杂性、提高方法通用性,往往需要在设计时就考虑到培养装置与显微成像系统的合理适配。
目前涉及到厌氧条件的细菌单细胞方法的相关报道并不多,尤其是能够直接与显微延时拍摄相结合的方法只有基于原有设计[35]——在琼脂糖平板外添加密封装置并通入厌氧混合气,以此实现对一种厌氧的脱硫弧菌(Desulfovibrio Vulgaris Hildenborough)的培养。此外,借此研究了可逆的低浓度氧气暴露对细胞分裂的影响[36]。此方法由于是固体平板培养,存在营养消耗的影响,难以完美地保持稳定生长,而且所采集的数据量较少、难以追踪单细胞谱系。虽如文中所述,培养时细菌细胞内荧光蛋白无法受激发发出荧光,以此论证其实验装置的厌氧程度,但是针对“无荧光”这一关键要素并未提供实验结果支持。而实际上有研究表明,培养气体氛围中 0.1% 的氧气就足以满足荧光蛋白受激发光所需[12],在此氧气浓度下即便是严格厌氧菌,由于其对氧气有一定的耐受性,也可正常生长[12,37],故仅有严格厌氧菌生长的实验结果并不能说明其实验装置厌氧程度很高。
5 结 论
本文所描述的细菌单细胞实时观测系统主要创新之处在于使用了一种自主设计的厌氧培养装置。它是由 3D 打印和数控机床加工而来,内部承载微流控芯片和液体培养基,进行组装密封后,具有优异的气密性:氧气指示剂达到测量下限(0.1%),而细菌内荧光蛋白受激发无明显可见亮光,进一步证明细胞培养基中溶解氧浓度低于1×10-7。该装置可以适配商业化显微镜的适配器,又与气体调节系统相连,后者为装置内部持续通入厌氧气体,在负压的驱动下,新鲜液体培养基持续不断地为细菌细胞提供营养,最终能够确保芯片内所培养的细菌细胞在长期稳定的严格厌氧环境下进行生长与分裂(前提是细菌本身能够在厌氧环境下生长)。本文所开发的实验装置及相应的整套实验流程为严格厌氧条件下的细菌生理学研究提供了有力的技术支持。同时,由于整个实验装置出色的气密性,除了严格厌氧微生物培养,还可以定量化探究不同气体组成对特定微生物生长的影响。但本实验系统目前只能使用单一培养基进行微生物培养,尚不能满足一些需要切换培养基的特殊实验需求,希望未来的研究能对此进行优化。
