铜绿假单胞菌感染治疗现状
2021-07-30高艳梅黄亚佳
金 帆 高艳梅 黄亚佳 蒲 璐 夏 霖*
1(中国科学院深圳先进技术研究院 合成生物学研究所 深圳 518055)
2(中国科学技术大学 合肥微尺度物质科学国家研究中心 合肥 230026)
1 引 言
铜绿假单胞菌(Pseudomonas aeruginosa)是一种普遍存在的革兰氏阴性菌,是一种获得性的条件致病菌,广泛存在于环境中,可以从人体皮肤、医疗器械、空气、水和食物中获得。铜绿假单胞菌对维持生存的营养需求很低,可以在多种环境中生存,这种强的环境适应力和生存能力帮助其在医院等干燥、无生命的表面环境中存活 6 小时至 6 个月[1]。铜绿假单胞菌几乎可以感染人体的任何部位和器官,严重的急性或慢性感染将导致机体死亡[2]。停留在医疗器械和设备表面的铜绿假单胞菌,给需要使用插管、呼吸机等侵入性医疗器械的患者或皮肤烧伤患者带来重大的安全隐患。
铜绿假单胞菌很容易生成生物被膜从而帮助其在各种环境中定植[3]。生物被膜的生成使得细菌以群体的形式生活在胞外聚合物(Exopoly Saccharides,EPS)包裹的基质中,EPS 是由多糖、脂质、核酸和蛋白质组成的复合物。生物被膜可作为细菌群落与外部环境之间的屏障,阻碍宿主免疫细胞的吞噬作用以及抗生素等抗菌剂到达细菌从而提高单个细菌应对药物和不利环境时的生存力,增大了铜绿假单胞菌感染患者体内病原菌的清除难度,甚至直接导致一些患者体内的病原菌无法被完全清除[4-6]。目前针对铜绿假单胞菌感染,临床使用较多的仍是抗生素药物。伴随抗生素的过度使用,铜绿假单胞菌的耐药性问题不断加重,导致抗生素疗效变差甚至完全失效。
根据发病率、病死率、疾病的长期性、预防和治疗的现有选择、保健利用、社会影响等参数,铜绿假单胞菌已被列为监测和流行病学研究的最高优先事项。2017 年,世界卫生组织更是将铜绿假单胞菌列为迫切需要开发新抗菌药物治疗的细菌之一[7]。铜绿假单胞菌感染的治疗和预防一直都是研究者们比较关心的问题,近年来也在不断报道相应的治疗药物和方法。本文主要总结目前用于铜绿假单胞菌感染治疗的药物和方式,以及未来可能的新药物和新方式。
2 抗菌药物
2.1 抗生素
对感染铜绿假单胞菌的患者来说,多重耐药的铜绿假单胞菌的出现往往意味着治疗周期的延长和费用的增加,严重时甚至会导致患者死亡。对囊性纤维化(Cystic Fibrosis,CF)患者来说,这一问题尤其严重。CF 是一种由囊性纤维化跨膜调节因子(Cystic Fibrosis Transmembrane Regulator,CFTR)的氯离子通道 19 编码基因突变引起的隐性遗传病。由于 CFTR 蛋白通道分布广泛,所以 CF 影响多个器官,包括肺、胃肠道、肝脏、男性生殖道和胰腺等。CF 患者的主要并发症之一是呼吸道的慢性感染,此并发症主要由铜绿假单胞菌感染引起。对于呼吸道慢性感染铜绿假单胞菌的 CF 患者,机体内部的炎症反应配合外部抗生素的强化治疗仍无法根除呼吸道感染的铜绿假单胞菌,进而导致感染严重的患者需要进行肺移植手术甚至死亡[8]。
伴随着治疗过程中抗生素的频繁使用,铜绿假单胞菌超强的耐药性问题不容忽视。铜绿假单胞菌对抗生素的耐药性增强主要有以下原因:(1)铜绿假单胞菌本质耐药性和超强的耐药性产生能力:铜绿假单胞菌具有低渗透压的外膜以及12 个 RND (Resistance-Nodulation-Cell Division)家族外排泵,导致自身对很多抗生素敏感性低。而通过膜孔道蛋白低表达或丢失、产生修饰酶或灭活酶、改变药物作用靶点等方式,铜绿假单胞菌可对不同的抗生素产生耐药性。同时,通过转化、转导和接合将质粒、其他菌株的抗性基因转移到铜绿假单胞菌基因组中,同样增强了铜绿假单胞菌对不同抗生素的耐药性[9-11]。(2)暴露在抗生素亚抑制浓度:受生物被膜、细菌与细菌之间隔离等因素影响,临床使用的抗生素不能到达细菌或者在细菌周围达到足够的抑制浓度,使得暴露在亚抑制浓度的铜绿假单胞菌更容易产生耐药性[12]。(3)铜绿假单胞菌感染时细菌状态和感染部位营养成分:如感染后细菌是否生成生物被膜、生物被膜组成、细菌周围金属阳离子浓度、聚胺类化合物等诱因均会不同程度地导致铜绿假单胞菌对抗生素的最小抑菌浓度(Minimum Inhibitory Concentration,MIC)值改变,帮助细菌逃脱机体免疫和抗菌药物的杀伤。上述因素均不同程度地增强了铜绿假单胞菌的耐药性,进而导致使用常规的抗生素治疗铜绿假单胞菌感染越来越难[9,13]。
随着对铜绿假单胞菌对抗生素耐药性产生机理研究的不断深入,相应耐药性抑制剂不断研制出来。比如,包括铜绿假单胞菌在内的革兰氏阴性菌对 β-内酰胺类抗生素产生耐药性的主要机制是细菌可以产生各种 β-内酰胺酶。针对这一耐药机制,研究者们发现 β-内酰胺酶抑制剂可以抑制大部分细菌产生的 β-内酰胺酶,将其与 β-内酰胺类抗生素联合使用时,可以保护抗生素不被水解,在提高 β-内酰胺类抗生素抗菌活性的同时降低了细菌对 β-内酰胺类抗生素的耐药性。近年来,使用他唑巴坦作为著名的 β-内酰胺酶抑制剂和头孢菌素组合形成的广谱复合制剂(C/T)来治疗腹腔感染、尿路感染以及肺炎的研究屡见报道[14-16]。另外,亚胺培南/瑞来巴坦、头孢他啶/阿维巴坦等复合剂均对多重耐药的铜绿假单胞菌具有很好的杀菌作用。
随着研究者和医院工作者对新抗生素的探索和研究的不断深入,近年来已有一些新发现,其中具有高效清除能力和低耐药性的抗生素头孢地尔、多尼培南、普拉米星(Plazomicin)、POL7001、磷霉素等已用于临床[10]。虽然抗生素在处理各类细菌感染中效果显著,但抗生素的滥用和不当使用很可能引发药物副作用和多耐药菌的产生,而新抗生素的开发不仅费时,且其开发潜力也非常有限,故寻找新的抗菌药物或新的抗菌疗法,来代替抗生素或减少抗生素的使用十分必要。
2.2 有机酸
弱有机酸比强无机酸更易穿过细胞膜,因此弱有机酸具有良好的抗菌效果。目前弱有机酸已经在食品工业中被广泛用作防腐剂,同时也一直被小规模地用于治疗(如烧伤、糖尿病溃疡和术后伤口的感染)。局部使用硼酸、抗坏血酸、柠檬酸、水杨酸和醋酸等有机酸来消除铜绿假单胞菌的皮肤和软组织感染以及烧伤感染的工作都有报道[17-22]。例如:早在 1987 年,Kujath 和Hügelschäffer[23]就使用 3% 的硼酸治疗 30 例局部铜绿假单胞菌伤口感染的患者,平均不到 6 天就取得了良好的效果,且未观察到任何毒副作用,而使用抗生素治疗的效果甚微。2018 年,Youn等[24]研究发现,4% 硼酸溶液和乙酸的 1∶1 混合液对喹诺酮类抗生素耐药的铜绿假单胞菌的生物被膜具有较强的抑制作用。1998 年,Nagoba等[25]用 3% 的柠檬酸治愈了一例伤口感染铜绿假单胞菌且已对所有抗生素产生耐药性的严重电灼伤患者。1993 年,Sloss 等[26]用浓度为 0.5%~5%的醋酸,在两周内成功治愈了 14 位患者。2008年,Nagoba 等[27]用 3% 的乙酸成功治愈了 7 位伤口感染铜绿假单胞菌的患者,且从这些患者伤口分离出的细菌对 4 种或 4 种以上的抗生素均具有耐药性,但这些耐药菌均可被 3% 的乙酸抑制。2015 年,Kumara 等[28]探究了醋酸、抗坏血酸、硼酸三种酸对从伤口分离出的金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌的抑菌情况,结果发现,在处理 30 min 时浓度为 0.5%、0.75% 和1% 的抗坏血酸抑菌率分别为 93.7%、97.9% 和100%;而浓度为 0.5%、0.75 % 和 1% 的硼酸没有抑菌效果;浓度为 0.5% 的醋酸可以完全抑制铜绿假单胞菌。
目前有机酸仅是小规模的研究和使用,并且不同文献存在使用差异,因此其临床最有效的使用浓度仍无法确定。在一些临床治疗中,有的患者会出现过敏和强烈刺痛感而不得不停止使用有机酸治疗。但是在面对耐多药的铜绿假单胞菌时,单独使用廉价的有机酸或联合抗生素来治疗患者也是一种不错的选择。
2.3 抗菌肽
天然的抗菌肽是一类所有生命体抵抗细菌、真菌和病毒入侵中不可缺少的一部分,因此抗菌肽也叫宿主防御肽。大多数的抗菌肽具有正电性、高度两亲性以及广谱的抗菌性,还有一些多肽具有良好的抗生物被膜作用[29-31]。相比于传统抗生素的作用机制,大多数抗菌肽通过改变细菌膜的通透性直接作用于细菌,而另一些需要进入细菌从而与细菌体内组分结合发挥作用[32]。根据抗菌肽数据(http://aps.unmc.edu/AP)可知,目前发现的抗菌肽已经达到 3 000 多种。不同的序列、长度和结构丰富了抗菌肽的种类和作用机制[33]。
2.3.1 抗菌肽杀死铜绿假单胞菌
随着铜绿假单胞菌对多种抗生素的耐药性增强以及开发新抗生素难度的增大,使用抗菌肽替代传统的抗生素或者抗菌肽-抗生素联用,减少抗生素的使用来解决铜绿假单胞菌耐药性的研究不断被报道。
黏菌素作为最典型的天然抗菌肽是目前临床治疗重症铜绿假单胞菌感染的重要药物之一[34-35]。黏菌素几乎可以杀死所有的革兰氏阴性菌,且病原菌对黏菌素的耐药性较低。自 2002 年第一个从临床上分离出来的对黏菌素产生耐药性的铜绿假单胞菌被报道以来,此种铜绿假单胞菌仍然比较少见[36]。黏菌素自身已具有很强的抑菌效果,而与亚胺培南、哌拉西林、氨曲南、头孢他啶等抗生素联合使用后治疗效果更佳[1]。
Mahdi 等[37]从唾液乳酸杆菌中分离出唾液霉素 LHM,其热稳定性好、适应的 pH 值范围广且不含脂质和碳水化合物,是一种有良好抗菌潜力的 II 型细菌素,也在体内外实验中被证明可以预防和治疗铜绿假单胞菌尿道感染。
虽然天然抗菌肽具有良好的抗菌效果和水溶性、以及低的耐药性产生频率等特性,但由于一些天然抗菌肽对细胞的选择性较低,它们对很多真核细胞也有毒性。同时,天然抗菌肽的合成成本较高,其活性受到体内生理条件的显著影响,包括二价阳离子和聚阴离子的强烈拮抗作用,许多天然抗菌肽很容易被细菌或者宿主的蛋白酶降解。因此,很多天然抗菌肽在体内实验中的作用远远不及体外实验,使其在临床应用中受到相当大的限制[38]。
为解决天然抗菌肽的毒性、易降解以及稳定性问题,目前已有研究者基于研究天然抗菌肽电荷数、结构、作用机制等理性设计,合成了很多新的多肽类似物,以提高抗菌多肽的稳定性和抗菌性,并减少其细胞毒性[39-40]。Kim 等[41]通过将噬菌体中一种能够特异性结合铜绿假单胞菌 OprF 孔蛋白的靶向肽 PA2 添加到 GNU7 上得到一种融合肽 PA2-GNU7。融合肽通过特异性地识别铜绿假单胞菌 OprF 孔蛋白发挥对铜绿假单胞菌的靶向抗菌作用,并且几乎没有细胞毒性。Zhong 等[42]探究了几种合成的抗菌肽对临床分离的 20 种多重耐药的铜绿假单胞菌的抑菌效果,结果发现 IK8L 可以通过膜裂解导致铜绿假单胞菌死亡。对比临床使用的抗生素,IK8L 具有低诱导耐药性,并通过老鼠烧伤伤口模型证明IK8L 在发挥抗菌作用的同时产生的毒性甚微。Mwangi 等[43]通过氨基酸替换的方法构建并筛选出一系列基于 Cathelicidin-BF-15 的抗菌肽,发现其中一种由二硫键稳定的环肽 ZY4 在体内具有高稳定性(半衰期为 1.8 h),且对多重耐药的铜绿假单胞菌具有良好的清除作用。通过老鼠败血症感染模型也证明 ZY4 具有良好的抑菌能力,其不仅可以抑制铜绿假单胞菌肺部感染,还可以抑制该菌向靶器官传播。
2.3.2 抗菌肽清除铜绿假单胞生物被膜
铜绿假单胞菌在感染部位生成的生物被膜往往很难被完全清除——生物被膜不仅会提高单个细菌在环境中的生命力,而且会增强暴露在药物下细菌的耐药性。随着天然抗菌肽的不断出现以及合成抗菌肽的不断发展,研究者发现许多天然和合成的抗菌肽具有良好的消除铜绿假单胞菌生物被膜的能力[30-31,44-45]。
Yasir 等[46]将铜绿假单胞菌连续 30 天暴露在抗菌肽 Mel4 和环丙沙星中来诱导其耐药性的产生,最后发现 30 天后铜绿假单胞菌对环丙沙星耐药性增强了 64 倍而对抗菌肽未增加。环丙沙星在 4 倍 MIC 下不能抑制耐药细胞生物被膜的形成,而抗菌肽在 1 倍的 MIC 下即可清除 75%的生物被膜。因此,抗菌肽 Mel4 相比环丙沙星抗生素具有弱的耐药性诱导力,可以单独或和环丙沙星联用来帮助清除耐药菌生物被膜。虽然人体防御多肽 LL-37 具有弱的抗菌性,但在低于其 MIC 浓度时,LL-37 可以通过减少细菌附着,刺激抽搐运动,并影响两种主要的群体感应系统(Las 和 Rhl),导致生物被膜发育所必需的基因下调,从而有效地抑制现存和早熟的铜绿假单胞菌生物被膜的生成[47]。Hirt 和 Gorr[45]通过向原有的抗菌肽 GL13NH2 中增加 3 个带正电荷的赖氨酸得到了 GL13K,发现新的抗菌肽 GL13K 具有良好的铜绿假单胞菌生物被膜清除能力。2015 年,De La Fuente-Núñez 等[44]构建了 12 个氨基酸相关的 L-对映物、D-对映物以及反义的一类多肽衍生物,研究发现 D-对映体的抗菌多肽具有更好的抗生物被膜效果。其中,DJK-5、DJK-6 的抗菌多肽具有更好的抗铜绿假单胞生物被膜和清除铜绿假单胞生物被膜的效果,且在蜡螟实验模型中可以很好地预防铜绿假单胞菌感染[41]。
2.4 纳米材料
早在几个世纪前,银、铜等金属材质物品就已经被用作抗菌和抑菌材料。随着科学技术的不断发展,人们对这些金属材质物品的抗菌原理逐渐清晰。通过对金属及其氧化物的改造发现,相比于传统的金属材料,直径小于 100 nm 的金属离子及其氧化物纳米粒子的比表面积更大,抗菌、抑菌活性更高,并且金属纳米粒子抗菌过程中不需要与细菌表面特定受体结合,因此使用金属离子及其氧化物作为抗菌和抑菌材料时细菌难以产生耐药性。目前,银、铜、铁、锌、镓等金属离子及其氧化物均被证明具有较好的抑制铜绿假单胞生物被膜形成的能力[48-53]。
2014 年,Lee 等[52]对 36 种金属离子的抗铜绿假单胞菌生物被膜及抗铜绿假单胞菌毒力因子的能力进行研究发现,Ag+、Cd2+、Co2+、CrO4
2-、Fe2+、Ga3+、In3+、Pt4+、TeO32-和 Zn2+可以抑制铜绿假单胞菌绿脓青素的产生;Ag+、Cd2+、Co2+、CrO42-、Fe2+、Ga3+、Pt4+、Sc3+、TeO3
2-和 Zn2+可以显著抑制铜绿假单胞菌生物被膜的产生。随后对 Zn2+和 ZnO 纳米颗粒的抑制性能进行探究发现,两者可显著抑制铜绿假单胞菌生物被膜的形成以及绿脓青素、群体响应、脓毒素和溶血活性的产生,但不会影响浮游铜绿假单胞菌的生长。2019 年,Liao 等[49]通过实验探索发现,银纳米粒子对耐多药的铜绿假单胞菌的最小抑菌浓度和最小杀菌浓度值分别为1.406~5.625 µg/mL 和 2.813~5.625 µg/mL。通过蛋白质组学定量分析发现,银纳米粒子作用主要机制为氧化和抗氧化反应的不平衡导致细菌体内残留过量无法消除的活性氧(Reactive Oxygen Species,ROS)。
金属纳米粒子对包括耐多药的铜绿假单胞菌在内的革兰氏阴性菌以及革兰氏阳性菌均有良好的抑制作用,但是使用金属纳米粒子治疗同样会带来不容忽视的副作用。例如:ZnONPs 的摄入会导致铜和铁元素的摄入减少,而啮齿动物缺乏铁是文献中最常报告的贫血原因;纳米粒子引发的 ROS 和氧化应急会引起许多疾病的炎症反应,如肺部疾病和肝变性[53]。
3 抗菌药物载体
研究探索用于治疗多重耐药菌的新药物无疑是解决抗生素耐药性问题的最佳选择。但无论是新的抗生素、抗菌肽、纳米粒子还是一些蛋白酶,采用口服、注射等方式给药时很容易在药物还未到达治疗部位时就被降解,或与周围金属离子、脂质、糖基发生拮抗作用,使其疗效大打折扣甚至无法到达指定的治疗部位。因此,将抗菌药物负载在载体中,减少药物的损失和提高药物活性的研究也是十分的必要。
3.1 水凝胶载体
水凝胶是一种用物理或化学交联的聚合物链组成网状以包裹大量水的柔性三维多孔材料。水凝胶具有较高的比表面积、较好的结构可控性以及良好的生物相容性,一直以来都是最理想的生物材料。按照抗菌药物来源,具有抗菌功能的水凝胶可分为两大类:第一类本质抗菌的水凝胶,其主要是使用抗菌肽或者抗菌高分子聚合物自身直接形成的具有抗菌功能的水凝胶[54];第二类抗菌药物载体水凝胶即通过对自身没有抗菌功能的水凝胶进行表面修饰或者内部负载抗菌药物(无机金属离子、无机金属氧化物、纳米粒子、抗生素和抗菌肽)而得到的具有抗菌功能的水凝胶。使用水凝胶作为药物载体负载药物治疗时不仅能提高抗菌药物的抗菌活性、延长抗菌药物的活性时间,而且能减少病原菌对抗菌药物抗性的产生[55-58]。本小节主要列举近年水凝胶作为药物载体用于抗铜绿假单胞菌的相关研究。
护理人员应对职业性腰背痛防护知识有足够的认识,才能在保证自身安全的基础上有能力护理好患者,使护理质量无缝衔接,确保患者安全。因此,护士职业性腰背痛问题应引起医疗卫生管理部门和医院管理层的足够重视,在现阶段需采取多种方式加强护士的继续教育并且作为一种基本培训项目,提高护士的认知水平,及早进行教育与培训,预防职业性腰背痛的发生。合适而人性化的教育与培训对提高护士职业性腰背痛认知水平继而提高护理质量可以起到事半功倍的效果。
1998 年,DiTizio 等[59]研究了一种以由聚(乙二醇)-明胶水凝胶为基底负载环丙沙星的脂质体水凝胶。负载环丙沙星的水凝胶不仅可以在 7 天内均有环丙沙星释放,而且在 7 天的体外黏附实验中也证明了黏附在硅导管表面的铜绿假单胞菌完全被抑制。Al-Bakri 和 Mahmoud[60]将可以光诱导抗铜绿假单胞菌及其生物被膜的 DSPEAuNPs 负载在泊咯沙姆 407 水凝胶中,得到可以光控抗菌和抗生物被膜的水凝胶。如图 1 所示,Bodenberger 等[61]利用几种病原菌在生物被膜生成过程中可以与凝集素 B 特异性结合这一特征,在中间层加了抗菌肽的水凝胶表面修饰了凝集素 B。最终修饰后的水凝胶可以通过表面修饰的凝集素捕捉铜绿假单胞菌,并利用中间层抗菌肽将其杀死。Tao 等[62]通过反复冻融的方法将丝胶(Silk Sericin,SS)与聚乙烯醇(Poly(Vinyl Alcohol),PVA)反复冻融,制备了丝胶/聚乙烯醇(SS/PVA)水凝胶。实验表明,混合后的 SS/PVA 水凝胶具有负载和释放小分子药物及银纳米粒子的能力。细菌抑制实验和伤口感染模型表明,负载庆大霉素的 SS/PVA 水凝胶能有效抑制铜绿假单胞菌、金黄色葡萄球菌和大肠杆菌的生长。
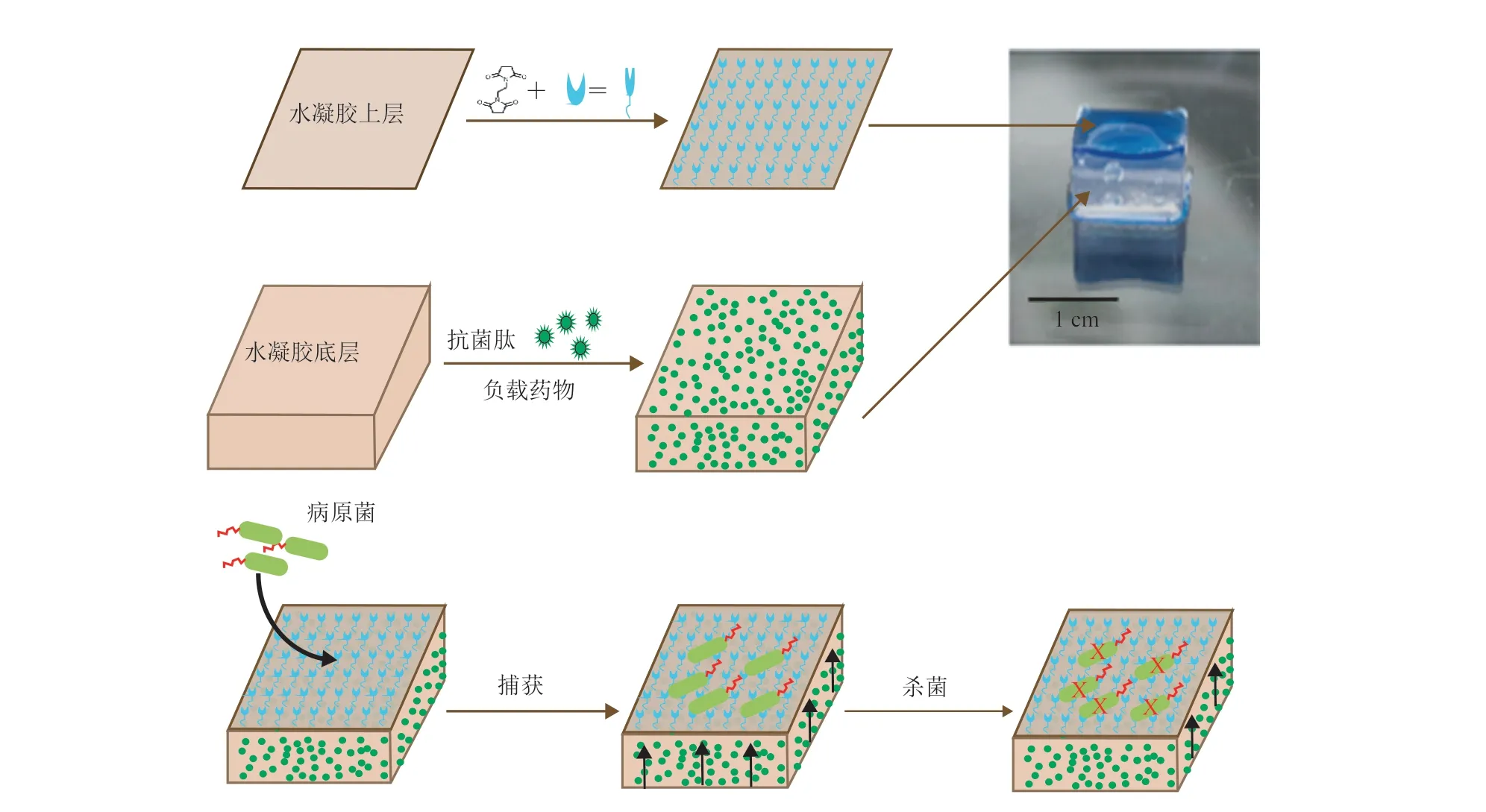
图1 凝集素修饰的复合水凝胶用来捕获和杀死耐碳青霉烯的铜绿假单胞菌示意图[61]Fig. 1 Lectin-functionalized composite hydrogels for “capture-and-killing” of carbapenem-resistant Pseudomonas aeruginosa[61]
3.2 细菌载体
随着合成生物学的不断发展,目前已经可以通过人工设计构建出多种功能的工程菌。利用细菌作为抗菌药物的生产母体和载体来治疗病原菌(铜绿假单胞菌、霍乱、沙门氏菌)感染的相关研究相继被报道[63-68]。利用细菌作为抗菌药物的生产母体和载体来治疗病原菌具有其他药物载体无法比拟的优点:(1)利用细菌来表达抗菌药物可以防止药物在血流中或在上消化道的运输过程中迅速降解;(2)细菌可以将治疗药物运送到体内细菌可生存但口服或肠外药物难以到达的部位,如结肠或肿瘤中心;(3)利用细菌来生产抗菌药物的成本低;(4)工程菌表达药物都是诱导性,因此可避免在非治疗情况下抗菌药物泄漏导致的耐药性问题,大大降低了病原菌对抗菌药物产生耐药性的概率。本小节主要列举利用合成生物学手段构建工程菌抗铜绿假单胞菌的相关研究。
2011 年,Saeidi 等[63]将铜绿假单胞菌群体响应 LuxR/LasR 系统、绿脓杆菌素 S5 以及 E7裂菌蛋白导入大肠杆菌 TOP10 中,如图 2(a)所示,工程菌响应铜绿假单胞菌群体响应小分子后开启绿脓杆菌素 S5 和 E7 裂解蛋白的表达,当细菌体内 E7 裂解蛋白达到一定浓度后可将工程菌裂解,同时释放抗菌蛋白。最终证明工程菌可以杀死近 99% 的铜绿假单胞菌,且对生物被膜的抑菌效率达到 90%。2017 年,Hwang 等[65]从三方面对 Saeidi 等[63]的系统进行改进,如图 2(b)所示:(1)将原本的载体菌株由大肠杆菌 TOP10换成了益生菌 Nissle;(2)在原有的响应裂解抗菌的系统中增加了抗生物被膜的酶 dspB,以进一步促进成熟的生物被膜瓦解,增强抗菌和抗生物被膜效果;(3)构建宿主载体互补系统。这些改进既保证了质粒在菌种中的稳定性,又防止了菌种通过基因水平转移功能从带有抗性的质粒上获得抗性基因,并且在线虫和老鼠肠道感染模型中,均证明了改进版的工程菌不仅可以消除铜绿假单胞菌感染,还可以预防铜绿假单胞菌感染。
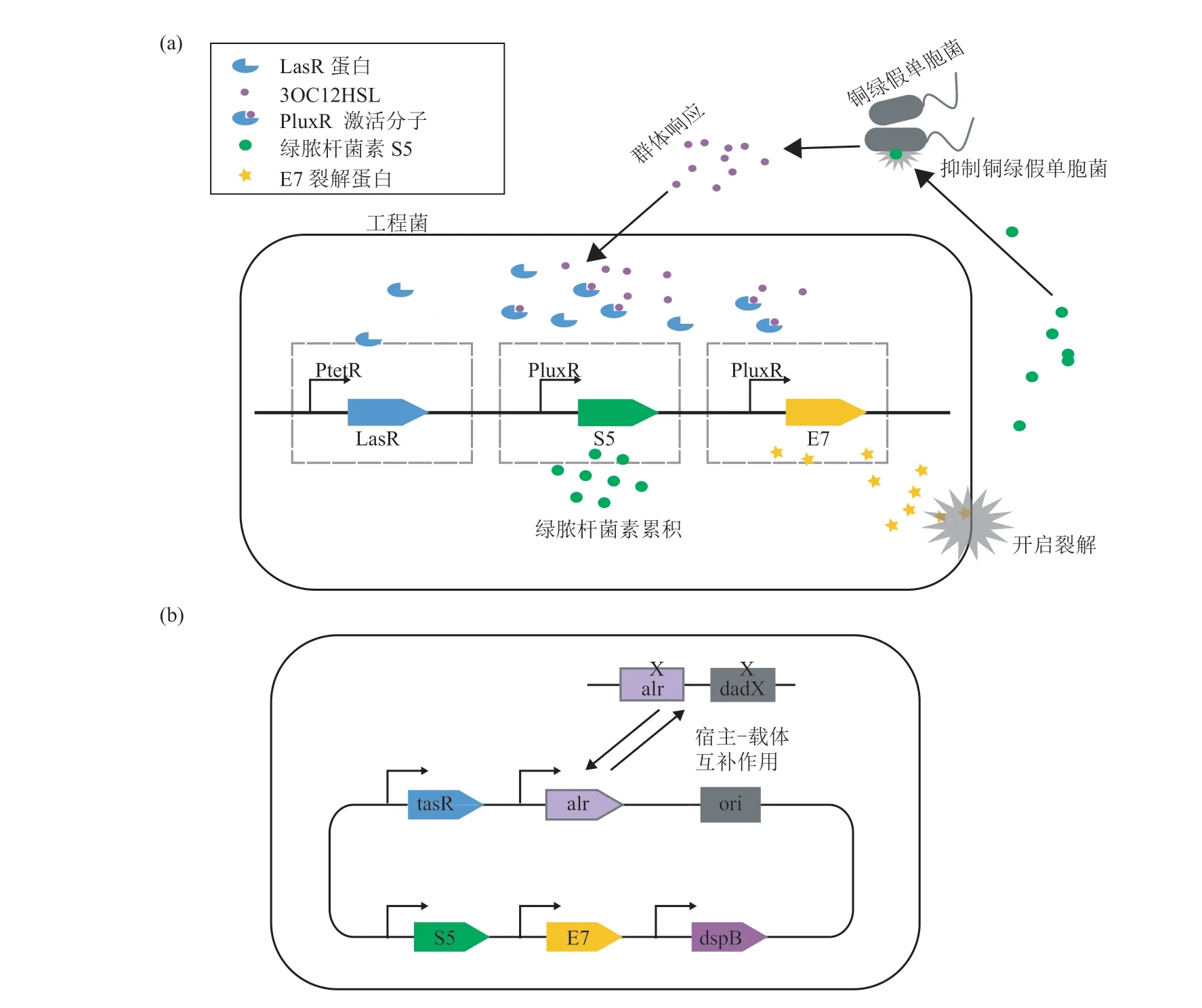
图2 (a) Saeidi 等[63]构建的工程菌基因回路和抗菌作用示意图;(b) Hwang 等[65]构建的工程菌基因回路示意图Fig. 2 (a) Schematic of engineered bacteria gene circuit and antibacterial eあect of Saeidi et al.[63]; (b) Schematic of engineered bacteria gene circuit and antibacterial eあect of Hwang et al.[65]
虽然工程菌表达绿脓杆菌素抑制铜绿假单胞菌生长具有很高的特异性,但是大多数铜绿假单胞菌自身都会表达绿脓杆菌素及其免疫蛋白。工程菌表达的绿脓杆菌素只能作用于不表达绿脓杆菌素免疫蛋白且细胞膜上含有绿脓杆菌素特异性受体的铜绿假单胞菌,最终导致工程菌作用范围很窄。2013 年,Gupta 等[64]通过将绿脓杆菌素 S3 的受体和转位结构域与大肠杆菌素 E3 蛋白的核酸和免疫结构域相融合得到新的抗菌蛋白CoPy,如图 3 所示。融合后的 CoPy 蛋白可以特异性地作用于任何细胞膜上含有绿脓杆菌素 S3受体的铜绿假单胞菌,较绿脓杆菌素 S3 可作用的菌株范围更广。同时通过将 CoPy 与鞭毛分泌标签 FlgM 融合表达,抗菌蛋白在工程菌不裂解的情况下经鞭毛分泌系统排出,解决了前面回路中工程菌裂解后内毒素的副作用。
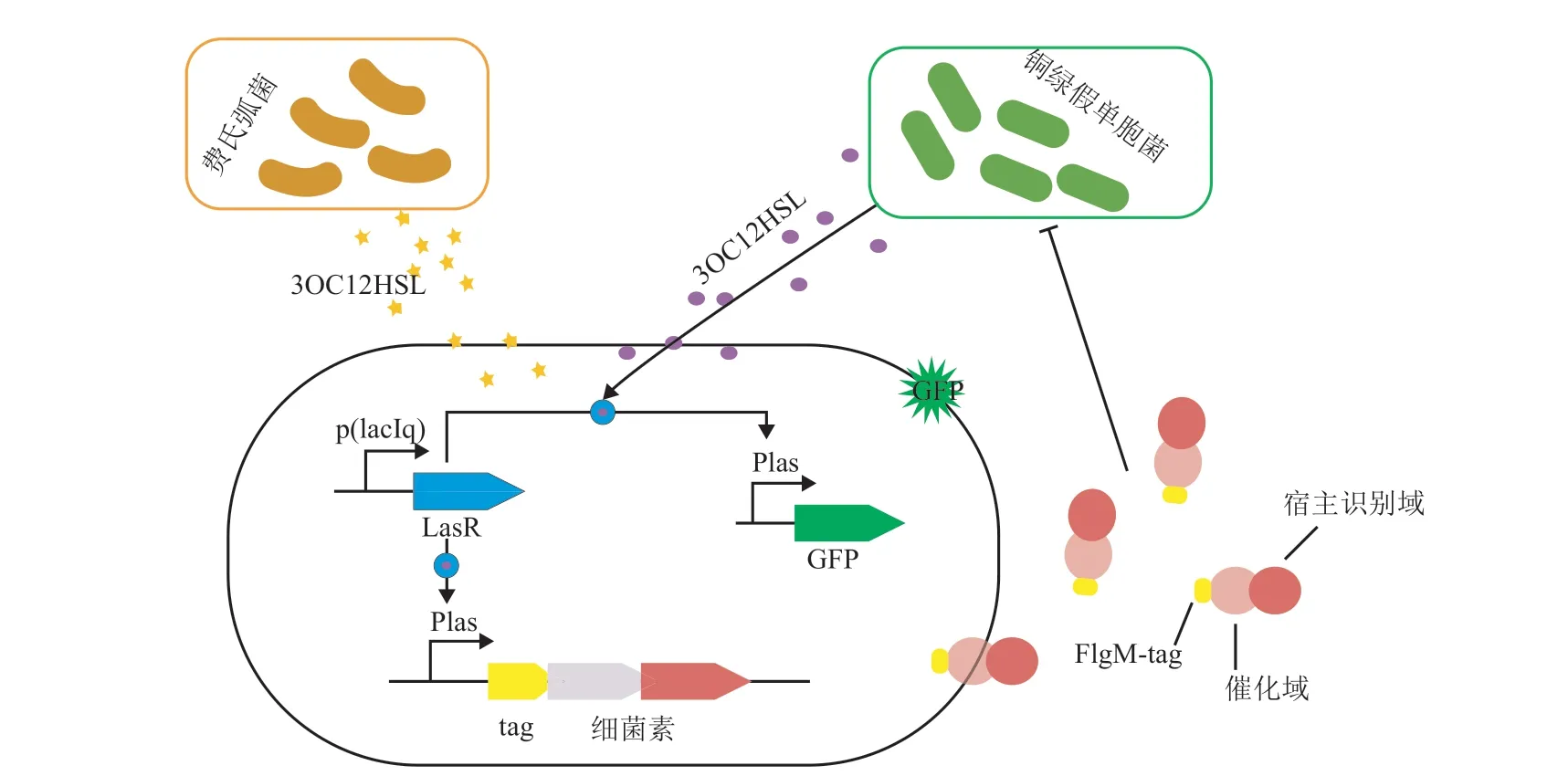
图3 Gupta 等[64]构建工程菌基因回路和抗菌作用示意图Fig. 3 Schematic of engineered bacteria gene circuit and antibacterial eあect of Gupta et al.[64]
铜绿假单胞菌感染后,生成的生物被膜不仅增强了细菌生命力,而且会影响治疗时药物的渗透,使得治疗效果大打折扣。因此,构建工程菌来响应寻找铜绿假单胞菌以及清除铜绿假单胞生物被膜显得尤为重要。如图 4 所示,2014 年,Hwang 等[69]构建的工程菌可以在响应铜绿假单胞菌群体感知小分子后游向铜绿假单胞菌,然后通过分泌的 DNase I 来消散生物被膜,并利用分泌的抗菌肽 MccS 来杀死周围的铜绿假单胞菌。
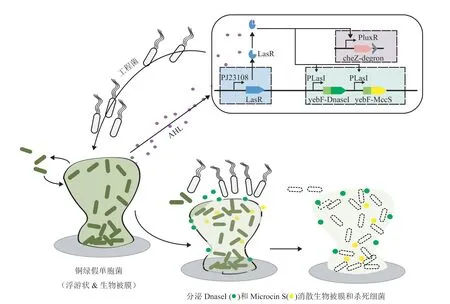
图4 Hwang 等[69]构建工程菌基因回路和抗菌作用示意图Fig. 4 Schematic of engineered bacteria gene circuit and antibacterial eあect of Hwang et al.[69]
4 噬菌体疗法
噬菌体是具有感染能力并在许多情况下可杀死细菌的一种细菌病毒。与大多数病毒一样,噬菌体通过与细菌表面特定受体结合后将遗传物质注入细菌体内,并在细菌体内进行复制。当子代噬菌体浓度达到一定值后噬菌体通过裂解宿主细菌来终止复制和释放子代到环境中,开启新一轮的感染[70]。在抗生素未普及之前,噬菌体被用作抗菌剂广泛使用,但随着越来越多的抗生素种类被发现和普及,噬菌体疗法逐渐被淡忘。随着抗生素耐药性问题的不断严峻,利用噬菌体来治疗多重耐药的病原菌又重新被重视起来[70-75]。
4.1 噬菌体抗铜绿假单胞菌实验研究
2016 年,Chan 等[78]分离出一种新的铜绿假单胞菌噬菌体 OMKO1,其受体结合位点是铜绿假单胞菌外排系统 MexAB 和 MexXY 的外膜孔蛋白 M(OprM)。如图 5 所示,当使用 OMKO1噬菌体侵染铜绿假单胞菌时,细菌通过改变外排泵机制对噬菌体产生抗性,进而导致其对几种抗生素类药物的敏感性增强,降低铜绿假单胞菌对抗生素耐药产生频率。
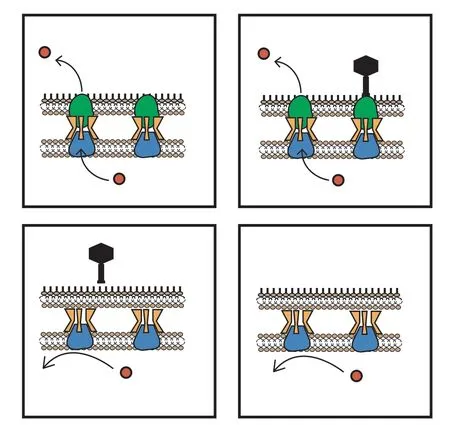
图5 铜绿假单胞菌对噬菌体产生耐药性外排泵机制[78]Fig. 5 Pseudomonas aeruginosa resistance to phage attack changes the eラux pump mechanism[78]
噬菌体通过细菌表面特异性的受体来特异性识别细菌。一旦细菌表面的受体发生突变,其就会对噬菌体产生抗性,单独使用噬菌体来治疗病原菌的效率势必会受到影响。因此,研究者通过将几种噬菌体混合起来的鸡尾酒疗法或者将噬菌体与抗生素联合的方法来治疗铜绿假单胞菌感染。
2017 年,Oechslin 等[79]研究发现,单独使用噬菌体来治疗铜绿假单胞菌感染虽然可以杀死大部分铜绿假单胞菌,但是 24 h 后会产生噬菌体抗性菌,而将噬菌体和环丙沙星联用,不仅可以增强抗菌能力,还可以降低铜绿假单胞菌的抗性。如图 6 所示,2020 年,Luscher 等[71]在人气道上皮细胞系体外模型中,研究了噬菌体和环丙沙星单独或联合使用对铜绿假单胞菌感染的疗效。结果发现,单独使用噬菌体或抗生素时产生抗性的细菌会再次生长,而将噬菌体和环丙沙星联合使用后不仅提高了抗菌效率,而且保持了细胞的完整性。2018 年,Forti 等[80]为了提高噬菌体的治疗效果,将 6 种噬菌体(PYO2、DEV、E215、E217、PAK_P1 和 PAK_P4)混合,通过体外实验验证了这 6 种噬菌体混合物可以杀死浮游状和生物被膜状态的铜绿假单胞菌,而后在有菌血症的蜡螟和呼吸道感染的老鼠模型中均验证了 6 种噬菌体混合物清除铜绿假单胞感染的高效性。2019年,Cafora 等[81]在囊性纤维化的斑马鱼模型中也验证了单独使用 6 种噬菌体混合物能够降低感染动物致死率、细菌负担和减轻感染引起的促炎反应。
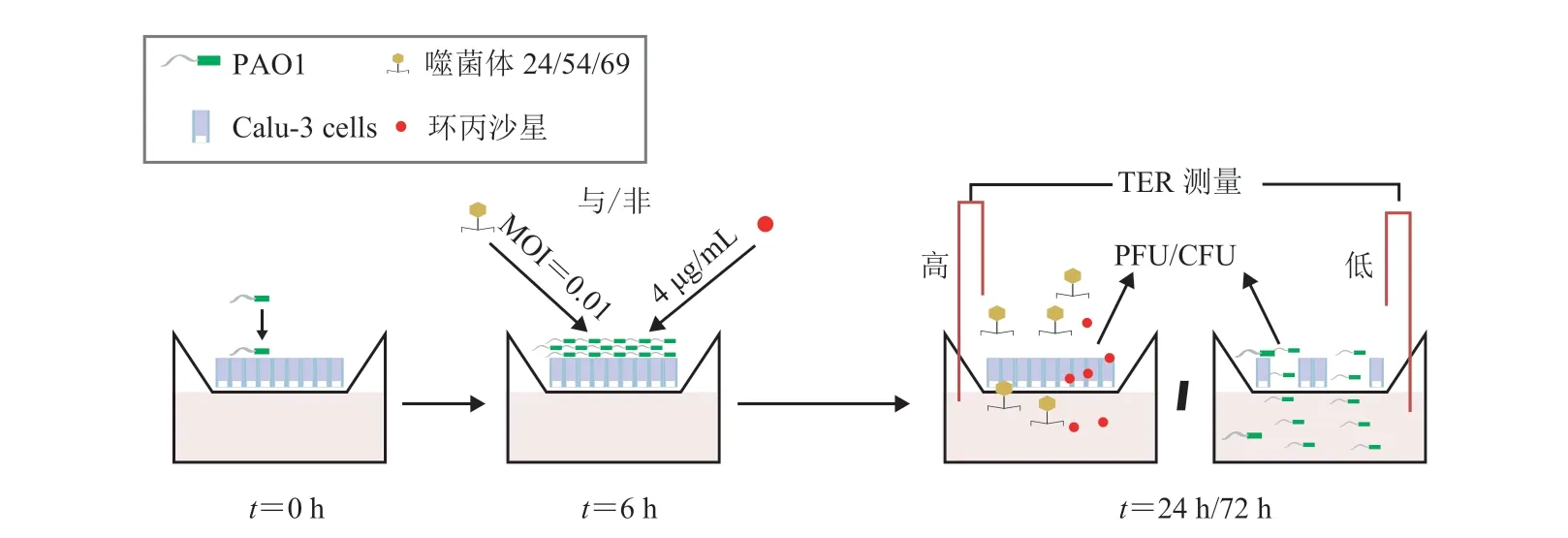
图6 噬菌体和抗生素联合治疗可防止铜绿假单胞菌感染野生型和 cftr-上皮细胞[71]Fig. 6 Combined bacteriophage and antibiotic treatment prevents Pseudomonas aeruginosa infection of wild type and cftr- epithelial cells[71]
用噬菌体治疗铜绿假单胞等病原菌造成的感染具有很多优点,但临床中大规模地使用噬菌体来治疗病原菌感染仍有不容忽视的问题。(1)天然噬菌体治疗病原菌感染往往会导致病原菌裂解,而裂解后的病原菌释放的内毒素是脓毒症发病机制中最重要的因素;(2)哺乳动物的循环系统能有效地从血液中清除噬菌体,因此治疗时噬菌体很难维持必要的噬菌体浓度;(3)单个天然噬菌体特异性太高导致其作用范围较窄[82]。
随着分子生物学和基因工程的发展,越来越多的噬菌体基因组序列和蛋白功能被阐明。通过对天然的噬菌体基因组进行设计改造,可以提高噬菌体的抗菌效率,同时降低噬菌体疗法的副作用[83-86]。
2004 年,Hagens 等[87]通过修改铜绿假单胞菌噬菌体的Pf3基因,得到的Pf3R噬菌体在杀死宿主细菌时不会导致宿主细胞裂解。因此,在杀死铜绿假单胞菌后其内毒素的释放保持在最低水平,有效解决了用噬菌体清除铜绿假单胞菌感染时内毒素释放带来的问题。2014 年,Pei和 Lamas-Samanamud[88]通过对 T7 噬菌体进行改造,得到一种可表达广泛活性内酯酶的工程 T7 噬菌体。该噬菌体可以通过降解细菌生物被膜,生成必需的群体响应小分子 AHLs,从而阻止铜绿假单胞菌、农杆菌等细菌的生物被膜生成。
4.2 噬菌体治疗多重耐药的铜绿假单胞菌的临床应用
目前,噬菌体疗法已在一些感染铜绿假单胞菌的烧伤、尿路病人上应用,具有良好的效果且未观察到不良反应[89-90]。
2009 年,Merabishvili 等[91]通过筛选将 3 种作用范围比较广的噬菌体混合,得到的噬菌体混合物 BFC1 用于治疗铜绿假单胞菌和金黄色葡萄球菌感染烧伤患者,且未观察到不良反应。2016 年,一位 61 岁铜绿假单胞菌感染的败血症患者由于急性肾损伤不得不停止对其体内分离铜绿假单胞菌唯一敏感的抗生素——黏菌素的继续使用。Jennes 等[92]通过静脉输入噬菌体混合物BFC1 的方式成功治愈铜绿假单胞菌感染,避免了传统的血液过滤,同时也没有观察到可能与噬菌体应用有关的意外不良事件、临床异常或实验室检测结果的变化。2018 年,Furr 等[93]用 ABPA01 混合噬菌体成功治愈一位囊性纤维化患者的肺部耐多药铜绿假单胞菌肺炎,并且在治疗的两个月内都没有发生肺炎,患者的肾衰竭也得到了改善。2019 年,Jault 等[94]用 12 种铜绿假单胞菌噬菌体混合物(1×106[PFU]/mL)和 1% 磺胺嘧啶银乳剂分别来治疗已经感染多重耐药的铜绿假单胞菌的烧伤患者。虽然相比使用 1% 磺胺嘧啶银乳剂,噬菌体混合物治疗效果略差,但是单独使用噬菌体混合物仍然可以有效杀死伤口表面感染的铜绿假单胞菌。
5 结语与展望
近年来,为了提高多重耐药的铜绿假单胞菌的治愈率,不同领域的研究者们研究探索了很多新的药物和新的治疗方式。目前,已经投入临床使用或尚在研究中的针对多重耐药的铜绿假单胞的抗菌药物分为广谱型药物(有机酸、抗生素、纳米粒子、抗菌肽)和靶向型药物(绿脓杆菌素、绿脓杆菌素融合蛋白)。广谱的抗菌药物虽然可以同时作用于多种菌,适用范围较广,但无差别杀菌在对抗病原菌的同时,往往会影响正常菌群的生长,进而导致菌群紊乱,对治疗带来不良效果。靶向型药物特异性高,但作用范围又太窄。无论是广谱型的药物还是靶向型的药物,直接将抗菌药物用于治疗往往会因为体液中金属离子、生物被膜等因素影响药物浓度和活性。为了提高药物的活性和减少药物损失,需要将药物负载在载体中进行保护。使用水凝胶作为药物载体时往往会受到使用时的 pH 值、生物相容性以及水凝胶流动性等的影响;使用细菌作为抗菌药物表达母体和药物载体可以降低成本,实现药物抗菌可控性,但工程菌内基因线路是否稳定以及工程菌裂解后内毒素问题等无一不困扰着研究者。
开发新的抗菌药物和新的治疗方法以治疗多重耐药的铜绿假单胞菌感染是一条漫长而曲折的道路。尽管在体外实验或动物模型中许多新的抗菌药物和治疗方式对多重耐药的铜绿假单胞菌表现出显著的抗菌作用,但受限于抗菌药物生产难度、给药方式等原因,进入临床实践的很少。未来铜绿假单胞菌感染治疗研究中,除了继续开发新药物和新治疗方式外,更不能忽略将现有抗菌药物、治疗方式联合起来扬长避短推动多重耐药铜绿假单胞菌在临床治疗中的应用。
