基因工程纳米颗粒在 EB 病毒疫苗研发中的应用概述
2021-07-30黄建东
黄建东 黄 琨
(中国科学院深圳先进技术研究院 深圳合成生物学创新研究院 深圳 518055)
1 引 言
EB 病毒(Epstein-Barr Virus,EBV)是人类至今未攻克的一大科学难题。该病毒在人群中感染非常广泛,流行病学研究表明全球约有 90% 的成年人存在 EB 病毒感染[1]。大多数初次感染发生在幼儿时期且无临床症状,而青少年时期的感染往往会引发传染性单核细胞增多症。此外,成年人感染 EB 病毒可诱发多种疾病甚至癌症,全球每年新增癌症病例中就有约 20 万病例与 EB 病毒感染直接相关[2],因此 EB 病毒被世界卫生组织归为第一类致癌病毒。与 EB 病毒感染高度相关的癌症包括鼻咽癌、胃癌、霍奇金(Hodgkin’s)淋巴瘤、伯基特(Burkitt’s)淋巴瘤等。其中,鼻咽癌与 EB 病毒相关性最高,并且高发于我国广东、香港等南方地区,被列为我国重点防治的十大恶性肿瘤之一。目前,全球还没有可接种的EB 病毒防治疫苗。而在我国,针对高发的 EB 病毒阳性鼻咽癌,主要手段为放射性疗法同多种化疗药联合治疗,而针对晚期鼻咽癌患者的治疗手段则更为有限。因此,开发防治 EB 病毒感染所诱发相关疾病的变革性疫苗刻不容缓。随着合成生物学、基因工程技术的进步,各种工程化合成疫苗载体得以迅速发展,并在 EB 病毒预防及相关肿瘤综合治疗中发挥着越来越重要的作用。
2 EB 病毒
EB 病毒主要通过唾液在鼻咽部及扁桃体传播感染,在鼻咽上皮细胞以及随上皮组织中的血管到达 B 淋巴细胞中增殖复制或进入潜伏期。EB 病毒基因组主要以附加体形式(Episomes)游离于宿主细胞的细胞核并编码约 100 个基因[3]。EB 病毒存在多种变异株,因此引发的相关疾病具有非常明显的地域差异。例如,伯基特淋巴瘤高发于中非地区,霍奇金淋巴瘤高发于欧美国家,鼻咽癌高发于我国南方地区。通过大量比对华南高发区与欧美地区及其他低发区鼻咽癌样本中 EB 病毒的全基因组捕获测序,分析鼻咽癌发生与相应 EB 病毒基因组的关系,证实广东地区约 83% 的鼻咽癌患者感染的 EB 病毒高危亚型为BALF2基因非同义变异位点 BALF2_CCT,而并非普遍感染中国人群的 LMP1-China1 亚株[4],该亚型在欧洲和非洲等地则极为罕见。同时,人群中不同的人类白细胞抗原(Human Leukocyte Antigen,HLA)等位基因型易感 EB 病毒的程度也有所不同。通过大量比对华南地区鼻咽癌患者中的 HLA 等位基因型发现,患者体突变形成的HLA-A*02:07 与 HLA-B*58 等位基因是 EB 病毒的易感受体,与鼻咽癌的低生存率也高度相关[5]。
由于 EB 病毒的主要宿主细胞是人类 B 细胞,感染后的 B 细胞很难正确执行外来病毒抗原呈递的作用,从而导致机体很难通过体液免疫及经由 B 细胞抗原提呈的下游细胞免疫来对抗病毒对宿主细胞的感染。有研究通过对鼻咽癌病人肿瘤组织的单细胞测序发现[6-7],CD8+T 细胞在浸润 EB 病毒阳性的鼻咽癌组织后很快转变为耗竭状态,或以一个“旁观者”的姿态,不发挥任何肿瘤杀伤功能,这种现象是 B 细胞功能失调的良好佐证。同时 EB 病毒的感染可潜伏于记忆 B 细胞中,这种潜伏期由于不表达任何病毒来源的蛋白,被称为潜伏 0 期。该潜伏现象使得这类被感染的细胞很难被免疫系统监测并清除。综上不难看出,由于 EB 病毒突变株的地域差异、人群易感表型不同以及攻击人类 B 细胞等特性,EB 病毒防治疫苗的研发十分困难。
目前,研发阶段的 EB 病毒疫苗主要以病毒的外膜糖蛋白 gp350 作为抗原靶点,刺激机体产生中和抗体以阻止病毒与 B 细胞表面受体结合。前期临床实验证实了该靶点的生物活性及安全性,但对无症状或特定的感染者不能有效预防,使得该疫苗的适用范围大大缩小。基于糖蛋白gB、gH、gL、gp42 为复合靶点的疫苗也可诱导产生保护性中和抗体,阻止病毒感染,但也面临由于刺激机体产生中和抗体的滴度较低,不能有效阻断病毒感染的临床问题[8]。另外,关于 EB病毒潜伏期蛋白,各项研究均表明,EBNA1、EBNA3 所能引起的 CD4+T 细胞及 CD8+T 细胞免疫应答效果并不理想[9];LMP1 几乎不能引起 CD4+细胞或 CD8+T 细胞的特异性应答,反而是通过使肿瘤相关抗原(Tumor-Associated Antigen,TAA)表达量增加来引起 T 细胞对 TAA的响应[10]。因此,寻求更全面的免疫原覆盖替代单一病毒靶蛋白形式,最大化阻断 EB 病毒感染、提升病毒抗原的主要组织相容性复合体(Major Histocompatibility Complex,MHC)分子亲和力及呈递效率,从而提高对 T 细胞的活化效果并杀伤感染细胞,是未来 EB 病毒疫苗研发的重点发展方向。本文作者团队利用反向疫苗学理念,以新冠(SARS-CoV-2)病人血液中病毒基因组捕获为平台,对新冠病毒刺突蛋白 Spike 的抗原表位进行了筛选,再对筛选出的相关抗原进行高通量克隆、表达和纯化,进行血清学及小鼠体内评价,筛选出多个具有保护性的新冠病毒抗原[11],并用潜在的 Spike 受体结合域(Receptor Binding Domain,RBD)靶点设计疫苗并免疫仓鼠,验证了候选抗原的体内反应效果[12]。因此,基于反向疫苗学抗原筛选平台,可寻求 EB 病毒更多潜在的高免疫原性的靶点,再设计能辅助免疫原性增强、将多种病毒蛋白以不同形式整合并完整呈现的疫苗平台,是 EB 病毒疫苗研发的突破口。新型基因工程纳米颗粒疫苗载体的构建为EB 病毒疫苗研究注入新的活力。本文将总结近年来针对 EB 病毒采用纳米颗粒形式防治疫苗的研究进展,为新一代 EB 病毒疫苗的研发提供更多研究基础、设计思路及新方向。
3 工程化外泌体纳米颗粒
外泌体是一种直径为40~160 nm的纳米囊泡颗粒[13],外泌体的脂双层膜结构不仅能携带多种生物活性蛋白,还能包裹多种核酸分子,包括 mRNA、小 RNA(miRNA)、长非编码 RNA(lncRNA)、DNA 等。外泌体经静脉注射,30 min 后可快速在肝脏、脾脏、肺、肾等器官富集,并可通过血脑屏障等多种生物屏障;通过其表面承载的 CD55 及 CD59 分子,可以有效防止外泌体在外周血液循环时被降解,增强了外泌体的稳定性及半衰期[14]。外泌体可通过多种途径被附近受体细胞或者经循环系统被远端细胞有效吸收,从而获取其承载的生物信息分子或者靶向药物,包括网格蛋白依赖性胞吞作用(Clathrin-Dependent Endocytosis)、陷穴蛋白依赖性胞吞作用(Caveolin-Dependent Endocytosis)、吞噬作用(Phagocytosis)、巨胞饮作用(Macropinocytosis)、脂筏介导性内吞(Lipid Raft-Mediated Uptake)、细胞膜直接融合以及受体介导性内吞[15]。同时,不同细胞来源的外泌体表面可携带不同的功能分子,如 MHC 分子、共刺激分子等,能够激活体内抗原呈递细胞(B 细胞、树突状细胞(DC)和抗原特异性 T 细胞等)的免疫反应。因此,通过对外泌体来源细胞的基因工程改造,能形成含有多种目的分子的外泌体并用于激活 T 细胞免疫反应,从而特异性杀伤病毒感染细胞或肿瘤细胞等。综上所述,外泌体具有良好的生物体兼容性、较长的循环半衰期、便于基因工程改造包装、生物安全性以及便于大规模工程化生产等优点,使其成为一种新型、备受瞩目的癌症免疫治疗平台递送工具。
目前,已有许多研究利用外泌体成功递送核酸、蛋白、抗体、纳米抗体、复合物及化疗药物等。通过工程质粒、病毒载体携带不同目标蛋白、抗体或 miRNA 等转染改造外泌体来源细胞,或将小分子药物如阿霉素 Doxorubicin 电转染进来源细胞使其分泌的外泌体中包装有该类药物[16]。还可通过展示相应的受体配体,增加外泌体的细胞特异靶向性:如 DC 细胞来源的外泌体携带 ICAM-1 可以有效并特异靶向 T 细胞上的LFA-1[17], EB 病毒糖蛋白 gp350 可特异靶向 B细胞 CD21 受体等。工程化的 SMART-Exo 外泌体表面展示 CD3 抗体分子、EGFR 抗体及 HER2抗体,帮助 T 细胞激活并重新定向于表达 EGFR/HER-2 的乳腺癌细胞[18]。工程化的 B7-Exo 携带白血病相关抗原及 B7 共刺激分子 CD80/CD86,可对荷瘤小鼠(白血病细胞系 L1210)起到有效的保护作用[19]。采用肿瘤特异性多肽脉冲树突状细胞,可获得表面携带抗原多肽的 MHC 外泌体MHC-Exo,并在多项肿瘤治疗临床前实验中取得良好的效果[20-22]。工程化 Lewis 肺癌细胞(3LL)产生的外泌体携带 CD40 配体 CD154(CD40L),该外泌体 CD40L-Exo 可有效促进 DC 分化,诱导Th 1 分泌细胞毒性因子,减轻小鼠荷瘤负担[23]。采用肿瘤细胞自体产生的外泌体(Tumor-Derived Exosomes,TEX),并修饰有 Toll 样受体 4(Toll-Like Receptor 4,TLR4)通路传递信号-警报素家族成员 HMGN1 的氮端功能域 N1ND,工程化为TEX-N1ND 外泌体刺激 DC,发现对 DC 激活有促进作用,并增强了 T 细胞对肝癌细胞 HCC 的潜在杀伤效果[24]。工程化生物素修饰后的外泌体可耦合链霉亲和素连接的 IFNγ 形成 IFNγ-Exo 外泌体,促进 M1 巨噬细胞极化、增加 IFNγ+/CD8+T 细胞并拮抗调节性 T 细胞 (Treg),共表达肿瘤相关抗原(TAA)可有效控制前列腺癌细胞 RM-1增殖[25]。外泌体表面展示 TNFα 受体 TNFR1,TNFα-Exo 外泌体可捕获 TNFα,阻断由 TNFα 介导的炎症反应[26]。同时,在新冠疫苗研发方面,深圳市第二人民医院的段莉等[27]也基于外泌体平台制备开发了新冠病毒疫苗。图 1 中总结了目前在研的用于临床治疗的工程化外泌体纳米颗粒[28]。
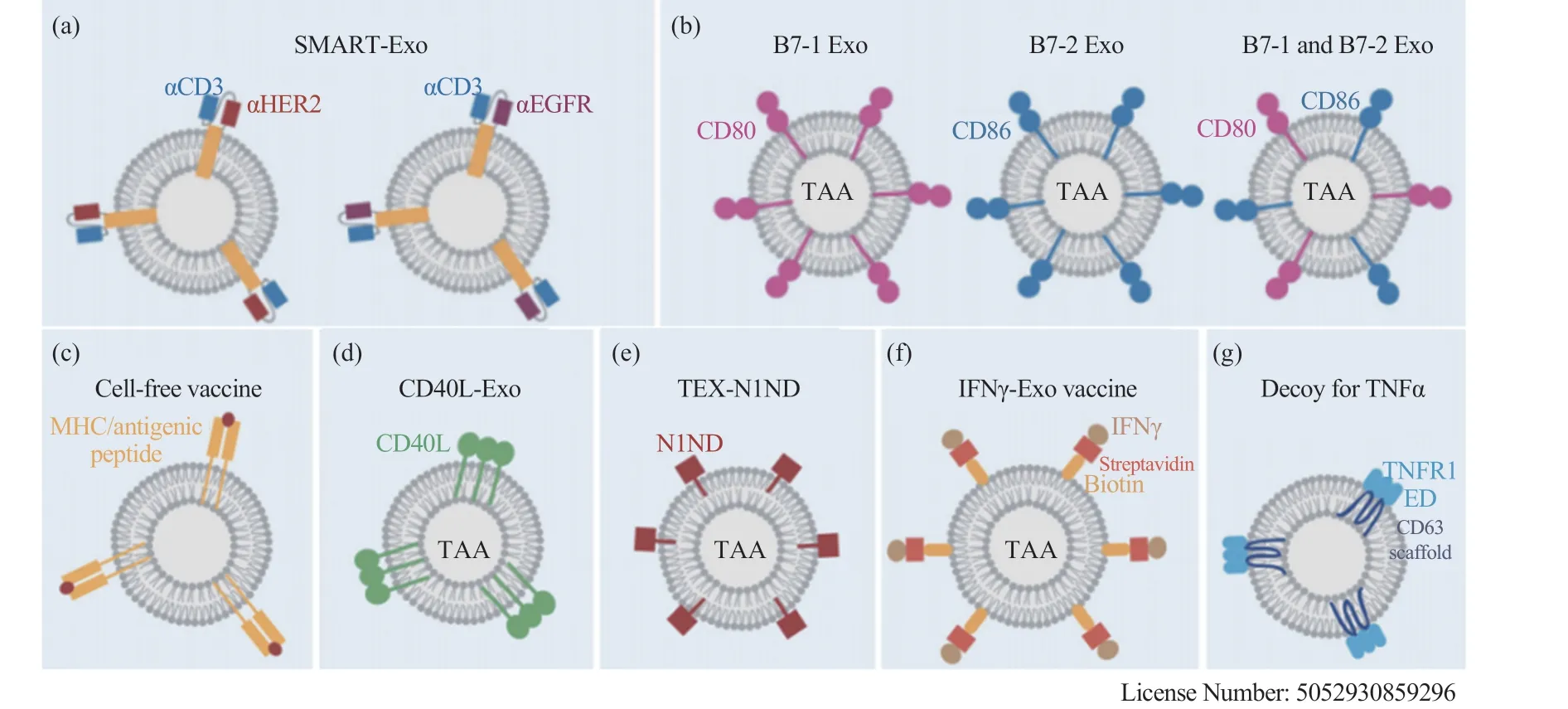
图1 基因工程化外泌体在临床免疫治疗中的应用[28]Fig. 1 Engineered exosomes for cancer immunotherapy[28]
EB 病毒作为诱发多种癌症的病毒,其表达蛋白可作为肿瘤新抗原,并工程化修饰于外泌体表面,经嵌合修饰后的工程化外泌体有望被用于 EB 病毒相关疾病的临床免疫治疗。Du 等[29]发现,通过在外泌体中储存 miR-200a 及 miR-200b,可调控其下游的 E-cadherin 表达,从而抑制 EB 病毒阳性胃癌的发生。Hurwitz 等[30]发现,CD63 富含于循环外泌体中,参与 EB 病毒潜伏期蛋白 LMP1 的外泌体包装循环,当敲除外泌体中的 CD63 分子时可有效抑制 LMP1 引起的 mTOR 信号激活,从而抑制 EB 病毒相关癌症的发生。Wang 等[31]发现,用帕米膦酸盐(Pamidronate,PAM)体外刺激 Vδ2-T 细胞激活及扩增,这种 T 细胞产生的外泌体中富含细胞程序死亡受体 FasL 及 TRAIL、NK 细胞激活受体 NKG2D、抗原呈递分子 MHC I 及 MHC II、共刺激分子 CD80 及 CD86 等,能激活 EB 病毒阳性胃癌细胞 SNU-719 的细胞凋亡通路,抑制EB 病毒阳性 B 细胞瘤 LCL 的生长,并能显著提升荷瘤小鼠的生存率及生存时间。由于 Vδ2-T细胞介导的免疫反应更偏向于天然免疫,不受限于受体 MHC 分子,因此比只能采用自体免疫细胞的细胞疗法更具临床转化优势。他们在分别给荷瘤小鼠注射 NK 细胞外泌体及 Vδ2-T 细胞外泌体后发现,Vδ2-T 细胞外泌体具有比 NK外泌体更加有效的肿瘤抑制效果。EB 病毒糖蛋白 gp350 与 B 细胞表面受体 CD21 结合,介导EB 病毒感染 B 细胞,感染后的 B 细胞分泌的外泌体中整合了糖蛋白 gp350,可转移至未感染的 B 细胞,并激活 CD4+T 细胞免疫应答,可诱导强烈的抗病毒免疫反应。B 细胞来源的慢性淋巴细胞白血病(Chronic Lymphocytic Leukemia of B-Cell Origin,B-CLL)是常见于西方国家成人中的一种 EB 病毒阳性白血病,这类 B 细胞肿瘤由于缺乏辅助分子及共刺激分子 CD40,无法通过激活 CD40 配体 CD154(CD40L)有效向T 细胞呈递肿瘤相关抗原,从而导致肿瘤逃脱免疫监视。Ruiss 等[32]采用表达载体共转染的方式使 HEK293 细胞分泌含有 CD154 及 gp350 的外泌体,发现纯化后的 CD154+/gp350+外泌体可高效地与 B-CLL 病人的 B 细胞结合,并有效地将CD154 信号传递给病人的 B 细胞,使其重新有效地执行抗原呈递,从而激活 CD4+/CD8+T 细胞gp350 的特异性免疫应答,并执行杀伤 B-CLL肿瘤细胞。
综上,外泌体纳米颗粒在临床转化中颇具优势,在对抗 EB 病毒方面也取得了一定进展,但目前工程化的外泌体在适应临床转化及应用前,还存在诸多需要解决以及改进的问题。例如:如何运用新基因工程技术(如 CRISPR 基因敲除技术)去除外泌体中所有副效蛋白或 RNA 分子;如何改进外泌体功能使其具有更好的安全性;如何选择 EB 病毒有效抗原并利用外泌体嵌合更全面多样的抗原等。
4 类病毒颗粒
传统疫苗的制备周期较长、免疫效果不佳,不适用于临床大规模生产。近年来不断兴起的病毒样颗粒(Virus-Like Particle,VLP)载体有望成为传统疫苗形式的替代。VLP 是由病毒单一或多个结构蛋白自行装配而成的高度结构化的蛋白质颗粒,直径为 20~150 nm,因其保持了病毒抗原蛋白的天然构象,具备激发宿主先天和适应性免疫反应的功能。由于缺乏病毒调节蛋白和感染性核酸,VLP 无复制和感染宿主的能力,所以其具有良好的生物安全性。VLP 作为一种新型的基因工程疫苗载体,具有强大的免疫优势,如表面结构规则、大小合适、不含核酸、不能自主复制、不具有传染性、易被免疫系统识别并产生很好的免疫效果、半衰期较长、质量稳定和安全可靠等。
类病毒颗粒大致可分为无包膜结构的 VLP以及有包膜结构的 VLP(VLP/LP)。若想在没有脂双层修饰的 VLP 表面呈现特异抗原,则需要进行基因工程化改造,使其病毒结构蛋白在自组装时表面携带外源性抗原或带有可化学耦合抗原分子的连接分子,如 Sulfo-SMCC[33]或 Spycatcher。本文作者团队的前期工作成功将Spycatcher 展示于乙型肝炎病毒核心蛋白(HBc)自发形成的类病毒颗粒表面,并与 Spytag 靶抗原蛋白或相关抗原多肽偶联,通过喷鼻免疫的方式,快速激活小鼠体内的黏膜免疫。还可通过基因工程化方式优化改造 HBc 的特定侧链氨基酸引入人工二硫键六聚体结构,形成结构更稳定的工程化类病毒纳米颗粒 VLP-SS1[34]。包膜结构的 VLP-VLP/LP 也可同样采用基因工程化方式进行改造,或利用宿主细胞的脂质双层膜结构,使用简单的共孵育方法将糖基磷脂酰肌醇(Glycosyl Phosphatidyl Inositol,GPI)锚定蛋白吸附于 VLP/LP 表面,通过 GPI 锚定分子吸附呈递多种目标抗原或纳米抗体等,形成多功能的纳米颗粒疫苗[35]。
类病毒颗粒疫苗在癌症治疗及病毒防护中已有多项应用。例如,HBc 自组装病毒颗粒表面可承载多种癌症相关抗原(如黑色素瘤抗原MAGE-1、MAGE-3 等),临床实验中用于治疗黑色素瘤[36]。在 EB 病毒预防疫苗的研发方面,嵌合新城疫病毒类病毒颗粒(NDV-VLP),工程化改造融合了 EB 病毒糖蛋白 gp350/220,在体内产生了持久性较强的 EB 病毒特异性中和抗体[37]。这种工程化的 NDV-VLP 不仅能引起体液免疫,还可以通过包裹 EB 病毒的 mRNA 分子,在免疫细胞内翻译,再由 MHC I 分子途径激起 EB 病毒特异性 CD8+T 细胞反应[38]。采用NDV-VLP 工程化装载 gH/gL-EBNA1 及 gB-LMP2,两种形式的 VLP 均能使体内产生高滴度的 EB 病毒中和性抗体[39]。Pavlova 等[40]成功采用 293T细胞表达并纯化出 EB 病毒 BFLF1/BFRF1A 的突变基因,形成不含病毒 DNA 的 EBV-VLP,激起了特异性的 CD4+T 细胞免疫反应。该团队在此 VLP 的基础上,又改造整合了 EB 病毒潜伏期蛋白 EBNA1 的两段功能域 RI+RII,形成VLP-EBNA1RI+RII,随后又逐次引入了 gp350 以及可对人源化小鼠模型起到良好 EB 病毒保护效果的 gH/gL[41],再加入被膜蛋白 BNRF1,最大化疫苗的体液免疫与细胞免疫反应[42],扩大了疫苗的保护作用。同时,其他团队也证实了 EBVVLP 疫苗对免疫力低下的肾移植病人有较好的保护作用[43]。图 2 展示了不同类病毒颗粒载体结合EB 病毒抗原的疫苗结构。
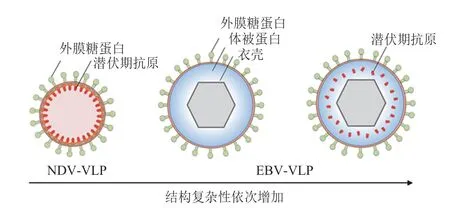
图2 类病毒颗粒在 EB 病毒疫苗研发中的应用Fig. 2 EB virus vaccines candidates based on engineered VLPs
在设计 VLP 时,病毒结构蛋白的选择以及外源性抗原融合病毒结构蛋白单体的设计至关重要。由于 VLP 自身的潜在免疫原性引起受体的非特异性免疫,会竞争遮盖掉 VLP 所承载的特异性抗原本身的免疫原性信息(CIES 效应),致使疫苗设计失效[44]。再者,大部分 VLP 的设计均基于感染真核细胞病毒的结构蛋白,由于原核微生物工程菌株缺乏翻译后修饰系统,基因工程化的蛋白无法正确折叠,从而发生自组装,形成稳定的 VLP 结构,因此很难采用大肠杆菌等工程化微生物大规模地生产并纯化 VLP。为确保VLP 疫苗质量,目前商业化的生产采用的是酵母、昆虫细胞、哺乳细胞等真核表达体系,导致设计难度及生产成本大幅提高。针对这两方面主要缺陷,今后还需要科研工作者在 VLP 疫苗平台的改造、生产及研发上重点突破。
5 铁蛋白自组装纳米颗粒
铁蛋白(Ferritin)可自发组装成由 24 个亚基构成的球状簇,球体直径约为 12 nm,可以快速有效地穿越体内屏障(血脑屏障、血睾屏障等)扩散至全身各处淋巴结,是一种理想的蛋白疫苗纳米递送平台。铁蛋白自组装纳米颗粒具有较多的抗原容纳区域,可以容纳多种抗原多肽,并高效提呈给 DC 细胞。由于铁蛋白自组装纳米颗粒有极高的热稳定及化学稳定性,更加便于对其大规模工业化提纯生产[45]。铁蛋白的自身免疫原性很低,具有很好的抗原递送属性及生物安全性。Ma 等[46]在铁蛋白纳米颗粒表面引入 Spycatcher/Spytag 系统,使得载体更具备抗原组装的灵活性,并采用该纳米颗粒平台同时将 24 个新冠病毒SARS-CoV-2 刺突蛋白 Spike 的受体结合域(RBD)和七肽重复域(HR)呈递于纳米颗粒表面。该疫苗在小鼠和恒河猴中均能够显著诱导出高滴度的中和抗体。目前,研究人员计划对这些纳米颗粒进行临床前安全评估,并力争进行临床转化生产。
针对 EB 病毒的疫苗设计,Kanekiyo 等[47]用 EB 病毒外膜糖蛋白 gp350 的突变片段 D123与铁蛋白融合,成功自组装形成 D123-铁蛋白纳米颗粒,并诱导出高滴度的 EB 病毒有效保护抗体。Bu 等[48]采用 EB 病毒外膜糖蛋白 gH/gL/gp42 的融合片段与铁蛋白氮末端进行基因融合,合成了 gH/gL/gp42 的铁蛋白纳米颗粒疫苗,产生的 EB 病毒特异性中和抗体对 B 细胞病毒感染起到了很好的保护作用。
与类病毒颗粒相比,在铁蛋白纳米颗粒上呈现的抗原分子不密集,也不会被其他衣壳蛋白遮蔽,能让免疫系统获取更全面的特异性抗原信息,使得该类新型纳米颗粒疫苗具有更大的临床转化潜力。
6 其他新型纳米颗粒 EB 病毒疫苗
除了通过基因工程改造纳米颗粒来源细胞的方法外,还有一些化学方法可有效形成工程化的纳米颗粒递送抗原表达 mRNA,或多肽抗原分子及免疫佐剂等,并已用于研制 EB 病毒疫苗。例如,纳米复合物 FNC 可同时递送 EB 病毒潜伏期抗原 EBNA1 的突变抗原与佐剂 CpG,成功激起小鼠体内鲁棒性的体液免疫及特异性 T 细胞免疫,并对转染 EBNA1 的小鼠肺癌细胞系起到了较强的生长抑制作用[49]。
二氧四氢喋啶合酶(Lumazine Synthase,LS)可自发形成含有 60 个亚基的二十面体纳米颗粒,直径约为 14.5 nm;来源于 KDPG 醛缩酶功能片段的 I3-01 也可自发形成二十面体纳米颗粒,直径约为 20 nm。这两种纳米颗粒均可在表面修饰特异性抗原,Kang 等[50]在 LS 及 I3-01 的二十面体表面均融合了 EB 病毒糖蛋白 gp350 的D123 片段,引起了比 gp350 单体高 65~133 倍的中和性病毒抗体,并激活了 Th2 辅助 T 细胞免疫应答反应。这些工作说明,还存在其他潜在的、高效的、可工程化的纳米颗粒疫苗平台。
综上,本文对近年来不同纳米颗粒载体在EB 病毒疫苗研发中的应用做了相应的总结评述,如表 1 所示。
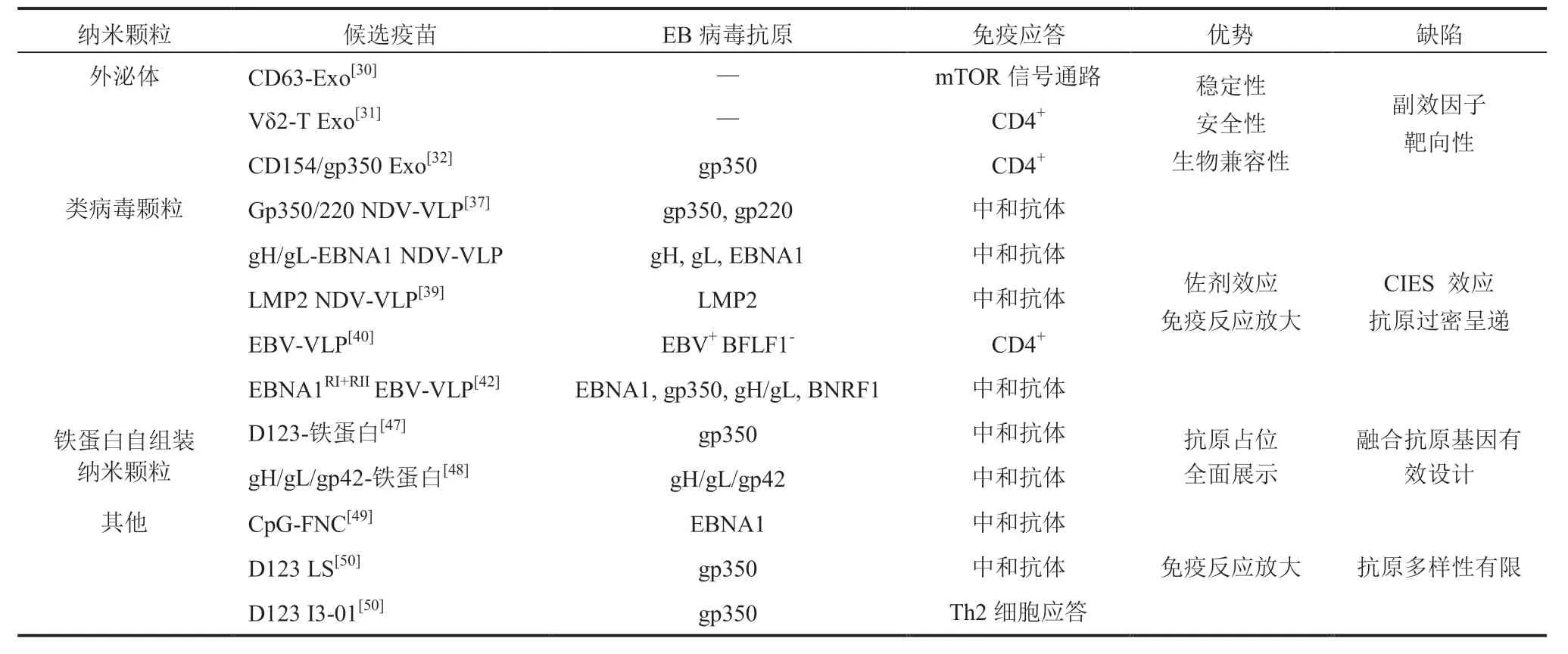
表1 纳米颗粒载体在 EB 病毒疫苗研发中的应用Table 1 Summary of nanoparticle-based EB virus vaccine candidates that have been developed
7 总结与展望
本文总结了近年来国内外利用纳米颗粒为疫苗平台对 EB 病毒的预防及治疗性疫苗方面的研究进展,重点介绍了外泌体纳米颗粒平台、类病毒颗粒平台、铁蛋白自组装纳米颗粒平台以及一些其他类型的纳米颗粒在防治 EB 病毒中的应用。虽然纳米颗粒基因工程技术突破了传统单一形式蛋白或多肽疫苗的技术瓶颈,并为 EB 病毒的有效防治提供了新工具,但纳米颗粒在进一步临床应用及转化过程中仍然面临诸多挑战。首先,要保证平台具有极高的生物安全性,需要检测验证外泌体中非必要蛋白的组分,并采用工程化改造技术剔除所有副效蛋白等;类病毒颗粒虽不包含病毒复制 DNA,但也不能引入引起副效作用的任何潜在调节分子片段;EB 病毒自身的免疫原性较低,如何选择 EB 病毒抗原并利用不同纳米颗粒载体更全面地嵌合及展示多种病毒蛋白抗原,这些都是影响临床转化的关键性问题。现有的纳米颗粒平台大多都未被国家食品药品监督管理总局正式批准,潜在的生物安全性还需进一步验证。其次,纳米颗粒的大规模可控制备纯化技术是临床转化的又一关键问题,包括外泌体、类病毒颗粒在内的纳米颗粒均需要真核表达系统的正确组装,使得大规模生产面临一定的技术挑战。因此,如何设计出可在原核生物中正确表达的结构单体、如何谨慎筛选组装分子、严格挑选抗原分子,都是纳米颗粒真正迈入临床转化所亟待解决的共同科学问题。
