合成生物学在推动肿瘤细菌疗法临床药物开发中的应用
2021-07-30刘陈立董宇轩
刘陈立 董宇轩 郭 旋
1(中国科学院深圳先进技术研究院 深圳合成生物学创新研究院中国科学院定量工程生物学重点实验室 深圳 518055)
2(中国科学院大学 北京 100049)
1 引 言
回顾肿瘤细菌疗法走过的百年历程,从最早外科医生的偶然发现(患者感染病原菌后肿瘤生长得到抑制)[1],到 William B. Coley 医生开发细菌制剂 Coley’s Toxins 用于肿瘤治疗[2],再到近二十年研究者通过基因工程改造细菌来提高肿瘤治疗效果,细菌疗法在肿瘤治疗中一直扮演着重要角色。近年来,随着合成生物学的蓬勃发展,研究者也在思考如何进一步优化肿瘤细菌疗法,为肿瘤治疗提供更多样化、更有效安全的策略[3]。
肿瘤细菌疗法依赖自然界中细菌的毒力、自主运动能力以及对肿瘤的趋向性和侵袭能力等特征,使细菌具有调节肿瘤免疫微环境、诱导抗肿瘤免疫反应的能力[4]。目前研究者依据细菌生物生理功能的不同,为治疗肿瘤提供了不同的干预策略[5]。此外,细菌基因组简单,易于进行工程改造,这也进一步提高了细菌对环境感应、特异靶向和智能递送药物等能力[6]。上述特点赋予细菌为许多难治性、转移性癌症类型提供更好的解决方案的能力,加速了肿瘤细菌治疗药物在生物医药领域的研发进程和未来临床应用成功转化的可能性[7]。
本文从肿瘤细菌疗法面向临床试验的角度出发,归纳总结了梭状芽孢杆菌(Clostridiumsp.)、单核细胞增生性李斯特菌(Listeria monocytogenes)、沙门氏菌(Salmonellasp.)和大肠杆菌(Escherichia coli)等不同种属细菌在临床试验中的代表性研究进展和面临的瓶颈问题。重点介绍了合成生物学利用细菌作为模块化工程平台,设计微妙而复杂的基因线路,在提高细菌疗法有效性和改善临床生物安全性等方面的应用,从而弥补目前肿瘤细菌疗法在临床测试中的不足,助力细菌疗法突破瓶颈,推动临床试验进展。
2 肿瘤细菌疗法在临床测试中的范例
2.1 梭状芽孢杆菌
梭状芽孢杆菌是一种革兰氏阳性菌,是最大的原核生物属之一,由于芽孢形态呈圆形或卵圆形,使菌体膨大呈梭状,所以被称为梭状芽孢杆菌[8]。梭状芽孢杆菌是专性厌氧菌,因此,赋予了其在氧气匮乏的实体肿瘤坏死区域定植的能力[9]。此外,梭菌芽孢的萌发是由多种因素导致的,包括营养物质、酶、液体静压力或阳离子表面活性剂等[10],使其形成具有代谢活性的细菌细胞。
目前已有多株梭状芽孢杆菌被报道应用于治疗肿瘤,包括溶组织梭状芽胞杆菌(C. histolyticum)[11]、破伤风梭菌(C. tetani)[12]、溶瘤梭菌(C. sporogenes)[13]和丙酮丁醇梭杆菌(C. acetobutylicum)[14]等。梭状芽孢杆菌在肿瘤治疗中的应用历史可以追溯到 1813 年,外科医生 Vautier 首先观察到肿瘤患者在感染梭状芽孢杆菌后患上气性坏疽,但患者体内的肿瘤竟然消退了[15]。1935 年,Connell[1]首次使用来自溶组织梭状芽胞杆菌的细菌培养液干预治疗了 30 例癌症患者,结果发现肿瘤病情在部分患者上有所缓解。1947 年,Parker 等[16]首次将溶组织梭状芽胞杆菌用于治疗荷瘤小鼠,结果显示静脉注射细菌激发小鼠全身性免疫反应能在短期内延长小鼠寿命,但肿瘤并没有完全消退。1955 年,Malmgren 和 Flanigan[17]通过探究破伤风梭菌在小鼠各个组织器官和瘤内的定植数量,进一步证明了梭状芽孢杆菌对实体瘤的特异定植能力。在对小鼠注射高浓度剂量的破伤风梭菌孢子的 48 h内,只有在实体瘤内检测到了破伤风梭菌,这说明了细菌孢子在实体瘤内定植的特异性。以上研究均表明,梭状芽孢杆菌具备肿瘤治疗的潜力。
但由于梭状芽孢杆菌的天然毒力过强,其在肿瘤治疗中的应用也受到一定限制。对此,Dang等[18]对包含双歧杆菌(Bifidobacterium)、乳酸菌(Lactobacillus)和梭状芽孢杆菌在内的 26 种不同菌株评估了其在实体瘤厌氧区的特异定植能力。通过将细菌或梭菌孢子静脉注射入 B16 黑色素瘤荷瘤小鼠后,发现一株诺维氏梭菌(C. novyi)表现出优异的定植能力。Dang 等[18]通过对该菌株加热诱导,在 400 多个细菌菌落中筛选到缺失致死性毒素基因的减毒株C. novyi-NT,从而降低了梭状芽孢杆菌在静脉注射后造成的全身毒性。减毒株C. novyi-NT的孢子仅在小鼠实体瘤的血管匮乏区域(厌氧区)出芽萌发,并破坏周围的肿瘤细胞。另外,Dang 等[18]还开发了一种联合溶菌疗法(Combination Bacteriolytic Therapy,COBALT),通过将C. novyi-NT孢子与常规化疗药物联合使用,显著延长了抗肿瘤作用的持续时间。这种细菌联合其他疗法的治疗策略不仅突破了常规化疗药物无法深入递送到血管匮乏的实体瘤内部的瓶颈,也开创了联合细菌治疗肿瘤的先河。
虽然目前对梭状芽孢杆菌治疗肿瘤的机制尚未清晰,但有研究表明梭菌产生的诸如胞嘧啶脱氨酶、硝基还原酶以及磷脂酶、溶血素和脂肪酶等破坏肿瘤细胞的毒素可能在肿瘤治疗中发挥了积极作用[19]。另外,也有研究报道梭菌孢子可以在肿瘤细胞中萌发,诱导表达针对在肿瘤发展中起关键作用的转录因子——缺氧诱导因子-1(HIF-1)[20]和不同细胞因子如 TNF-α[21]、IL-2[22]和 IL-12[23],从而抑制肿瘤细胞的增殖或转移[18]。
值得关注的是,减毒株C. novyi-NT在 2019年完成了 1 期临床测试(NCT01924689)。测试中,对 24 例过往接受过化疗或放疗等常规方法且没有治疗效果的晚期实体肿瘤患者,接受单次瘤内注射 6 个递增剂量的C. novyi-NT的细菌孢子(1×104~3×106个/kg),以确定剂量限制毒性(DLT)和最大耐受剂量。结果显示在 24 名患者中,单次肿瘤内注射C. novyi-NT后,10 名患者(42%)的瘤内检测到细菌孢子出芽萌发,并导致肿瘤病灶减小[24]。
2.2 单核细胞增生性李斯特菌
单核细胞增生性李斯特菌是一种兼性厌氧的革兰氏阳性胞内杆状菌。李斯特菌感染会导致患者产生多种症状,包括肠胃炎、脑膜炎和脑炎[25]。但一般来说,人类免疫系统具有强大的先天和适应性免疫反应,能够有效控制李斯特菌感染。因此,由李斯特菌造成的极其严重的感染通常仅发生于老年人、孕妇或免疫功能低下的患者[26]。随着对单核细胞增生性李斯特菌侵染细胞并激发强烈细胞免疫应答特性的深入研究,研究者也在考虑利用细菌的免疫原性来开发肿瘤疫苗[26]。
相比于其他细菌载体可能会被中和抗体抑制而失去作用,单核细胞增生性李斯特菌感染仅会触发适度的体液反应,这使其能多次使用来有效增强患者的 T 细胞反应[19]。值得关注的是,单核细胞增生性李斯特菌是激活细胞毒性淋巴细胞的有效刺激因子[27]。1962 年,Mackaness[28]报道了小鼠暴露于亚致死剂量的李斯特菌后,会产生时间持久、独立于抗体的免疫反应,这保护了未来致命剂量的李斯特菌的感染。基于这些实验数据和理论成果,研究者们开始探索通过开发李斯特菌疫苗载体,诱导激活细胞毒性淋巴细胞介导的免疫应答来清除外源抗原。Schafer 等[29]在 1992年首次报道了通过改造李斯特菌载体表达大肠杆菌的 β-半乳糖苷酶抗原来作为肿瘤靶向药物,诱导 BALB/c 小鼠的细胞毒性淋巴细胞反应。自从这个开创性的工作成果发表后,近 30 年来,基于李斯特菌治疗各种癌症的研究被广泛报道。
感染过程中,单核细胞增生性李斯特菌会侵入肠上皮细胞,随后细菌进一步迁移到脾脏、肝脏等正常组织器官,并被抗原呈递细胞(Antigen-Presenting Cells,APC)吞噬,激活适应性免疫系统,表现如促炎细胞因子表达增高、李斯特菌特异性激活 CD4+T 细胞应答和 MHC I 类分子向CD8+T 细胞分泌蛋白抗原等[26]。但李斯特菌会通过产生穿孔素(Listeriolysin,LLO)和肌动蛋白装配诱导蛋白(Actin Assemble Inducingprotein,ActA)在细胞内扩散存活[30]。
截至 2014 年,多项李斯特菌肿瘤疫苗已经进入临床试验。第一个推向临床试验的是应用于治疗晚期宫颈癌的重组减毒活菌疫苗Lm-LLO-E7[31]。Lm-LLO-E7 是将人乳头瘤病毒 HPV-16 E7 抗原融合到李斯特菌穿孔素蛋白Listeriolysin O 的非溶血片段,再由李斯特菌分泌表达,增强肿瘤抗原的免疫原性。在这项 1 期临床试验中,对 15 例既往治疗过的转移性、难治性或复发性的晚期浸润性宫颈癌患者进行了Lm-LLO-E7 的安全性评估。患者接受 3 个剂量水平的Lm-LLO-E7 (1×109CFU、3.3×109CFU 和1×1010CFU)静脉滴注,3 周后第二次注射。在接受治疗之后,所有患者均表现出不良反应,包括流感样综合征和低血压等临床症状。到研究实验结束,2 例患者死亡、5 例病情有发展、7 例病情稳定、1 例符合部分应答标准,该研究首次表明,减毒活疫苗对晚期浸润性宫颈癌患者是安全的,且对肿瘤有一定抑制作用[31]。
另外两个比较有代表性的李斯特菌疫苗分别是 CRS-207 和 ADXS11-001。其中,CRS-207 是在敲除了两个毒力基因actA和内化蛋白B (Internalin B)的基础上,表达人源间皮素的减毒株。这两个毒力基因的缺失降低了细菌在细胞间的扩散能力和对非吞噬细胞的侵袭能力。研究表明,与野生型单核细胞增生性李斯特菌相比,CRS-207 的定植水平降低了 1 000 倍[32]。在对CRS-207 的安全性临床测试中,17 名间皮瘤、肺癌、胰腺癌或卵巢癌受试者接受 CRS-207 的 4 个递增剂量(1×108CFU、3×108CFU、1×109CFU、1×1010CFU)后,患者耐受性良好,并在血清细胞因子或趋化因子水平观察到了患者机体免疫系统的激活。在 17 名受试者中,37% 的受试者生存期达到 15 个月,证明了该疫苗的生物安全性和治疗肿瘤的潜力(NCT00585845)。另外,研究者也对 CRS-207 联合培美曲塞/顺铂化疗的治疗有效性做了临床评估。共计 60 例不可手术切除的恶性胸膜间皮瘤患者接受了 2 次 1×109CFU的 CRS-207 静脉滴注并联合化疗。结果表明,35 例可评估的患者中,89% (31/35)患者的病情得到控制,1 例完全缓解(3%),19 例部分缓解(54%),10 例病情稳定(29%)。证明 CRS-207 联合化疗可显著改变局部肿瘤微环境,激活机体免疫细胞杀伤肿瘤(NCT01675765)[33]。
2.3 沙门氏菌
沙门氏菌是一种兼性厌氧的革兰氏阴性胞内杆状菌。沙门氏菌能够在有氧条件下利用氧气或者在无氧条件下利用其他电子受体或以发酵的方式产生腺嘌呤核苷三磷酸(Adenosine Triphosphate,ATP),维持自身生理生长。沙门氏菌拥有诸多优良特性,使其成为肿瘤治疗中的模式微生物,包括依赖其鞭毛的自主运动能力、便于基因改造、天然的细菌毒力等[37]。
由于在临床上使用沙门氏菌具有高感染风险,所以如何平衡细菌过强的毒性和治疗效力是研究者急需攻克的难题。目前研究者对沙门氏菌进行了多方面的基因工程改造。已报道的改造主要集中于降低细菌天然毒力、提高细菌肿瘤定植能力和降低细菌逃逸免疫系统监控的风险等,如鼠伤寒沙门氏菌菌株 VNP20009[38]、A1-R[39]和ΔppGpp (SHJ2037)[40]等。
其中,VNP20009 是基于野生型鼠伤寒沙门氏菌 ATCC 14028 底盘,通过基因工程改造的方式敲除了msbb基因,使细菌丧失了将脂质酰化为内毒素的能力,从而减少了内毒素的产生,降低了细菌毒性。另外,通过敲除参与嘌呤代谢相关基因purI,使细菌的增殖只能依赖于外源性的腺嘌呤,避免了细菌逃逸风险[20]。鼠伤寒沙门氏菌菌株 A1-R 是在结肠癌小鼠模型中筛选得到的亮氨酸和精氨酸缺陷株,其在实体瘤坏死区有较强的定植能力[41],并对前列腺癌[42]、乳腺癌[43]和宫颈癌[44]等都有很好的疗效。ΔppGpp(SHJ2037)是relA和spoT双基因突变菌株,relA和spoT的缺失导致了细菌不能合成 ppGpp,从而丧失了细菌对哺乳动物细胞的侵袭能力。有文章报道 ΔppGpp (SHJ2037)在小鼠结肠癌模型中具有良好的靶向能力,并改造其表达细胞毒性蛋白(Cytolysin A),在小鼠原位瘤模型和肺转移瘤模型中表现出良好的治疗效果[45]。
在上述菌株中,VNP20009 是首例推向肿瘤治疗临床测试的沙门氏菌菌株。据报道,VNP20009 在 1 期安全性临床测试中,对 24 名转移性黑色素瘤患者和 1 名转移性肾细胞癌患者静脉注射 106~109CFU/m2的 VNP20009;结果表明,患者的最大耐受剂量为 3×108CFU/m2,在接受 109CFU/m2的注射剂量后,患者出现严重的剂量限制毒性,表现为血小板减少、贫血、持续性菌血症、高胆红素血症、腹泻、呕吐、恶心、碱性磷酸酶升高和低磷酸盐血症等。虽然 VNP20009 在临床测试中表现出良好的肿瘤定植能力,但并没有观察到病灶减小。因此,VNP20009 由于在临床实验中不具备有效的肿瘤治疗效果而止步于 1 期[46]。
2.4 益生菌——大肠杆菌 Nissle 1917
大肠杆菌菌株 Nissle 1917(Escherichia colistrain Nissle 1917,EcN)由外科医生 Alfred Nissle于 1917 年在第一次世界大战期间从一名德国士兵的粪便中分离出来。之后,Alfred Nissle 发现该菌株对不同致病性大肠杆菌具有强烈的拮抗活性[47]。
EcN 作为肠道益生菌具有许多优良的特性,赋予了其应用于肿瘤治疗的良好前景。首先,EcN 具有生物安全性、对免疫系统敏感[48],不产生任何与致病性大肠杆菌相关的肠毒素或细胞毒素[49]。同时,EcN 膜上的血清敏感性脂多糖可确保该菌株能快速地被机体清除,且对患者没有严重的免疫毒性副作用[50]。而 EcN 作为兼性厌氧菌,同样具备良好的实体瘤定植能力[6]。
近年来,越来越多的报道表明 EcN 能够作为细菌药剂治疗肿瘤。例如,Zhang 等[51]报道了改造 EcN 组成型表达天青蛋白以抑制肿瘤的研究。在该研究中,患有原位 B16 黑色素瘤或 4T1 乳腺肿瘤的 BALB/c 小鼠以每只 2×107CFU 的剂量静脉注射 EcN,天青蛋白的释放和由此产生的炎症反应有效地抑制了肿瘤的生长和肺转移,并且细菌没有表现出显著的毒性。另外,He 等[52]通过氧气依赖性启动子控制 EcN 在实体瘤内特异性表达血管生成抑制剂 Tum-5。结果表明,在静脉注射的 14 天内,表达 Tum-5 的 EcN 能在携带B16 黑素瘤的 C57BL/6 小鼠中定植,并且肿瘤生长和血管生成被成功抑制。此外,该课题组还将能够表达抗癌蛋白 p53 的治疗模块加入到表达Tum-5 的 EcN 中,赋予了 EcN 在小鼠原位肝癌肿瘤模型上更显著的抑制作用[6]。
目前,EcN 在肿瘤治疗临床测试上走得最远的是美国 Synlogic 公司研发的 SYNB1891。SYNB1891 是以大肠杆菌 Nissle 1917 为细菌底盘,利用其在肿瘤内的特异性定植能力,通过合成生物学改造,赋予 EcN 在瘤内特异性表达STING 激动剂环二磷酸腺苷。STING 激动剂可以激活抗原呈递细胞呈递肿瘤抗原,从而激活抗肿瘤免疫反应[53]。SYNB1891 对晚期转移性实体瘤和淋巴瘤患者(NCT04167137)的 1 期临床实验表现出良好的安全性;同时,患者在接受SYNB1891 干预后,显示出 STING 通路激活,以及相关干扰素刺激基因、趋化因子、细胞因子和 T 细胞应答等上调;另外,2 名转移性黑色素瘤和转移性小细胞肺癌治疗的患者接受治疗后,肿瘤也得到了持久稳定的控制[54]。这一临床测试结果证明了 SYNB1891 的安全性和肿瘤治疗的有效性,同时也有望弥补免疫疗法对大部分患者没有良好响应的缺陷。
2.5 卡介苗
卡介苗(Bacillus Calmette-Guérin,BCG)是由来自法国巴斯德研究所的 Charles Calmette 和Camille Guérin 根据减毒的牛型结核分枝杆菌(Mycobacterium tuberculosis)悬液制成的活细菌制剂。他们通过将牛型结核分枝杆菌在含有胆汁的培养基中传代培养来实现分岐杆菌的减毒,并在传代超过 1 000 次后获得了供临床使用的减毒菌株[55]。
起初,卡介苗的作用是为了治疗哮喘性支气管炎及预防结核病和结核性脑膜炎[56],直到 1959 年,卡介苗首次用于癌症免疫治疗,并在治疗及预防肿瘤中取得了很好的效果。1976年,卡介苗治疗佐剂首次成功应用于治疗复发性浅表性膀胱癌,这是具有划时代意义的研究成果[57]。随后,卡介苗于 1990 年获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于临床治疗[41]。直至 40 年后的今天,卡介苗已成为复发性浅表性膀胱癌治疗中最常用的佐剂。
虽然卡介苗治疗肿瘤的机理尚无定论,但主流的观点认为卡介苗是通过激活局部和全身的免疫反应来产生抗肿瘤效果[42]。研究表明,卡介苗通过灌注的方式进入膀胱后,激活尿路上皮细胞和抗原呈递细胞,产生 IL-1β、IL-8、IL-15 和 IL-18 等细胞因子以及 CXC 趋化因子配体 10 (CXCChemokine Ligand 10,CXCL10)、GM-CSF等趋化因子,从而吸引中性粒细胞、巨噬细胞、CD4+T 细胞和 CD8+T 细胞等免疫细胞的募集[43-44],这些免疫细胞通过产生活性氧中间体或释放促凋亡因子对肿瘤细胞具有直接杀伤作用[57]。同时也有研究表明,肿瘤浸润性 CD4+T 细胞数量的增加、CD4+T 细胞与 CD8+T 细胞比率的增加都和肿瘤的治疗效果显著相关[58]。
3 合成生物学推动肿瘤细菌疗法的临床开发
截至 2021 年,虽然已有多种细菌治疗肿瘤的案例报道(表 1),其中以卡介苗为代表的肿瘤细菌疗法在治疗和预防浅表性膀胱癌方面效果显著、临床安全,使其在诸多处于临床前研究和临床测试阶段的活菌制剂中脱颖而出,成为肿瘤细菌疗法的典范(图 1)[55]。但就目前来说,肿瘤细菌疗法在临床开发中面临着两方面的关键挑战:一是如何在保证活菌药物生物安全性的前提下,提高细菌的肿瘤治疗能力[59]。传统的基因工程技术不能系统性地修饰细菌功能,从而不能很好地平衡细菌毒力和肿瘤治疗效力之间的关系。例如,VNP20009 虽然降低了沙门氏菌天然毒力,避免了细菌毒副作用,但却损失了细菌对肿瘤的抑制效果[46]。挑战二是解析细菌治疗肿瘤的现象背后潜藏的治疗机理,活菌药物是如何对肿瘤细胞起到杀伤作用的,至今仍是一个待解之迷。肿瘤微环境的复杂性,活菌制剂的不可控性都给更深入的分子机理研究带来严峻的挑战。

图1 治疗肿瘤细菌在临床前和临床试验中的进展情况Fig. 1 Progress in preclinical and clinical trials for the bacterial therapeutics
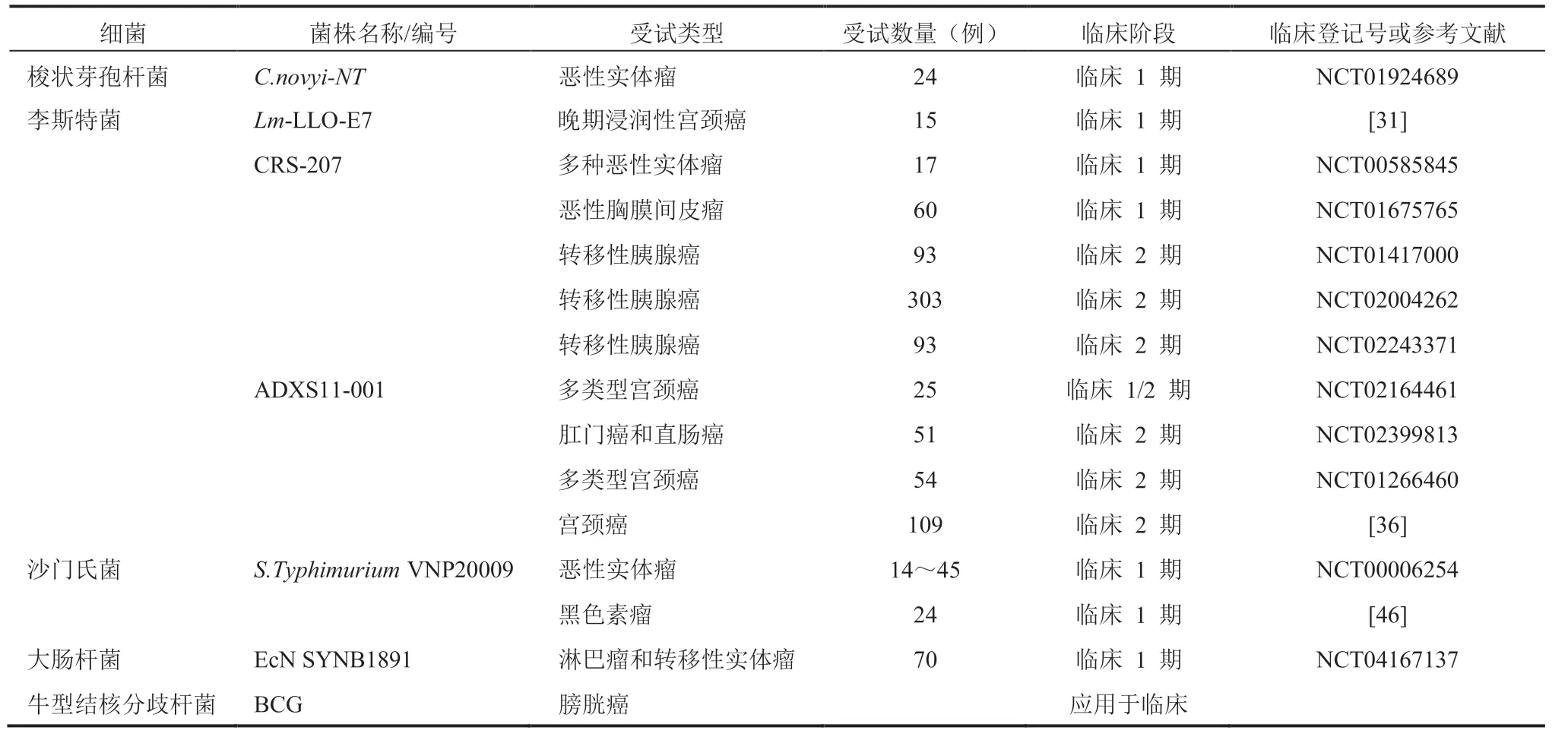
表1 肿瘤细菌疗法在临床测试中的范例Table 1 Examples of bacterial therapeutics in clinical trial
近年来,合成生物学作为一门以理性设计生物行为为目标的学科快速发展,已成为更复杂、更精确地设计细菌行为的重要方法[60]。这种方法利用细菌作为模块化的工程平台,将基因和启动子元件合理设计组合,创造出微妙而复杂的基因线路,从而能够更精确地控制细菌的生理行为,加强对细菌的生物安全控制,调控细菌表达治疗分子的释放,增强细菌对疾病的治疗能力等(图 2)[61]。因此,合成生物学有望成为细菌疗法临床开发的助推剂,面对肿瘤细菌疗法在临床测试中面临的严峻挑战,提高细菌制剂的研发质量,强力推动肿瘤细菌疗法走向临床应用。

图2 合成生物学推动肿瘤细菌疗法的临床开发Fig. 2 Synthetic biology in promoting clinical advances of bacterial anti-cancer therapy
3.1 面向临床的生物安全性
目前,通过基因工程改造能够实现对细菌减毒或构建营养缺陷型菌株,从而限制细菌向正常组织器官扩散。这一策略在临床前药理学和毒理学测试中均显示出不错的安全性[62-63]。然而,为了获得更好的防治细菌逃逸效果,研究者并不仅仅满足于此。根据实体瘤内氧气浓度比正常组织低的特性,Li 等[64]利用氧气敏感启动子元件设计了一套基于“自杀开关”的合成生物学基因线路,构建了一株仅能在瘤内定植的专性厌氧鼠伤寒沙门氏菌 YB1,由此规避细菌的逃逸风险。他们首先利用厌氧启动子 PpepT 驱动必需基因asd转录表达,再用需氧启动子 PsodA 反向驱动asd的转录表达,从而实现 PsodA 对 PpepT 启动子本底表达的抑制作用,确保一旦细菌逃脱瘤内扩散到正常组织,高氧气的环境会诱导 PsodA 抑制必需基因asd的表达,从而使细菌因不能合成细胞壁而“自杀”。实验结果也表明,在乳腺癌裸鼠模型中,YB1 在瘤内的定植数量要显著高于正常组织器官内的数量[64-65]。
此外,上述报道的活菌制剂 SYNB1891 不仅利用了厌氧启动子 Pfnrs驱动 STING 激动剂环二磷酸腺苷基因dacA在瘤内的特异表达,还敲除了细菌胸腺嘧啶核苷酸合成酶基因thyA和大肠杆菌合成细胞壁的关键基因dapA。相比于正常组织,实体瘤内的胸腺嘧啶核苷酸合成酶的浓度比较丰富,这就使得细菌在缺失thyA基因的情况下仅能在瘤内定植和复制;同时,细菌dapA基因的缺失使细菌丧失了合成细胞壁的能力,从而使细菌在进入机体后,会逐渐被免疫细胞清除。这种对细菌关键基因的“双敲除策略”更近一步提高了细菌的生物安全性,大大降低了安全风险,也促使 SYNB1891 能够在临床安全风险评估中取得成功[49]。
另一种通过合成生物学理念增强细菌疗法临床安全性的策略是由 Ho 等[66]开发的“合成生物学食用疗法”。通过巧妙的设计重新编程EcN,使细菌能够在肠道组成型表达组蛋白样蛋白 A(Histone-like protein A,HlpA)。其中,组蛋白样蛋白 A 能特异结合结直肠癌细胞上的硫酸乙酰肝素蛋白多糖(Heparan Sulfate Proteoglycan,HSPG),同时 EcN 通过表达分泌黑芥子酶可以将患者食用的西兰花中的天然成分硫代葡萄糖苷(Glucosinolates)转化为抗癌小分子萝卜硫素(Sulphoraphane)。在小鼠结直肠癌模型的研究显示,该方法对鼠源和人源结肠癌细胞的抑制率高达 95%。这种将可食用的西兰花和“益生菌酸奶”的联合疗法实现了将日常食物转化为癌症预防及治疗的药物分子,进一步确保了生物安全性。
3.2 提高肿瘤治疗的有效性
细菌可以用于治疗肿瘤的一个重要原因是其能够作为免疫激活剂扭转瘤内的免疫抑制微环境。早在 150 年前,William B. Coley 研制的灭活细菌制剂——Coley’s Toxins 从某种程度上来讲可能就是利用病原微生物进入体内后,打破体内原本“沉寂”的免疫微环境,激活免疫细胞杀伤细菌的同时也消灭癌细胞,从而对恶性肿瘤达到“以毒攻毒”的治疗效果。因此,研究者将Coley 称为“癌症免疫疗法之父”[67]。
合成生物学“自下而上”的设计理念,给予科学家极大的便利,通过改造细菌作为递送药物的智能载体,实现药物分子在瘤内不同层次的递送,从而达到调节免疫系统治疗肿瘤的目的[3]。目前已经报道的细菌可递送药物分子,包括溶血素 A(ClyA)、FAS 配体(FASL)、肿瘤坏死因子相关凋亡诱导配体(TRAIL)等细胞毒性分子,IL-2、IL-18、CCL21 等细胞因子,以及 p53 等调控因子等[61]。其中,Zheng 等[68]基于鼠伤寒沙门氏菌 ΔppGpp 开发的一种组成型“智能”载药平台,能够使其表达及分泌创伤弧菌(Vibrio Vulnificus)鞭毛蛋白 FlaB,通过 FlaB 协同活化TLR5 和 TLR4 信号通路,提高肿瘤抑制因子的分泌,显著增强免疫系统对结肠癌细胞的杀伤作用。另外,为了改善细菌本身治疗肿瘤效果不佳的问题,本文作者团队[69]提供了一种细菌与光热纳米颗粒的联合治疗策略。通过将光热纳米颗粒 INPs 偶联在减毒鼠伤寒沙门氏菌菌株 YB1上,开发出能够感应外界红外光强的“合成溶瘤菌”。相比于未结合纳米颗粒的对照菌株,细菌在瘤内的定植数量提高了 14 倍。同时,这种联合疗法不仅能够对细菌和肿瘤进行示踪和成像,还能有效提高对较大膀胱癌实体瘤(>500 mm3)的治疗效果。提高工程细菌在瘤内的群体定植能力是实现肿瘤治疗的关键步骤,但目前关于工程细菌定植能力的理性设计尚缺乏理论指导。基于合成生物学造物致知的理念,本文作者团队[70]以大肠杆菌 MG1655 为模式生物,系统研究了细菌空间定植的进化稳定性策略,发现种群在不同大小生境的定植,都对应着一个最优的迁徙和生长策略,这为未来理性设计工程细菌瘤内空间定植提供了重要的科学依据和基础的理论指导。逻辑门控系统是合成生物学最具标志性的基因线路之一。逻辑门控系统有助于改造细菌实现其对两个或多个输入肿瘤相关信号的整合,以便特异表达具有治疗效果的功能性基因的输出,实现其在肿瘤诊断、预防和治疗方面的高度选择性应用场景[71]。Anderson 等[72]基于逻辑门控系统成功将大肠杆菌改造成具有肿瘤侵袭能力的合成工程菌。该系统应用双输入逻辑与门基因线路,设计大肠杆菌只有在感知到肿瘤内低氧气浓度和自身群体密度后,才会特异性输出表达来自假结核耶尔森菌(Yersinia pseudotuburculosis)的侵染素编码基因inv,使细菌能够侵入包括 HeLa、HepG2 和U2OS 等癌细胞系。这篇具有里程碑意义的文章开创了合成生物学优化肿瘤细菌疗法的先河,为细菌疗法的优化带来了更多可能。
另外,为了获得更好的肿瘤治疗效果,可能还需要进一步优化细菌搭载药物分子可控释放能力。通过合成生物学手段构建的群体感应基因线路能够感知环境因素的变化,完成药物分子表达释放的智能切换,这套对基因表达智能精确的时空控制,有助于实现可控化的药物管理策略,增强抗肿瘤效果[73]。根据上述理念,Din 等[74]和Danino 等[75]构建了一套基于细菌载体表达抗肿瘤药物的同步化合成和裂解释放系统。这套系统不仅能够维持细菌在实体瘤内的定植数量,降低生物安全风险,还能在细菌数量增多后,完成细菌菌体的裂解和抗肿瘤药物的释放。小鼠实验显示,将具有群体感应系统的沙门氏菌与化疗药物5-氟尿嘧啶(5-FU)联用,可以使小鼠的平均生存时间增加约 50%,疗效提高正是得益于系统药物释放的同步周期性和稳定性[74]。
应用同样的思路,该课题组通过改造一株非致病性大肠杆菌,在肿瘤微环境中特异性裂解并释放 CD47 纳米抗体拮抗剂达到治疗黑色素瘤的目的。CD47 是一种抗吞噬细胞受体,通常在几种人类癌症组织中过表达。研究表明,通过群体感应裂解系统表达 CD47 纳米体拮抗剂可增加肿瘤浸润 T 细胞的激活数量,刺激肿瘤抗原特异性免疫反应,从而刺激肿瘤快速消退[76]。另外,该课题组还将群体感应裂解释放系统与免疫检查点抑制剂疗法联用,通过设计 EcN 在瘤内特异性周期化裂解表达 PD-L1 和 CTLA-4 拮抗剂,激活增强免疫系统对肿瘤细胞的杀伤作用,并在 B 细胞淋巴瘤小鼠模型上将肿瘤的抑制效果维持在 15天以上[77]。
4 总结与展望
虽然目前已有多种细菌制剂在动物模型中被证明具有治疗癌症的潜力,如梭状芽胞杆菌等专性厌氧菌,或者如沙门氏菌、单核细胞增生性李斯特菌和大肠杆菌等兼性厌氧菌,但是这些菌株都还处于临床前或临床实验阶段,并没有达到预期的人体临床试验效果。究其原因,主要是由于活细菌制剂在临床评估中仍有一些挑战需要克服:
(1)如何确保细菌治疗肿瘤的安全性。将病原菌用于肿瘤治疗,可能会引起全身毒性副作用。确保细菌在瘤内特异性定植的前提下,降低细菌逃逸风险,是研究者在研发溶瘤细菌药物时需要优先考虑的问题。一种新的“合成生物学防护策略”是构建非天然氨基酸代谢依赖型菌株,使细菌无法在代谢途径上绕过生物防护机制[78]。虽然基因改造可能限制了细菌的致病性,但并不能保证基因改造模块的稳定性和基因线路的遗传稳定性。因此,在早期临床试验中,不仅要确保细菌对临床患者的生物安全性,也要确保细菌不会感染传播到密切接触者。故需要设置严格详密的监管框架和防护体系来规避上述风险,如样品采集程序、科学监测方法、应急处理方式等[79]。对此,FDA 也于 2018 年发布了一份行业指南,旨在解决这些问题,以帮助研发者和实验人员设计合理的研究策略[80]。另外,也需要特别考虑前期接受过常规放疗或化疗无效的癌症患者,这类免疫系统受损的患者若暴露于细菌感染,可能会导致巨大的风险,对生命安全造成不可控的结果。
(2)如何针对不同患者确定“个性化诊疗标准”。由于不同患者的年龄、身体素质、罹患癌症类型都不相同,如何确立溶瘤细菌药物的用药剂量、用药周期、给药后辅助药剂的选用等,都需要经过谨慎的求证和测试。特别是在患者肿瘤消退后,如何使用合适的方法来清除体内的细菌。抗生素可以作为一种行之有效的策略,然而,治疗后使用抗生素必须谨慎,因为过度使用抗生素会导致许多细菌产生耐药性,导致出现新的安全风险[81]。
(3)如何确定合理的给药方式。给药方式的不同也会造成患者机体免疫响应的差异和副作用水平的不同,静脉滴注的方式虽然可以确保细菌制剂快速达到并定植于肿瘤部位,但也会对患者机体造成严重损害,引起败血症,危及生命。目前,活细菌制剂在临床上的常用给药方式主要包括口服给药和局部给药等,如益生菌产品由于不存在细菌毒性,一般是选择口服给药的方式;但大多数活细菌肿瘤治疗制剂由于天然毒性的原因,临床研究者还是会优先采取局部给药,包括瘤内注射、瘤旁注射或如 BCG 一样采取膀胱灌注的给药方式[51]。
综上考虑,从活细菌肿瘤治疗制剂的研发到临床前和临床试验的成功仍然是一段充满严峻考验的漫漫长路,还需研究者通过设计更严格、更合理、更科学的临床前基础研究来逐渐缩短这段距离。而随着合成生物学和肿瘤免疫学相关研究的不断发展成熟,以及现代生物技术的日益完善,肿瘤细菌疗法在未来必将取得重要突破,给癌症患者带来更多康复的希望,造福社会,造福于民!
