新疆马铃薯甲虫对噻虫嗪的抗性监测及其细胞色素P450基因表达分析
2021-07-30石鑫李莎王志敏付开赟付文君姜卫华
石鑫,李莎,王志敏,付开赟,付文君,姜卫华
新疆马铃薯甲虫对噻虫嗪的抗性监测及其细胞色素P450基因表达分析
石鑫1,李莎1,王志敏1,付开赟2,付文君3,姜卫华1
1南京农业大学植物保护学院,南京 210095;2新疆农业科学院植物保护研究所/农业农村部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;3新疆伊犁州农业技术推广总站,新疆伊宁 835000
【】以世界性害虫马铃薯甲虫()为研究对象,筛选其参与噻虫嗪解毒的细胞色素P450主效基因。于2018、2019年利用点滴法监测新疆察布查尔县、伊宁县、塔城市、乌鲁木齐市和吉木萨尔县11个马铃薯甲虫田间种群对噻虫嗪的抗性水平,并测定分析噻虫嗪LD50处理72h后成虫中3种主要解毒酶细胞色素P450酶(P450)、谷胱甘肽-转移酶(GST)和酯酶(EST)的活性变化。利用Illumina HiSeqTM2500高通量测序技术进行转录组测序,获得抗性和敏感种群之间的差异表达基因(DEG),运用实时荧光定量PCR(qRT-PCR)技术验证3个P450基因并分析6个P450基因(、、和)在不同种群及噻虫嗪处理后的表达情况。抗性监测发现,2018年的YN1、URMQ1、TC和QPQL1以及2019年的YN2和JMS种群成虫对噻虫嗪抗性倍数(RR)分别达到5.99、8.81、10.86和20.33倍和11.82、14.05倍,为低至中水平抗性。解毒酶活性测定结果表明,2个敏感种群URMQ2、URMQ3以及2个抗性种群YN2、JMS成虫分别经噻虫嗪LD50处理72 h后其P450活性均显著增加,分别为对照的1.76、2.75、1.91和1.66倍。另外,URMQ3种群的GST(CDNB和DCNB为底物)及URMQ2、YN2种群的EST活性显著升高,分别为对照的1.19、2.10倍和1.35、1.91倍。转录组分析表明,通过合并组装分别获得噻虫嗪敏感和抗性种群样品56 872 051和62 249 136个原始序列数据以及55 903 706和61 082 076个过滤后的序列数据,过滤后的序列长度分别为8.39和9.16 G,碱基错误率均为0.03%。抗性种群中差异表达的P450基因13个,其中2个基因显著上调。3个上调的P450基因和的qRT-PCR检测结果与转录组测序结果基本一致,qRT-PCR分析还发现和在抗性种群成虫中表达量显著增加,噻虫嗪LD50处理均可引起URMQ2种群4龄幼虫和成虫表达量显著上调。相关性分析发现成虫对噻虫嗪的抗性水平与表达量呈显著正相关。可能在马铃薯甲虫中对噻虫嗪具有重要的解毒作用,其他基因的作用也不能排除。
马铃薯甲虫;噻虫嗪;抗药性;细胞色素P450;基因表达
0 引言
【研究意义】马铃薯甲虫()属鞘翅目叶甲科,是世界公认的马铃薯毁灭性检疫害虫。除直接取食危害寄主植物叶片外,成虫还能传播褐斑病、环腐病等病害,造成农作物产量和品质的巨大损失[1-2]。马铃薯甲虫自20世纪90年代初经哈萨克斯坦口岸传入我国新疆,现已扩散至天山以北地带,对当地马铃薯安全生产构成持续的威胁[3]。作为第4大类杀虫剂[4],新烟碱类杀虫剂以其作用机制独特、高效、低毒、对环境安全成为防治马铃薯甲虫的主要杀虫剂之一,其中1995年问世的吡虫啉和1998年市场化的噻虫嗪分别为第1代和第2代新烟碱类药剂的代表品种[5]。随着使用的频繁,国内外抗性调查发现马铃薯甲虫已对吡虫啉等产生了不同水平的抗性。因此,阐明相关抗药性分子机制对于防止抗性加剧及延长该类药剂的使用寿命具有重要意义。【前人研究进展】Zhao等[6]2000年报道纽约州长岛马铃薯甲虫成虫对吡虫啉产生了100—150倍的极高水平抗性;Mota-Sanchez等[7]于2006年报道该地区种群对吡虫啉的抗性已发展到309倍,另外美国特拉华、爱达荷、伊利诺斯等地区以及加拿大的安大略、爱德华王子岛、魁北克田间种群也对吡虫啉和噻虫嗪产生不同程度的抗性。在我国,王志田等[8]调查发现新疆奇台和乌鲁木齐马铃薯甲虫成虫对吡虫啉的抗性个体达到30%左右;刘萍等[9]监测发现2009年新疆6个马铃薯甲虫成虫种群中有3个对啶虫脒和噻虫嗪产生低水平抗性,2010年监测的6个种群均对噻虫嗪产生了抗性,其中低抗和中抗种群各3个。由此可见,新疆马铃薯甲虫对新烟碱类药剂尤其是噻虫嗪的抗性逐年发展。解毒代谢作用的增强是昆虫抗药性产生的重要机制之一。昆虫体内的解毒酶系主要包括细胞色素P450单加氧酶系(cytochrome P450 monooxygenases,P450)、谷胱甘肽-转移酶(glutathione-transferase,GST)和酯酶(esterase,EST),其中由P450介导的昆虫抗药性是主要的抗性机制。研究表明害虫对新烟碱类杀虫剂抗性的产生主要与P450基因过表达有关。Kaplanoglu等[10]对吡虫啉抗性马铃薯甲虫种群中显著上调的进行RNA干扰(RNA interference,RNAi),验证了该基因在抗性产生中的作用;Clements等[11-12]发现美国威斯康星州吡虫啉抗性马铃薯甲虫成虫过表达,通过RNAi可使马铃薯甲虫对吡虫啉的抗性水平降低,作者随后在该抗性种群中又发现另一个过表达的P450基因[13]。【本研究切入点】近年来抗性监测已发现新疆马铃薯甲虫对噻虫嗪的敏感性逐年下降,抗性分布不断扩展且水平较高,但有关抗性分子机制尚不明确。【拟解决的关键问题】监测新疆不同地区马铃薯甲虫对噻虫嗪的抗性水平,测定噻虫嗪处理对主要解毒酶活性的影响,利用转录组分析抗性和敏感种群的差异表达基因(differentially expressed gene,DEG),定量分析不同田间种群以及噻虫嗪处理后的6个P450基因的表达水平,筛查与噻虫嗪抗性相关的P450基因,为阐明马铃薯甲虫对噻虫嗪的代谢抗性分子机制打下基础,同时为马铃薯甲虫的抗性治理提供依据。
1 材料与方法
试验于2018—2019年在新疆农业科学院植物保护研究所安宁渠试验基地和南京农业大学植物保护学院昆虫生理生化与分子生物学实验室完成。
1.1 供试昆虫
马铃薯甲虫分别于2018年和2019年6—7月采自新疆察布查尔县(Qapqal,QPQL)、伊宁县(Yining,YN)、塔城市(Tacheng,TC)、乌鲁木齐市(Urumqi,URMQ)和吉木萨尔县(Jimusar,JMS)的田间马铃薯苗上,种群具体采集信息见表1。室内用马铃薯苗饲养,养虫室条件为(26±1)℃,相对湿度50%—60%,光周期为光/暗=16 h/8 h。选取大小一致、生长状态良好的4龄幼虫和成虫作为试虫。2018年抗性测定参照的敏感种群QPQL-S于2015年6月采自察布查尔县扎库齐牛录乡,不接触药剂下饲养3年。
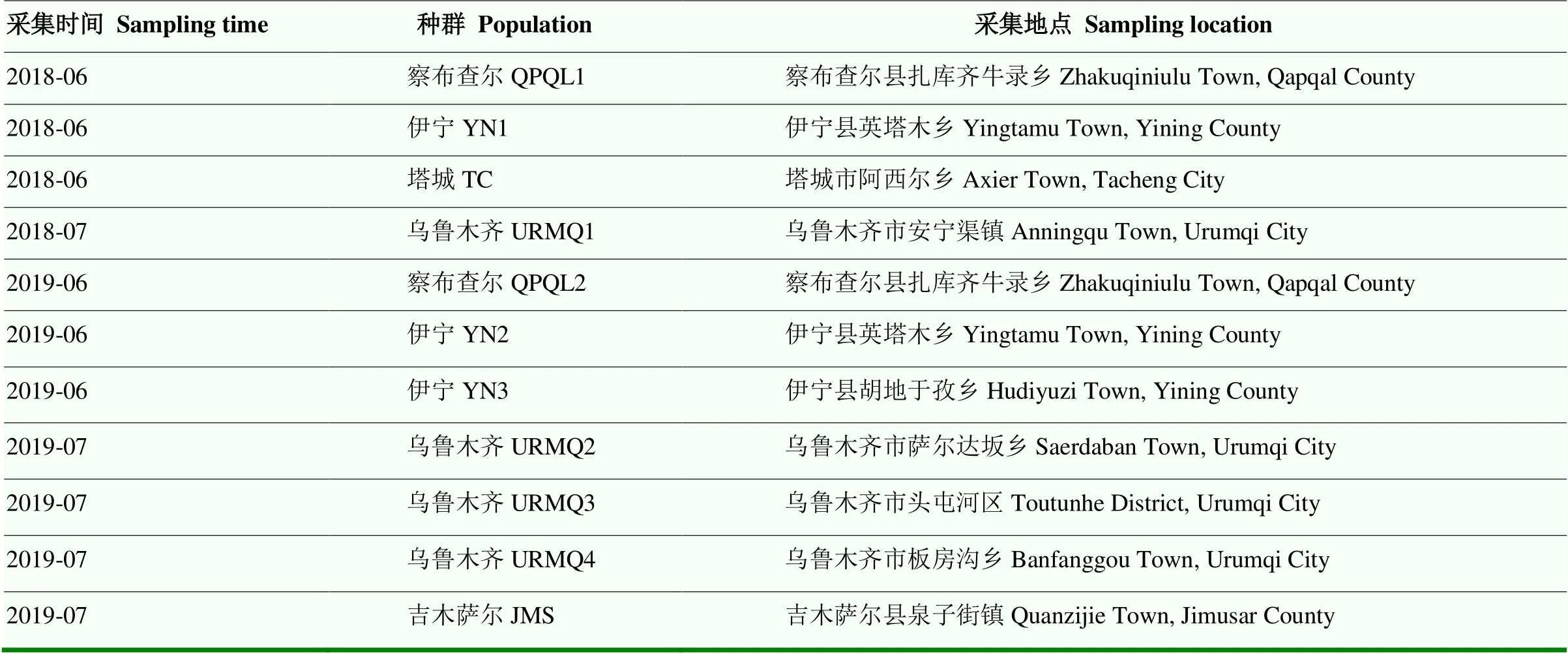
表1 马铃薯甲虫种群采集信息
1.2 供试药剂
97%吡虫啉原药(江苏红太阳有限公司);95%噻虫嗪原药(盐城双宁农化有限公司)。
1.3 毒力测定
采用微量点滴法。使用丙酮溶解原药并稀释制备1、0.5、0.25、0.125、0.0625、0.03125、0.015625、0.007813 mg·mL-1系列梯度浓度的药液。采用Hamilton微量进样器进行药剂点滴,药剂点滴部位:成虫腹部腹面第二节,4龄幼虫腹部背面的第3、4节;点滴量:4龄幼虫0.22 μL/头,成虫1.1 μL/头。点滴同体积的丙酮作为对照。每个处理试虫10头,共3个重复。处理后置于塑料培养皿(直径9 cm),在室内用新鲜马铃薯叶饲养,72 h后检查死亡虫数。马铃薯甲虫死亡标准参考刘萍等[9]和卢伟平等[14]。
1.4 解毒酶活性测定
1.4.1 酶液制备 收集URMQ2、URMQ3、YN2和JMS种群成虫分别经噻虫嗪LD50点滴法处理72 h后的存活个体,对照为丙酮处理,将试虫单头放于匀浆器内,加入1.2 mL 0.1 mol·L-1磷酸缓冲液(pH 7.6,其中含1 mmol·L-1EDTA,1 mmol·L-1DTT,1 mmol·L-1PTU,1 mmol·L-1PMSF)匀浆用于细胞色素P450单加氧酶活性测定;加入1.2 mL 0.1 mol·L-1磷酸缓冲液(pH 7.6)匀浆用于谷胱甘肽-转移酶活性测定;加入1.2 mL 0.02 mol·L-1磷酸缓冲液(pH 7.0)匀浆用于酯酶活性测定。匀浆液于4℃,13 000×下离心15 min后,将上清液转移到新的1.5 mL离心管,重复离心一次后,取上清液作为酶源。每个处理6个生物学重复,3个技术性重复。
1.4.2 P450活性测定 在96孔酶标板中加入100 μL 2 mmol·L-1对硝基苯甲酚(PNA)和90 μL酶液,混合液在30℃温育3 min,然后加入10 μL 9.6 mmol·L-1NADPH启动反应。利用SPECTRA max®340-PC型酶标仪(美国Molecular Devices公司)在波长405 nm下记录15 min内的吸光值变化,酶促反应温度为30℃。
1.4.3 GST活性测定 在96孔酶标板中分别加入10 μL稀释10倍的酶液(CDNB为底物)或25 μL酶液(DCNB为底物)、1.2 mmol·L-1CDNB或DCNB 100 μL,以及6 mmol·L-1谷胱甘肽(GSH)100 μL。在波长340 nm下记录10 min内的吸光值变化,酶促反应温度为27℃。
1.4.4 EST活性测定 在96孔酶标板中分别加入20 μL稀释10倍的酶液,0.2 mol·L-1PBS(pH 6.0)与固蓝RR盐和-乙酸萘酯(-NA)的乙醇溶液(100 mmol·L-1)以1﹕2﹕0.01比例的混合液205 μL,在波长450 nm下记录10 min内的吸光值变化,酶促反应温度为27℃。
1.4.5 蛋白含量测定 采用Bradford考马斯亮蓝法测定粗酶液的蛋白质含量,以BSA做标准曲线[15]。
1.5 转录组测序
URMQ3和JMS种群成虫用于转录组测序分析,每个种群设置3个重复,每个重复3头试虫。
转录组测序数据组装及分析:RNA的提取、cDNA文库的建立及测序工作由北京诺禾致源科技股份有限公司完成,采用Illumina HiSeqTM2500系统进行测序。使用HISAT2v2.0.5构建参考基因组的索引,并使用HISAT2 v2.0.5将配对末端clean reads与参照基因组比对,采用StringTie软件新转录本进行组装[16]。
转录组差异表达基因的筛选:首先对原始的readcount进行标准化(normalization),主要是对测序深度的校正。然后通过统计学模型进行假设检验概率(-value)的计算,最后进行多重假设检验校正(BH),得到FDR值(错误发现率)。以<0.05、|log2fold change(Fc)|≥1作为筛选标准[17],|log2Fc|越大,则基因表达差异越明显。筛选出解毒代谢酶、表皮蛋白、ABC转运蛋白、烟碱型乙酰胆碱受体等与抗性相关的差异表达基因。
1.6 马铃薯甲虫种群P450基因表达量分析
1.6.1 总RNA提取及反转录 将马铃薯甲虫4龄幼虫和成虫单头分别按照Trizol试剂说明进行总RNA提取,于-80℃冰箱贮存备用,每个处理6个重复。按照PrimeScriptTMRT reagent Kit with gDNA Eraser(日本TaKaRa公司)反转录试剂盒说明书合成cDNA。
1.6.2 实时荧光定量PCR 根据GenBank上马铃薯甲虫的序列(NCBI登录号分别为XP_023027514、XP_023018115、XP_023018114、XP_023021616、XP_ 023023178、XP_023015477),利用Beacon Designer 7.0软件设计荧光定量PCR引物,委托南京金斯瑞公司合成,以和作为内参基因[18],引物序列见表2。采用ABI 7500实时PCR系统(美国Applied Biosystems公司),以SYBR Green为染料,用稀释5倍的cDNA作为模板,测定P450基因的相对表达水平。反应体系:SYBR Premix Ex TaqTM(2×)10 µL,cDNA模板1.0 µL,上、下游引物各0.8 µL,ROX Reference Dye2(50×)0.4 µL,用无核酶水补足至20 µL。PCR程序采用两步法:95℃30 s;95℃5 s;60℃34 s,共40个循环,然后95℃15 s;60℃60 s;95℃15 s用于记录熔解曲线。每组试验重复3次。
1.7 数据处理与分析
死亡率和校正死亡率的计算使用Abbott公式,采用机率值分析法计算毒力回归曲线、LD50、相关系数及95%置信限,抗性倍数(RR)=田间测试种群的LD50/(相对)敏感种群的LD50。抗药性水平参照以下标准:敏感(RR<3.0)、敏感性降低(RR 3.1—5.0)、低水平抗性(RR 5.1—10.0)、中水平抗性(RR 10.1—40.0)、高水平抗性(RR 40.1—160.0)和极高水平抗性(RR>160.0)[19]。利用2-ΔΔCt方法[20]计算相对表达量,数据用Excel 2003进行分析。利用SPSS 18.0软件(One-way ANOVA)进行数据的差异显著性分析(Tukey检验,<0.05),以及对抗性水平和基因表达量进行相关性分析。

表2 马铃薯甲虫实时荧光定量PCR引物
2 结果
2.1 新疆不同马铃薯甲虫种群对噻虫嗪的抗性
对于4龄幼虫,2018年测试种群中,与敏感种群QPQL-S相比,YN1、TC和URMQ1种群对噻虫嗪均表现敏感(RR分别为1.88、2.14和2.42倍),而QPQL1种群为敏感性降低(RR为4.23倍);2019年测试种群中,URMQ2种群对噻虫嗪的LD50最低(5.52 ng/头),以此作为相对敏感种群,URMQ3、URMQ4、JMS、QPQL2、YN3种群对噻虫嗪均保持敏感(RR<3倍),仅YN2种群敏感性降低(RR为3.71倍)(表3)。
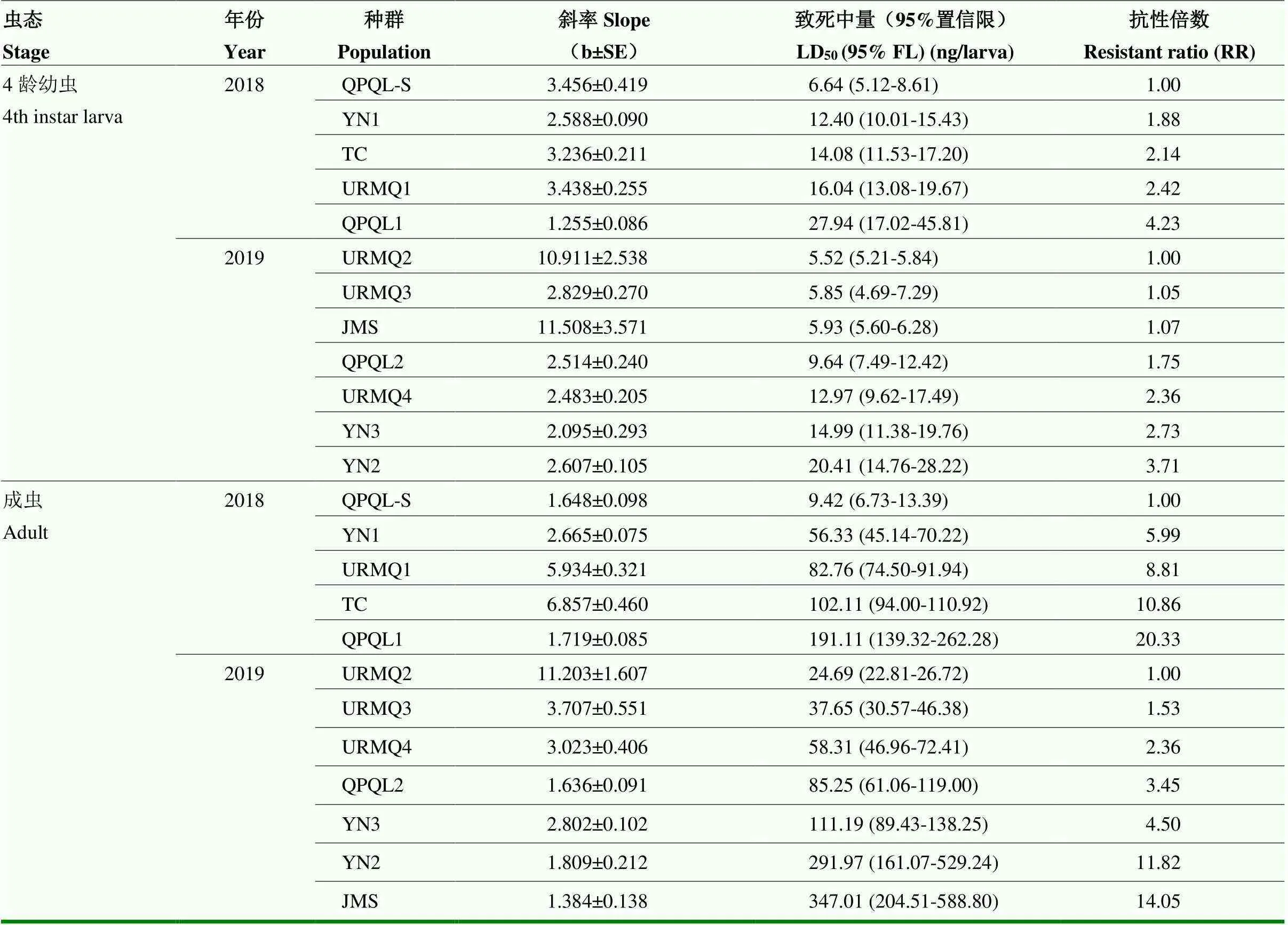
表3 新疆不同马铃薯甲虫种群4龄幼虫和成虫对噻虫嗪的敏感性
在成虫中,与QPQL-S相比,2018年测试种群均对噻虫嗪产生抗性,其中YN1和URMQ1种群为低水平抗性,而TC和QPQL1种群已达中等水平抗性,RR分别为5.99、8.81、10.86和20.33倍;2019年所有种群中,URMQ2种群对噻虫嗪的LD50最低,为24.69 ng/头,与之相比,URMQ3和URMQ4种群对噻虫嗪保持敏感(RR<3倍),QPQL2、YN3种群为敏感性降低,RR分别为3.45和4.50倍,YN2和JMS种群则达到中水平抗性,RR分别为11.82和14.05倍(表3)。
从两年的抗性监测结果可以看出新疆马铃薯甲虫成虫对噻虫嗪的敏感性普遍较低,抗性达低至中等水平,而4龄幼虫对噻虫嗪普遍敏感。
2.2 噻虫嗪胁迫下马铃薯甲虫的解毒酶活性
噻虫嗪可引起3种解毒酶的活性发生改变。其中P450活性在4个测试种群URMQ2、URMQ3、YN2、JMS处理组的活性均显著提高,分别为对照的1.76、2.75、1.91和1.66倍;URMQ3种群处理组的GST活性(CDNB和DCNB为底物)活性显著升高,分别为对照的1.19和2.10倍,而其他种群的GST活性无显著变化;URMQ2和YN2种群处理组的EST活性显著增加,分别为对照的1.35和1.91倍,其他种群的EST活性与对照相比差异不显著(图1)。
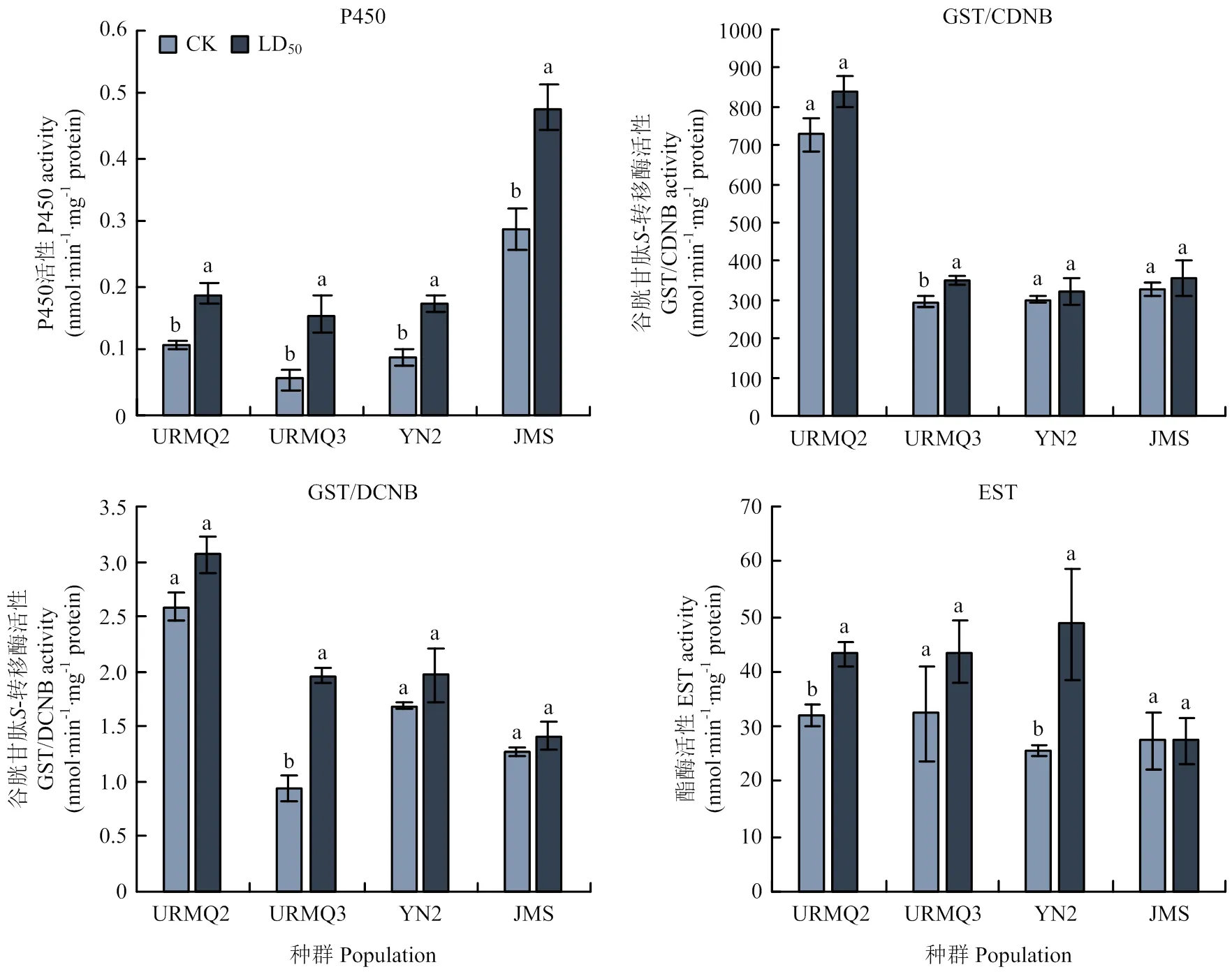
图中数据为平均数±标准误,柱上不同字母表示差异显著(P<0. 05)。下同
2.3 马铃薯甲虫敏感和抗性种群的转录组分析及验证
2.3.1 转录组数据组装 对噻虫嗪敏感种群UMRQ3和抗性种群JMS成虫进行转录组分析,分别获得56 872 051和62 249 136个原始序列数据以及55 903 706和61 082 076个过滤后的序列数据;过滤后的序列长度分别为8.39和9.16 G;碱基错误率均为0.03%;Phred数值>20的碱基占总碱基的百分比(Q20)分别为97.77%和97.75%;Phred数值>30的碱基占总碱基的百分比(Q30)分别为93.28%和93.25%;鸟嘌呤+胞嘧啶(guanine cytosine,GC)含量分别为38.95%和38.68%,表明转录组测序质量较高(表4)。
2.3.2 抗药性相关的差异表达基因 按照解毒机
制进行分类,鉴定到差异表达的P450基因13个,谷胱甘肽-转移酶基因1个,酯酶基因7个,尿苷二磷酸-葡萄糖基转移酶基因9个,表皮蛋白基因6个,ABC转运蛋白基因12个,烟碱型乙酰胆碱受体基因11个(表5)。
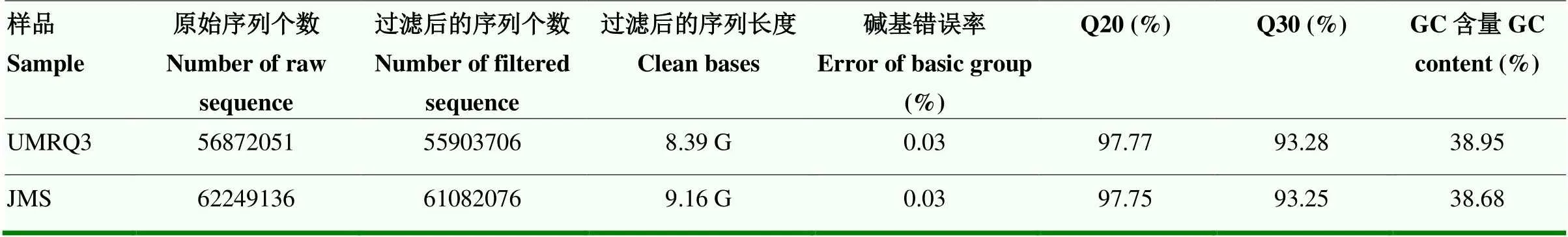
表4 敏感和抗性马铃薯甲虫种群成虫的转录组测序结果
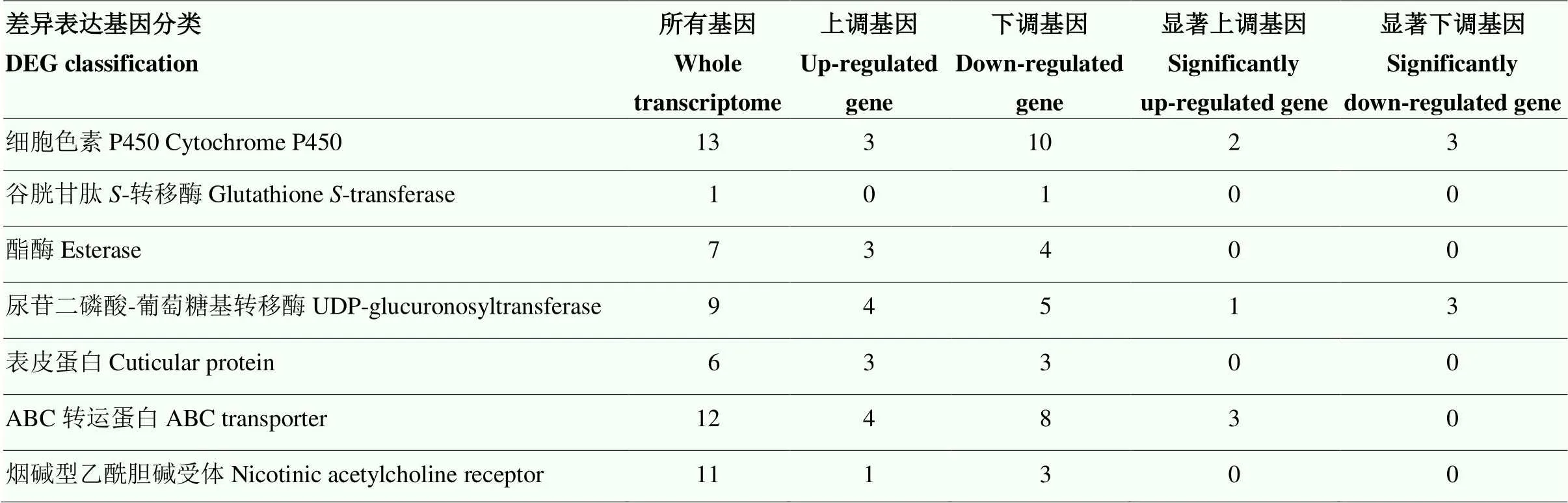
表5 抗性种群和相对敏感种群的差异表达基因
log2FC>1为判断基因上调的标准,<0.05即为显著。下同
Up-regulated transcripts were classified using a log2FC>1 and significant difference at<0.05 level. The same as below
抗性种群JMS中表达量上调的基因见表6,其中,显著上调的P450基因有2个(111509985、111511395)、ABC转运蛋白基因3个(有2个基因为新预测的基因,NCBI未见相关序列,由转录组测序公司编号)、尿苷二磷酸-葡萄糖基转移酶基因1个,显著上调的基因用加粗字体表示。
2.3.3 抗性和敏感种群P450差异表达基因的验证 DEG测序文库结果显示,抗性种群JMS的和基因表达量显著上调(<0.05),分别为相对敏感种群的13.45和4.44倍,在抗性种群中的表达量为相对敏感种群的3.60倍,但差异不显著。qRT-PCR检测结果显示这3个P450基因和在JMS种群中的表达量显著上调(<0.05),分别为相对敏感种群URMQ3的5.03、5.32和8.01倍(图2)。qRT-PCR检测结果与DEG测序文库显示的结果基本一致。
2.4 新疆不同马铃薯甲虫种群P450基因的表达水平
2018年4龄幼虫中,与QPQL-S相比,和在QPQL1和YN1种群、在TC种群的表达量均显著增加,表达量分别为QPQL-S的1.90、1.58、1.53、1.44和1.61倍(图3-A);2019年4龄幼虫中,与相对敏感种群URMQ2相比,YN3种群中的表达量最高,显著增加为URMQ2的6.74和4.15倍;JMS种群以及QPQL2的的表达量在所有种群中最高,显著上调,表达量分别是URMQ2的5.35、21.95、3.51和3.11倍。此外,其他种群的其他基因表达量无显著变化(图3-B)。
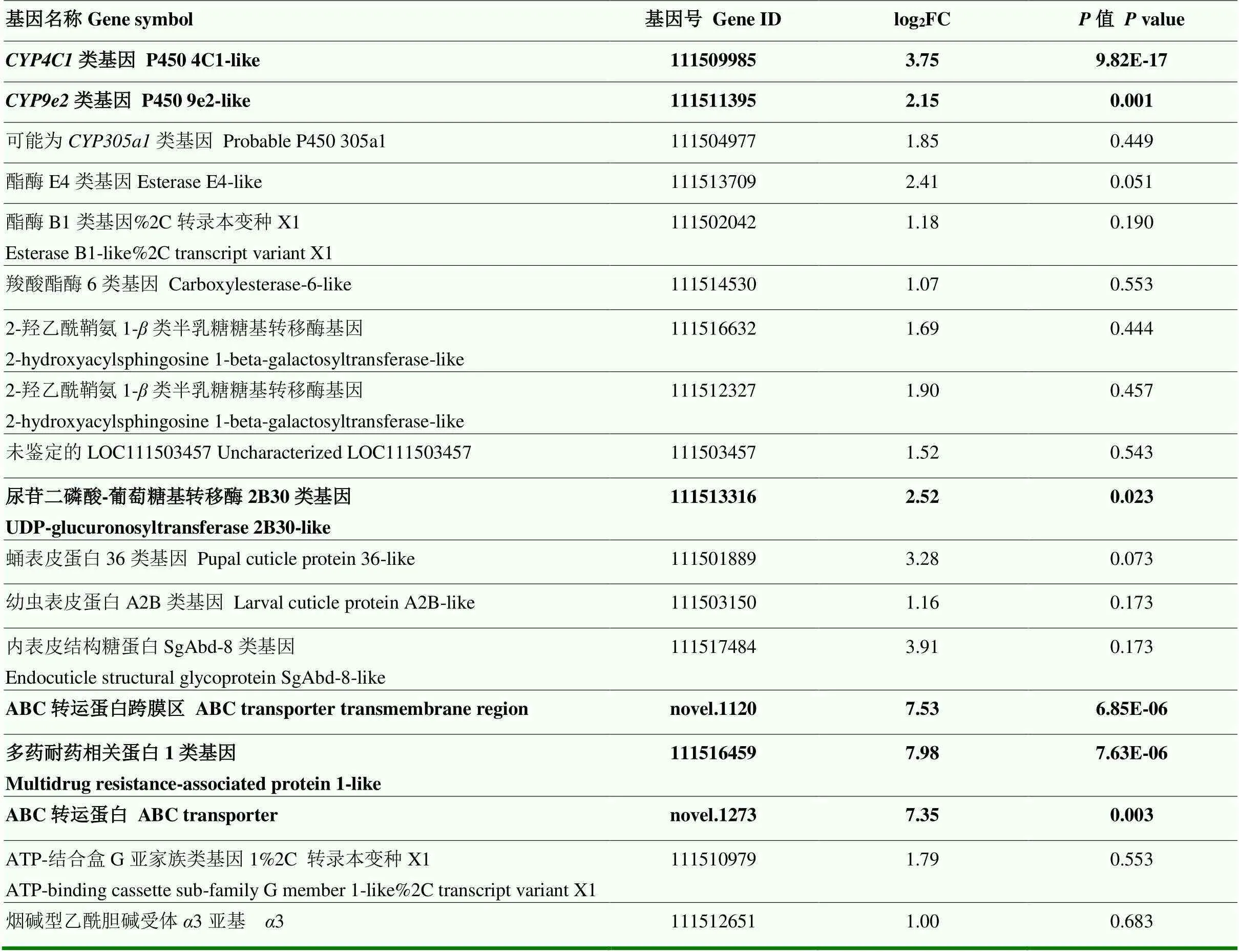
表6 抗性种群中表达量上调的基因
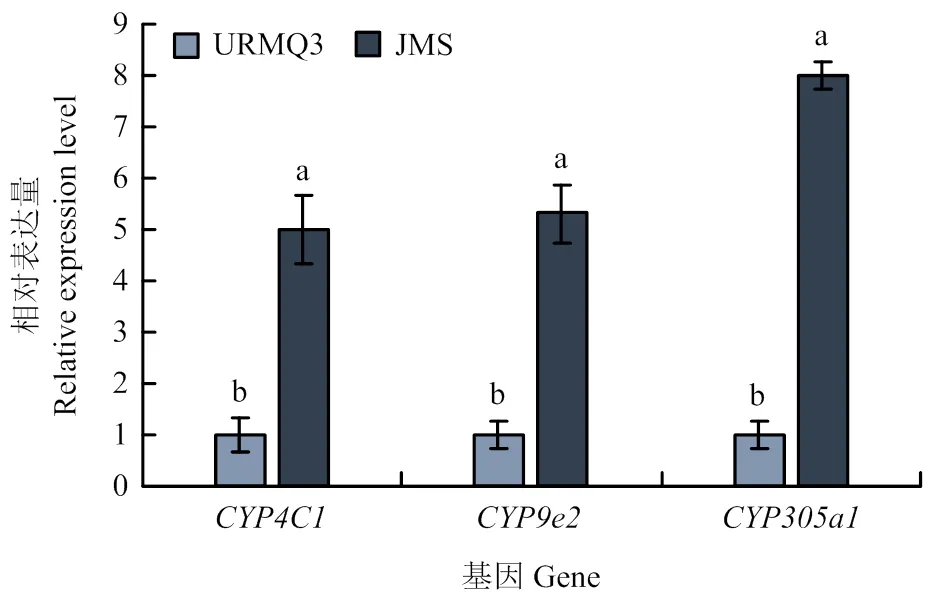
图2 qRT-PCR技术验证3个P450基因的表达
2018年成虫中,、和分别在QPQL1、URMQ1种群中显著上调,表达量分别为QPQL-S的1.53、1.50和2.22倍,而和在TC种群中的表达量均显著降低,表达量是QPQL-S的49.45%和52.55%(图4-A);2019年成虫中,与相对敏感种群URMQ2相比,YN2种群、的表达最高且显著增加,表达量分别为URMQ2的5.56、4.03倍,的表达量在JMS中最高,显著高于URMQ2(6.6倍),其次是QPQL2,其他4个种群的表达量较低;在YN3的表达量最高,显著上调,表达量是URMQ2的7.49倍,其次是URMQ4和YN2种群,JMS、QPQL2和URMQ3种群的表达量较低;的表达量在各种群中无显著变化(图4-B)。
2.5 噻虫嗪胁迫下马铃薯甲虫P450基因的表达分析
将2019年马铃薯甲虫相对敏感种群URMQ2的4龄幼虫和成虫经噻虫嗪LD50处理72 h,利用qRT-PCR测定其P450基因的表达变化,结果如图5所示。4龄幼虫中,以未处理同日龄的试虫为对照,处理组的表达量显著上升,分别为对照的5.08、4.25、2.38和2.79倍;而成虫处理组显著上调表达量分别为对照的1.80和1.68倍,显著下调。可以看出,经噻虫嗪LD50处理均可诱导4龄幼虫和成虫表达量显著增加,在4龄幼虫和成虫的表达变化则相反,而的表达量均无显著变化。
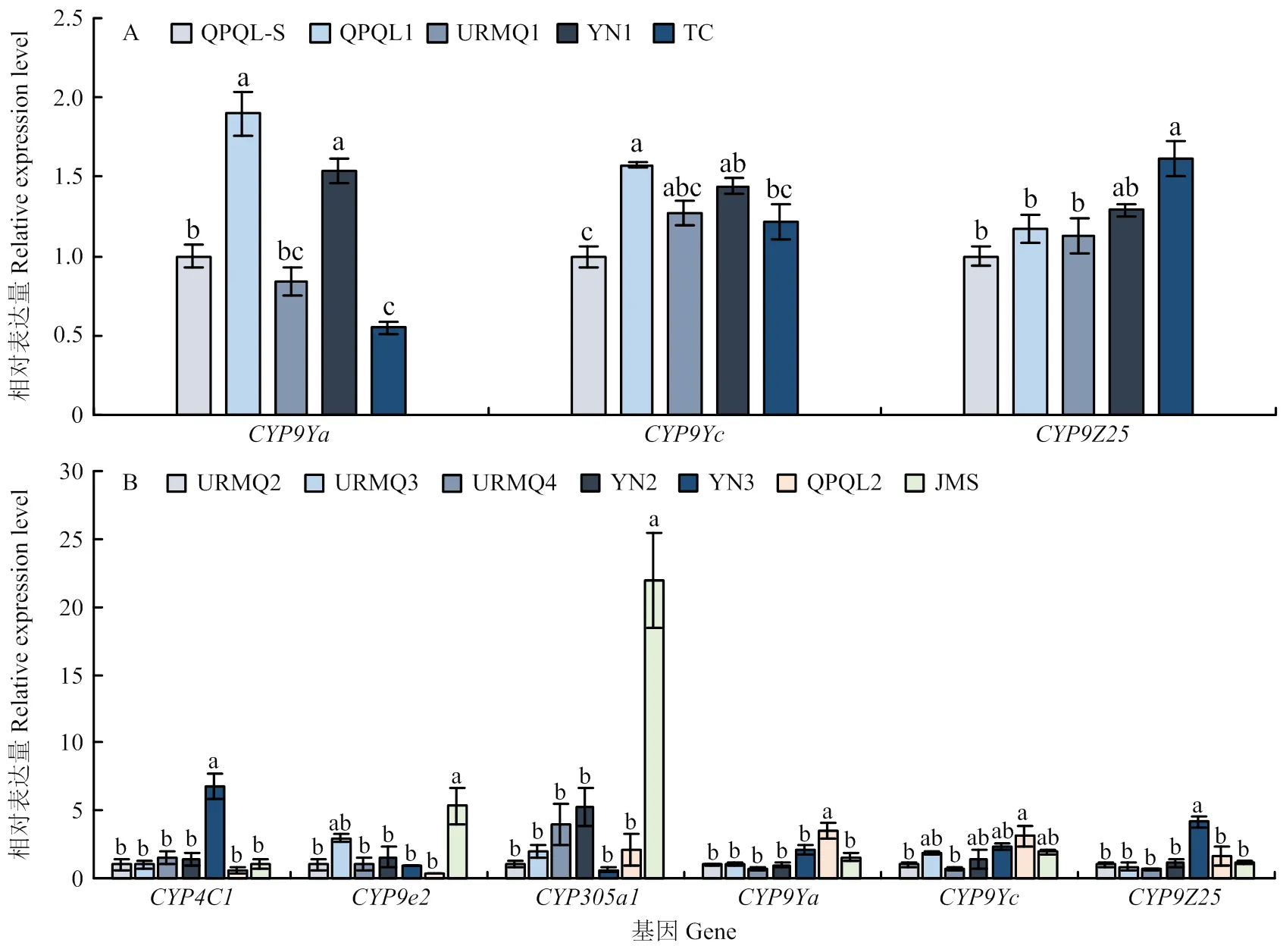
图3 马铃薯甲虫田间种群4龄幼虫P450基因的相对表达量(A:2018;B:2019)
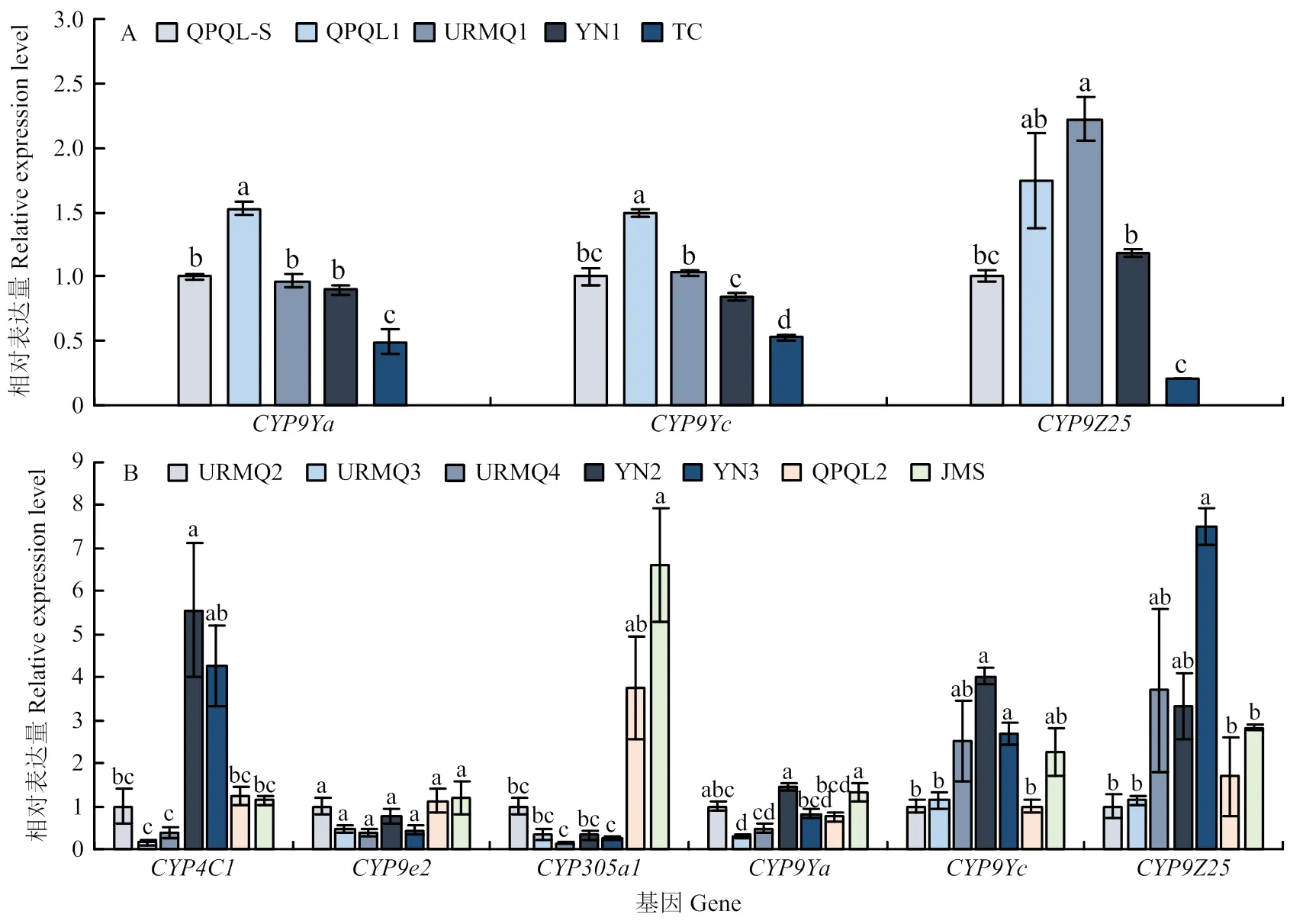
图4 马铃薯甲虫田间种群成虫P450基因的相对表达量(A:2018;B:2019)
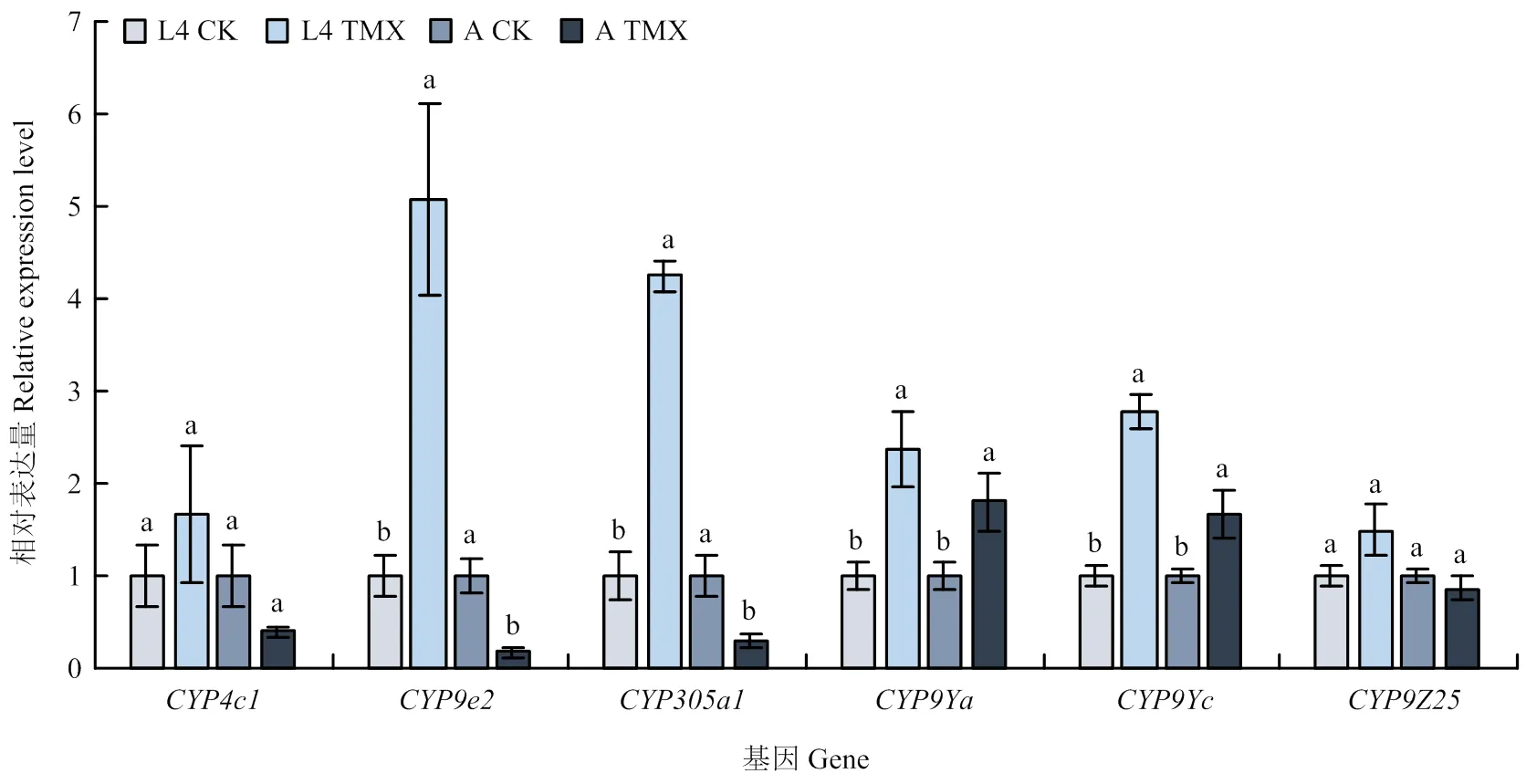
L4:4龄幼虫4th instar larva;A:成虫 Adult;TMX:噻虫嗪thiamethoxam
2.6 新疆马铃薯甲虫对噻虫嗪的抗性水平与P450基因表达量的相关性分析
利用SPSS分析2018年和2019年新疆马铃薯甲虫不同种群对噻虫嗪的抗性水平与上述P450基因表达量之间的相关性,结果如表7所示,马铃薯甲虫成虫对噻虫嗪的抗性水平与表达量之间的相关系数()为0.810(=0.027),二者之间为高度显著正相关。
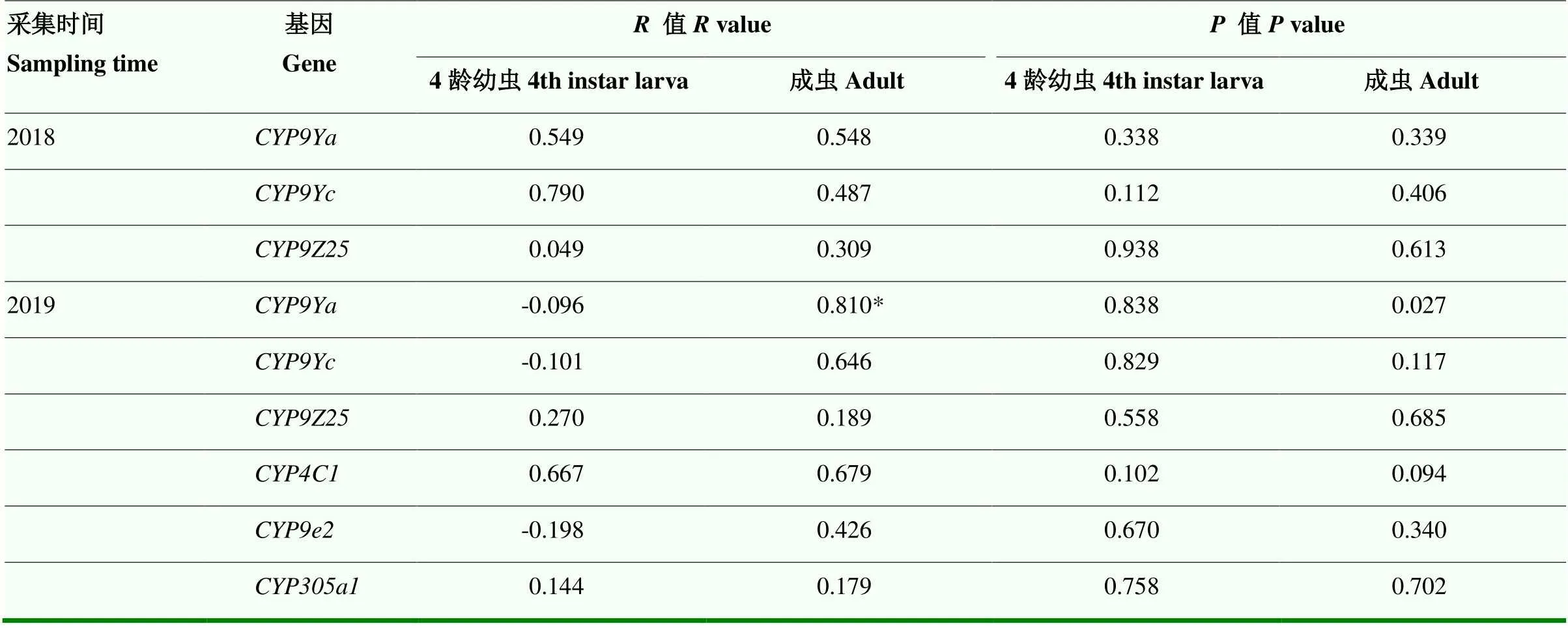
表7 新疆马铃薯甲虫对噻虫嗪的抗性水平与P450基因表达量的相关性分析
3 讨论
马铃薯甲虫对杀虫剂容易产生抗性,对于一种新的杀虫剂,往往在使用2—4年就产生明显的抗药性[2]。噻虫嗪是新疆地区防治马铃薯甲虫的主推药剂之一,随着使用周期的累积,其抗性发展不可避免。2009、2010年的调查发现新疆马铃薯甲虫4龄幼虫对噻虫嗪普遍敏感,仅2010年特克斯(TKS)种群产生8.03倍的低水平抗性[14];同时马铃薯甲虫成虫的抗性监测显示2009年昌吉(CJ)种群对噻虫嗪具有5.22倍的低水平抗性,2010年CJ、QPQL、TC和URMQ1种群对噻虫嗪发展了低到中等水平抗性(7.48、5.98、10.15和10.39倍)[9]。本研究抗性监测表明2018年YN1、URMQ1、TC和QPQL1以及2019年YN2、JMS田间种群成虫对噻虫嗪产生了5.99—20.33倍的低至中水平抗性。其中2019年YN2种群对噻虫嗪的抗性水平比2018年YN1种群增加了1倍。对上述采集地用药情况的调查发现,察布查尔、伊宁地区近3年均施用噻虫嗪、吡虫啉等药剂,吉木萨尔县近10年持续使用阿立卡(12.6%噻虫嗪·9.4%高效氯氟氰菊酯)防治马铃薯甲虫。可见长期、频繁的用药导致当地种群对新烟碱类杀虫剂的敏感性明显下降。另外,还可以发现本文的监测结果与刘萍等[9]、卢伟平等[14]的调查结果具有相似的趋势,即成虫对噻虫嗪的敏感性较低,而幼虫的敏感性较高,且随着时间发展田间最高抗性水平有所上升。虽然新疆马铃薯甲虫对噻虫嗪的抗性还处于低至中等水平,但其发展不容忽视,注意合理轮换使用不同作用机制的药剂,尽量避免在高龄期或成虫期用药,同时开展持续的抗性监测及抗性机制研究是马铃薯甲虫抗性治理的重要前提。
细胞色素P450单加氧酶是马铃薯甲虫代谢吡虫啉的主要酶系。Zhao等[6]研究发现,胡椒基丁醚在纽约州长岛马铃薯甲虫成虫和幼虫中对吡虫啉都有明显增效作用;Mota-Sanchez等[7,21]在其他种群的增效研究也获得同样的结果。在本研究中,噻虫嗪LD50处理72 h都可引起敏感和抗性马铃薯甲虫4个种群的P450活性显著升高,另外URMQ2和YN2种群的EST及URMQ3种群的GST活性也显著增加,这表明P450可能在马铃薯甲虫对噻虫嗪的解毒代谢中起主要作用。类似的研究发现褐飞虱()噻虫嗪抗性种群的细胞色素P450活性也显著高于室内敏感品系(2.13倍)[22]。
近年来随着分子生物学及生物信息学的快速发展,有关昆虫对新烟碱类杀虫剂抗性的解毒代谢分子机制也取得了一系列进展[10-13]。为了筛查新疆马铃薯甲虫对噻虫嗪抗性相关的解毒酶基因,本研究就马铃薯甲虫噻虫嗪抗性和敏感成虫进行转录组分析,结果发现与抗性相关的显著差异表达的上调解毒酶基因有P450基因2个、尿苷二磷酸-葡萄糖基转移酶基因1个、ABC转运蛋白基因3个,但未见有显著差异表达的酯酶和谷胱甘肽-转移酶基因。Clements等[23]将吡虫啉处理后的马铃薯甲虫与对照进行转录组测序,按照解毒机制进行分类,发现吡虫啉可诱导4个P450基因、1个尿苷二磷酸-葡萄糖基转移酶基因以及1个羧酸酯酶基因上调。可见不同背景的种群其解毒酶基因的表达量变化不同。本文利用qRT-PCR验证转录组数据中3个上调的P450基因和在抗性种群的表达量,结果与DEG数据基本一致,另外结合Zhu等[18]在美国长岛马铃薯甲虫吡虫啉抗性种群中发现的过表达基因和,本研究进一步对上述6个P450基因在新疆马铃薯甲虫不同田间种群的表达进行了比较分析,结果表明,4龄幼虫中,对噻虫嗪敏感性降低的QPQL1种群中、的表达量显著增加;成虫中,对噻虫嗪低水平抗性的URMQ1种群中高表达,和和以及分别在QPQL1、YN2以及JMS种群中显著上调,这些种群对噻虫嗪达到中水平抗性。综上,可以看出和在敏感性降低的幼虫和抗性成虫种群中表达量均显著提高,除以外其他5个基因在抗性成虫中都显著上调,表明这些基因可能参与了新疆马铃薯甲虫对噻虫嗪抗性的产生。
吡虫啉对昆虫P450基因表达具有诱导作用。Zhu等[18]研究显示对吡虫啉约30倍抗性的美国长岛马铃薯甲虫种群中有21个P450基因可被吡虫啉诱导上调表达;吡虫啉处理蜜蜂可引起6个P450基因的表达量增加[24];大草蛉()幼虫经吡虫啉诱导4 h其体内P450基因表达量略微上调,16 h后转录水平达最高值,随后逐渐下降[25]。本文qRT-PCR结果表明,经噻虫嗪LD50处理72 h,URMQ2种群4龄幼虫和成虫的和均显著上调表达。ZHANG等研究发现褐飞虱中13个可被吡虫啉诱导的P450基因在抗性种群中却无差异表达,而和不能被吡虫啉诱导,但在抗性种群中表达上调[26],这表明可被药剂诱导的基因与抗性相关的过表达基因并非完全一致。因此,综合本研究中诱导试验及不同田间种群P450基因的表达分析结果,在噻虫嗪抗性种群中显著上调同时又能被噻虫嗪诱导的基因即为和。另外相关性分析显示成虫对噻虫嗪的抗性与表达量呈显著正相关。而真正参与马铃薯甲虫对噻虫嗪抗性形成的基因有待进一步的功能验证。
4 结论
通过抗性监测发现2018年YN1、URMQ1、TC和QPQL1以及2019年YN2和JMS种群成虫对噻虫嗪产生了低至中水平抗性。噻虫嗪处理可引起测试种群P450活性的升高,表明其在马铃薯甲虫对噻虫嗪抗性产生中可能起到重要作用。抗性和敏感种群的转录组分析以及qRT-PCR结果显示包括和的5个P450基因在抗性种群中显著上调,同时噻虫嗪又可诱导这两个基因在4龄幼虫和成虫中的表达。结合相关性分析推测与马铃薯甲虫对噻虫嗪的抗性形成密切相关,但不排除其他P450基因以及其他解毒酶基因的作用。
[1] ALYOKHIN A. Colorado potato beetle management on potatoes: current challenges and future prospects//Fruit, vegetable and cereal science and biotechnology, 2009, 3(1): 10-19.
[2] ALYOKHIN A, BAKER M, MOTA-SANCHEZ D, DIVELY G, GRAFIUS E. Colorado potato beetle resistance to insecticides.American Journal of Potato Research, 2008, 85: 395-413.
[3] 郭文超, 吐尔逊, 许建军, 刘建, 何江, 李晶, 马德成, 王俊. 马铃薯甲虫识别及其在新疆的分布、传播和危害. 新疆农业科学, 2010, 47(5): 906-909.
GUO W C, TU E R, XU J J, LIU J, HE J, LI J, MA D C, WANG J. Research on the identification of Colorado potato beetle and its distribution, dispersal and damage in Xinjiang. Xinjiang Agricultural Sciences, 2010, 47(5): 906-909. (in Chinese)
[4] 须志平. 新烟碱类杀虫剂在作物保护方面的应用. 世界农药, 2009, 31(1): 18-21.
XU Z P. Application of neonicotinoids insecticides in crop protection. World Pesticides, 2009, 31(1): 18-21. (in Chinese)
[5] 王彦华, 王鸣华. 害虫对噻虫嗪抗药性及其治理. 世界农药, 2008, 30(4): 42-45.
WANG Y H, WANG M H. Pest resistance to thiamethoxam and its management. World Pesticides, 2008, 30(4): 42-45. (in Chinese)
[6] ZHAO J Z, BISHOP B A, GRAFIUS E J. Inheritance and synergism of resistance to imidacloprid in the Colorado potato beetle (Coleoptera: Chrysomelidae).Journal of Economic Entomology, 2000, 93(5): 1508-1514.
[7] MOTA-SANCHEZ D, HOLLINGWORTH R M, GRAFIUS E J, MOYER D D. Resistance and cross-resistance to neonicotinoid insecticides and spinosad in the Colorado potato beetle,(Say) (Coleoptera: Chrysomelidae). Pest Management Science, 2006, 62(1): 30-37.
[8] 王志田, 姜卫华, 李国清. 新疆北疆马铃薯甲虫成虫抗药性水平监测. 农药, 2010, 49(3): 206-208.
WANG Z T, JIANG W H, LI G Q. Insecticide resistance in adult of the Colorado potato beetle among north Xinjiang Uygur autonomous region. Agrochemicals, 2010, 49(3): 206-208. (in Chinese)
[9] 刘萍, 姜卫华, 卢伟平, 李国清. 新疆北疆马铃薯甲虫成虫对新烟碱类杀虫剂的敏感性变化. 农药学学报, 2011, 13(3): 271-275.
LIU P, JIANG W H, LU W P, LI G Q. Susceptibility of Colorado potato beetleadults from northern Xinjiang Uygur autonomous region to 4 neonicotinoids. ChineseJournal of Pesticide Science, 2011, 13(3): 271-275. (in Chinese)
[10] KAPLANOGLU E, CHAPMAN P, SCOTT I M, DONLY C. Overexpression of a cytochrome P450 and UDP-glycosyltransferase is associated with imidacloprid resistance in the Colorado potato beetle,. Scientific reports, 2017, 7: 1762.
[11] CLEMENTS J, SCHOVILLE S, PETERSON N, LAN Q, GROVES R L. Characterizing molecular mechanisms of imidacloprid resistance in select populations ofin the central sands region of Wisconsin. PLoS One, 2016, 11(1): e0147844.
[12] CLEMENTS J, SCHOVILLE S, PETERSON N, HUSETH A S, LAN Q, GROVES R L. RNA interference of three up-regulated transcripts associated with insecticide resistance in an imidacloprid resistant population of. Pesticide Biochemistry and Physiology, 2017, 135: 35-40.
[13] CLEMENTS J, OLSON J M, SANCHEZ-SEDILLO B, BRADFORD B, GROVES R L. Changes in emergence phenology, fatty acid composition, and xenobiotic-metabolizing enzyme expression is associated with increased insecticide resistance in the Colorado potato beetle. Archives of Insect Biochemistry and Physiology, 2020, 103(3): e21630.
[14] 卢伟平, 刘萍, 姜卫华, 李国清. 4种新烟碱类杀虫剂对马铃薯甲虫的触杀毒力比较. 农药, 2011, 50(2): 137-140.
LU W P, LIU P, JIANG W H, LI G Q. Comparison of contact toxicities of 4 neonicotinoids against. Agrochemicals, 2011, 50(2): 137-140. (in Chinese)
[15] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72: 248-254.
[16] 祝海栋, 李瑞琳, 何小雨, 赵丹, 韩鑫胤, 牛北方. 六倍体小麦基因组注释流程构建与优化. 计算机系统应用, 2019, 28(8): 222-228.
ZHU H D, LI R L, HE X Y, ZHAO D, HAN X Y, NIU B F. Construction and optimization of hexaploid wheat genome annotation process. Computer Systems and Applications, 2019, 28(8): 222-228. (in Chinese)
[17] LANGMEAD B, TRAPNELL C, POP M, Salzberg S L. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome. Genome Biology, 2009, 10(3): R25.
[18] ZHU F, MOURAL T W, Nelson D R, PALLI S R. A specialist herbivore pest adaptation to xenobiotics through up-regulation of multiple cytochrome P450s. Scientific Reports, 2016, 6: 20421.
[19] 王彦华, 陈进, 沈晋良, 高聪芬, 黄悦, 张久双, 李文红, 周威君. 防治褐飞虱的高毒农药替代药剂的室内筛选及交互抗性研究. 中国水稻科学, 2008, 22(5): 519-526.
WANG Y H, CHEN J, SHEN J L, GAO C F, HUANG Y, ZHANG J S, LI W H, ZHOU W J. Laboratory screening and cross-resistance analysis of alternative insecticides for highly-toxic pesticides for controlling brown planthopper,. Chinese Journal of Rice Science, 2008, 22(5): 519-526. (in Chinese)
[20] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[21] MOTA-SANCHEZ D, WHALON M, GRAFIUS E, HOLLINGWOETH R. Resistance of Colorado potato beetle to imidacloprid. Resistant Pest Management, 2000, 11(1): 31-34.
[22] 张钰明, 向兴, 王学贵. 噻虫嗪对褐飞虱的毒力及解毒代谢酶活性的影响. 华南农业大学学报, 2020, 41(3): 80-85.
ZHANG Y M, XIANG X, WANG X G. Effects of thiamethoxam on toxicity and detoxification metabolic enzyme activity of. Journal of South China Agricultural University, 2020, 41(3): 80-85. (in Chinese)
[23] CLEMENTS J, SANCHEZ-SEDILLO B, BRADFIELD C A, GROVES R L. Transcriptomic analysis reveals similarities in genetic activation of detoxification mechanisms resulting from imidacloprid and chlorothalonil exposure. PLoS One, 2018, 13(10): e0205881.
[24] WU M C, CHANG Y W, LU K H, YANG E C. Gene expression changes in honey bees induced by sublethal imidacloprid exposure during the larval stage. Insect Biochemistry and Molecular Biology, 2017, 88: 12-20.
[25] 刘昌燕, 曾凡荣. 大草蛉P450基因cDNA片段的克隆及吡虫啉诱导表达. 中国生物防治学报, 2014, 30(3): 427-433.
LIU C Y, ZENG F R. Cloning ofP450 cDNA fragment and the expression induced by imidacloprid. Chinese Journal of Biological Control, 2014, 30(3): 427-433. (in Chinese)
[26] ZHANG Y X, YANG Y X, SUN H H, Liu Z W. Metabolic imidacloprid resistance in the brown planthopper,, relies on multiple P450 enzymes. Insect Biochemistry and Molecular Biology, 2016, 79: 50-56.
Resistance monitoring to thiamethoxam and expression analysis of cytochrome P450 genes infrom Xinjiang
Shixin1, Li sha1, Wang Zhimin1, Fu Kaiyun2, Fu Wenjun3, Jiang Weihua1
1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095;2Research Institute of Plant Protection, Xinjiang Academy of Agricultural Sciences/Key Laboratory of Intergraded Management of Harmful Crop Vermin of China North-western Oasis, Ministry of Agriculture and Rural Affairs, Urumqi 830091;3Agricultural Technology Extension Master Station of Yili Prefecture, Yining 835000, Xinjiang
【】Colorado potato beetle (CPB),, is a significant agricultural pest in potato worldwide. The objective of the study is to identify the main cytochrome P450genes involved in metabolic regulation of neonicotinoid insecticide thiamethoxam in.【】In this study, the resistance level to thiamethoxam was assayed using topical applications in 11 field populations offrom Qapqal (QPQL), Yining (YN), Tacheng (TC), Urumqi (URMQ), Jimusar (JMS) of Xinjiang in 2018 and 2019. The activities of three detoxifying enzymes including cytochrome P450 monooxygenase (P450), glutathione-transferase (GST) and esterase (EST), exposed to LD50of thiamethoxam for 72 h were analyzed byenzyme activity assay. Thedifferentially expressed genes (DEGs) ofadults susceptible and resistant to thiamethoxam were detected by Illumina HiSeqTM2500 sequencing platform. The expression verification of three P450 genes and the expression change of six P450 genes in different populations and the beetles exposed to LD50of thiamethoxam for 72 h were performed by real-time quantitative PCR (qRT-PCR).【】Resistance monitoring results showed that the adults of YN1, URMQ1, TC and QPQL1 populations in 2018 and YN2 and JMS in 2019 developed low to moderate level resistance to thiamethoxam with resistance ratio (RR) ranging from 5.99 to 20.33 times. The P450 activities of adults from two sensitive populations URMQ2 and URMQ3 and two resistant populations YN2 and JMS after treatment with thiamethoxam LD50for 72 h were significantly increased to 1.76, 2.75, 1.91 and 1.66 times as high as the control, respectively. In addition, the GST (CDNB and DCNB as substrates) of URMQ3 population and the EST activities of URMQ2 and YN2 populations were obviously increased to 1.19, 2.10 and 1.35, 1.91 times of the control, respectively. Based on Illumina RNA sequencing, the raw reads (56 872 051 and 62 249 136), clean reads (55 903 706 and 61 082 076), clean bases (8.39 and 9.16 G) and error of basic group (0.03%) were obtained for the thiamethoxam-susceptible and -resistant samples of adult populations, respectively. Thirteen differentially expressed P450 genes were identified in the thiamethoxam-resistant sample, of which two genes were significantly up-regulated. The expression levels of three P450 genes, namely,andby RNA sequencing were validated by qRT-PCR analysis. Furthermore,,,,andwere up-regulated in the thiamethoxam-resistant adults, and the expression of,increased significantly in the 4th instar larvae and adults under thiamethoxam treatment. It was found by correlation analysis that there was a significant positive correlation between resistance level to thiamethoxam andexpression of adults. 【】may be involved in the production of thiamethoxam resistance in, and the role of other genes cannot be ruled out.
; thiamethoxam; resistance; cytochrome P450; gene expression

10.3864/j.issn.0578-1752.2021.14.007
2020-10-30;
2020-11-21
国家重点研发计划(2018YFD0200802)
石鑫,E-mail:907094441@qq.com。通信作者姜卫华,E-mail:jwh@njau.edu.cn
(责任编辑 岳梅)
