早期局限性肾癌患者肾周脂肪粘连的预测因素
2021-07-30李庆辉刘洪志戚聂聂李海龙温儒民
李庆辉,刘洪志,戚聂聂,陈 跃,李海龙,温儒民
(1.徐州医科大学研究生学院,江苏徐州 221000;2.徐州医科大学附属医院泌尿外科,江苏徐州 221000)
对于早期局限性肾癌是否实施肾部分切除术(partial nephrectomy,PN)很大程度上取决于肿瘤肿块及其周围解剖的复杂性。为了客观地评估肾脏肿块的复杂性,目前国内外常用RENAL评分、PADUA评分以及向心性指数预测手术难度和并发症。因此,这些评分对术前预测评估有重要意义,有助于开放和微创手术之间选择时的治疗决策。患者特有的解剖结构可以分别影响PN中的外科解剖和肿瘤暴露。在实施PN时,Gerota筋膜下的肾周脂肪粘连(adherent perinephric fat,APF)时有发生。越来越多的证据表明,APF干扰PN期间肾脏肿块的分离,并可能增加肿瘤侵犯的风险以及手术时间和中转率。因此,准确预测APF可以改善术前风险评估。虽然APF的潜在发病机制尚不清楚,但研究表明炎症和心血管危险因素可能是其发生的原因。本研究目的是评估早期局限性肾癌患者在腹腔镜下肾部分切除术(laparoscopic partial nephrectomy,LPN)中APF的相关预测因素。
1 对象与方法
1.1 研究对象选取2018年1月至2020年5月徐州医科大学附属医院泌尿外科收治的早期局限性肾癌患者132例作为研究对象。依据术中腔镜观察、肾周脂肪剥离情况以及观看手术录像,由经验丰富的泌尿外科医师判断是否存在APF,即肾脏周围存在厚度大、粘连的脂肪组织。将APF患者34例作为APF组,无脂肪粘连患者98例作为无APF组。纳入标准:①所有患者均为T1aN0M0原发性肾脏肿瘤;②术前完善胸部计算机断层扫描(computed tomography,CT)、肾脏血管造影(CT angiography,CTA)、肾小球滤过率(glomerular filtration rate,GFR)等检查了解肿瘤位置、大小及肾功能;③由同一组手术经验丰富的泌尿外科主任医师完成LPN;④可以获得完整的临床病理资料。排除标准:①T1b期及以上肾脏肿瘤;②局部或远处转移、伴有肾静脉血栓、多发肿瘤以及位置深在居于肾中央的肿瘤;③合并其他恶性肿瘤、合并严重肝肾功能不全、严重心脑血管疾病、不能纠正的出血性疾病等。收集并比较两组患者的性别、年龄、体质指数(body mass index,BMI)、肿瘤位置及最大直径、术前血清肌酐、合并症(包括高血压、糖尿病、高脂血症)、MAP评分、C反应蛋白、肾周脂肪密度等资料。本研究符合《赫尔辛基宣言》,且获得患者的知情同意。
1.2 APF的定义和评估APF被定义为需要剥离肾包膜以暴露肾实质的肾周脂肪,或由于切除肾周脂肪困难而残留在肾实质表面的脂肪[1-2]。正常情况下,在腰大肌前方与腰大肌平行切开Gerota筋膜,切开后即可见到肾周脂肪,轻微钝性分离即可暴露肾脏边缘。但在APF的情况下,钝性分离效果不佳,需要借助超声刀等能量设备谨慎分离。
1.3 手术方法全身麻醉起效后,取折刀卧位,患侧术野消毒铺巾。取腋后线十二肋下2 cm处做1.2 cm皮肤切口,依层切开皮肤,血管钳沿腰大肌外侧缘钝性分离肌肉到达筋膜外。用一次性腹膜后扩张器扩张腹膜后形成人工腔隙,腋后线处置入12 mm Trocar持续注入CO2气体并维持15 mmHg(1 mmHg=0.133 kPa)压力,直视下于12肋腋前线切开10 mm,髂嵴上方2 cm处切开10 mm,髂嵴上缘处切开5 mm,分别穿刺置入10、10、5 mm Trocar,置入手术操作器械,探查未见损伤。切除腹膜外脂肪,暴露患肾,沿腰大肌表面向内分离至肾门,游离出肾动脉。并将肿瘤与周围组织完全游离。再次显露肾动脉[依据术前计算机断层血管造影(computed tomography angiography,CTA)和腔镜所见判断有无副肾动脉]并用动脉阻断夹阻断,沿肿瘤与肾脏交界处用剪刀锐性切除肿瘤,保证肿瘤面完整,将肿瘤完全切除,暴露出肾脏创面,3-0倒刺线连续缝合创面内层,接着用2-0倒刺线连续缝合创面全层。开放动脉阻断夹,注射用水及生物护创冲洗创面,见创面无渗血后,喷洒止血微球及覆盖止血纱布,3-0可吸收线连续缝合脂肪囊,置入取物袋将肿瘤装入,自腋后线切口将肿瘤取出,清点器械辅料无误后,留置腹膜后引流管,逐层关闭切口。患者安全返回病房后密切关注患者术后生命体征变化、肾周引流量及引流液的颜色变化,绝对卧床。予以补液抗炎、预防感染等对症治疗,术后复查患者血常规、肾功能及电解质。
1.4 梅奥粘连概率(Mayo adhesive probability,MAP)评分2014年Mayo研究所的DAVIDIUK等[3]提出了基于影像学特征预测APF的MAP评分系统。通过对肾脏后侧脂肪厚度及肾周脂肪在影像学上的条索状改变这2个参数求和来计算MAP分数。在肾静脉水平面上,当肾脏后侧脂肪厚度处于<1.0、1.0~1.9、≥2.0 cm时分别赋予0、1、2分;肾周脂肪的条索状改变可以分为无条索改变(0分)、中度条索影(2分)、重度条索影(3分)3级。总分为0~5分,分数越高代表出现粘连脂肪的概率越高,在临床上分为MAP低度组(0~1分)、中度组(2~3分)、高度组(4~5分)。DAVIDIUK等[3]将中度条索影定为细边状温和影,重度为粗大、弥漫、杂乱的条索状改变;将肾脏后侧脂肪厚度定义为在肾静脉水平,肾被膜至腹壁之间的长度。
1.4 肾周脂肪密度在患者肾静脉水平的中腹部CT中,测量3次肾周脂肪密度CT表达值,取平均值作为最终肾周脂肪平均密度值。影像采集工作由专业影像科医师完成,确定肾静脉平面及肾周脂肪范围并通过影像学数据软件进行采集。
2 结 果
2.1 两组患者的临床资料比较APF组中男性患者22例,女性12例,平均年龄(58.59±9.99)岁;非APF组中男性患者42例,女性56例,平均年龄(54.81±8.52)岁。APF发生率为25.76%,两组患者的年龄、性别、BMI、高血压病史、糖尿病病史、高脂血症、MAP评分及肾周脂肪密度比较,差异均有统计学意义(P<0.05,表1)。
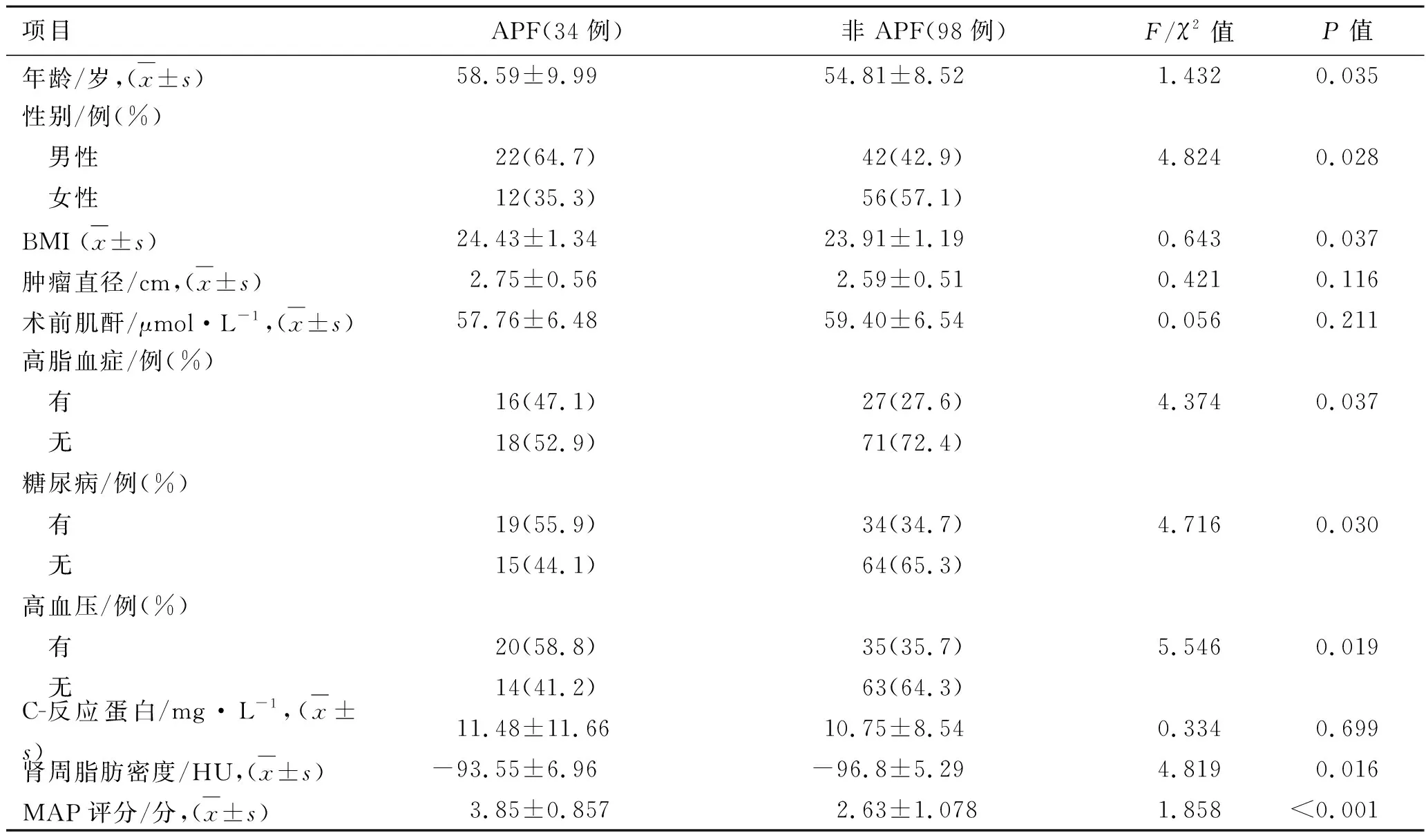
表1 两组患者的临床资料比较
2.2 APF患者的Logistic分析单因素结果显示,其中高龄、男性、高BMI、基础病史、高MAP评分、高脂肪密度为APF的预测因素。在多因素Logistic回归分析显示,MAP评分是APF的独立预测因子,差异具有统计学意义(OR=2.717,P<0.05,表2)。
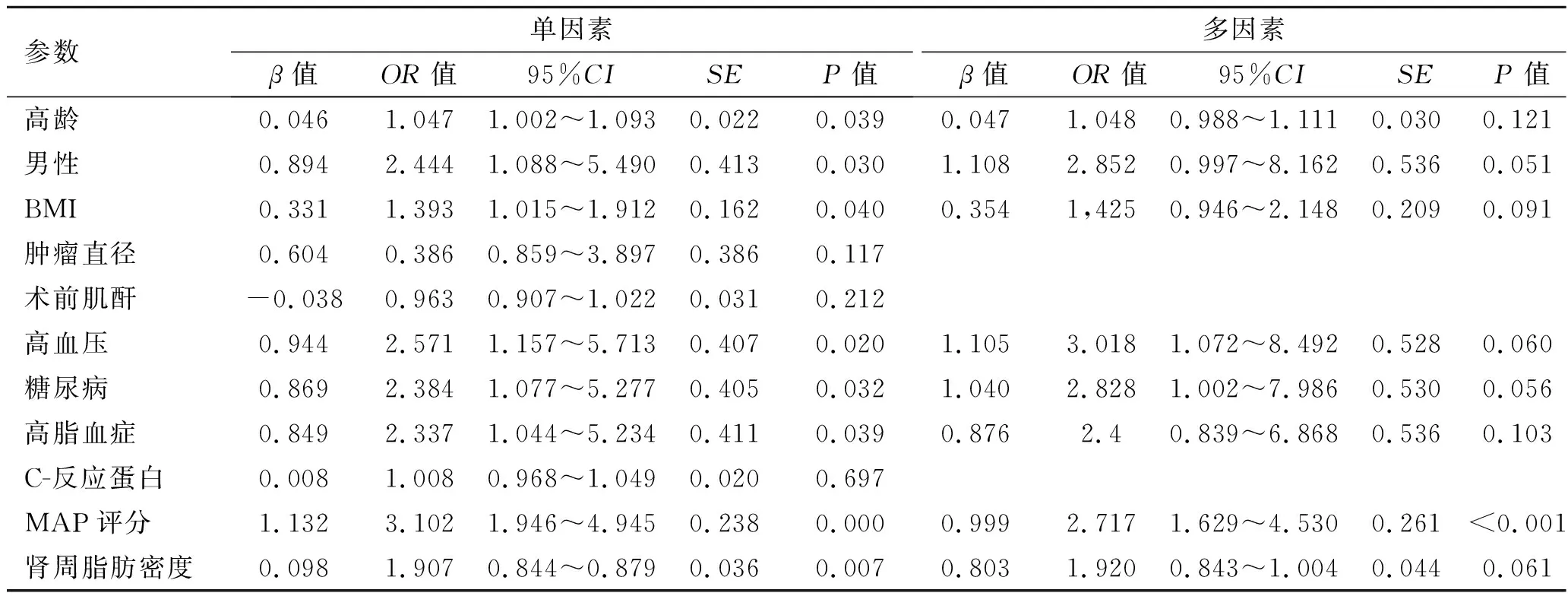
表2 132例早期局限性肾癌患者的APF单因素与多因素Logistic分析
3 讨 论
肾细胞癌是起源于肾实质泌尿小管上皮系统的恶性肿瘤,简称肾癌,占成人恶性肿瘤的2%~3%,男女比例为2∶1。早期肾癌患者往往缺乏临床表现,超过一半患者在体检或做其他系统疾病检查时被发现[4]。对于早期局限性肾癌,手术切除一直为首选治疗方案。对于T1期肾癌患者应尽量采取保留肾单位的手术方式。在技术可行的情况下,肾部分切除术越来越多地适用于小型肾肿块的治疗。泌尿外科医生过去常常根据肿瘤的解剖因素(如大小、位置),对手术复杂性进行分类评分[5-7]。然而,除了肿瘤解剖因素外,还应考虑肿瘤周围环境的影响因素。手术困难的潜在的非肿瘤相关危险因素是肾脏周围存在厚度大、粘连的脂肪组织,即APF,其发病机制尚未明确,全身慢性炎症状态可能是潜在的机制。DARIANE等[8]研究了PN期间肾周脂肪的一些病理特征,结果显示,在APF组和非APF组中都没有观察到明显的巨噬细胞浸润,两组间脂肪细胞纤维化无差异。然而,在APF组,脂肪细胞的直径更大,血管的存在也更多。宏观上,APF存在时,即使肿瘤很小,并且是外生性生长的,泌尿外科医生在LPN中分离肾脏并暴露肿瘤时常会感到困扰。相关大数据的前瞻性研究报道,APF的发生率为40.8%[8]。APF的存在可能成为分离肾脏肿瘤和阻断肾门的障碍,并且去除粘连的肾周脂肪通常会导致肾被膜的撕裂。KHENE等[1]的研究结果显示,在接受机器人辅助肾部分切除术的患者中,APF的存在导致手术时间、出血量和中转率显著增加,并导致更多的输血治疗。因此,在LPN前预测APF的存在对于术前规划以及医患沟通显得格外重要。
本研究的单因素分析结果显示BMI、性别、年龄、合并高血压、糖尿病病史、高脂血症、MAP 评分与 APF相关。将以上因素进行多因素分析则显示与APF相关的只有MAP评分。在单因素分析中BMI(OR=1.393,P=0.04)与 APF 密切相关,而在多因素分析中(OR=1.425,P=0.091)却无相关性。BMI是临床上常用的衡量人体肥胖程度的重要标准,虽然BMI数值与肥胖程度成正比,但无法区别腹腔内脏脂肪与皮下脂肪,也不能区分脂肪重量和肌肉重量,它对肥胖只能做出模糊的判断,更不能以此判断患者是否存在APF,并且一些国外研究并没有发现BMI与LPN难度有联系。一些与肥胖相关的并发症,如糖尿病、高血脂和高血压,也仅在单因素分析中具有预测作用。
多项研究表明,老年和男性都是APF的危险因素[8-9]。与代谢反应相似,老年人处于一种炎症老化的渐进性促炎状态[10]。年龄也有助于脂肪组织的重新分布,从皮下脂肪组织到内脏脂肪组织[11]。这将导致APF在老年患者中的有较高的患病率。而且男性和女性脂肪的分布也不同,内脏肥胖更多见于男性。HAGIWARA等[12]报告称,男性的内脏脂肪组织为女性的2倍。因此,本文研究的高龄和男性通过增加肾周脂肪的数量(厚度)和质量(黏性)成为APF的危险因素是合理的。但是本次研究的多因素分析中,性别(OR=2.852,P=0.051)、年龄(OR=1.048,P=0.121)与APF无相关性,可能与研究收集的阳性样本量过少或者系统误差有关。
C-反应蛋白是一种急性反应期蛋白,作为一种具有代表性的评价非特异性炎症反应的敏感指标,可以敏感地提示炎症反应的程度,不少文献也阐明C-反应蛋白是肾癌预后的独立因素,反映肿瘤的进展[13-15]。但是炎症与肿瘤之间的机制仍未得到明确阐明。本次多因素分析中C-反应蛋白与APF并无相关性,未来研究中仍需要大数据进一步探索APF与炎性标记物关系。
DARIANE等[8]发现APF组CT测量平均值更高。李霖等[15]研究发现高密度的肾周脂肪患者LPN手术时间更长,出血量也更多。本研究的肾周脂肪密度是在肾静脉的水平测量3次取平均值,并且在多因素分析中与APF并无相关性。影像学上肾周脂肪的密度不均,测量误差大,因此,相关文献报道肾周脂肪密度作为预测因素的结果并不相同。ZHENG等[16]提出了肾周脂肪表面密度(perinephric fat surface density,PnFSD)的概念,先计算阈值为-190~-30的像素总数,然后总像素值除以-190~-30的像素所覆盖的面积百分比,PnFSD仍然是肾周脂肪剥离难度的独立预测因子。因此,术前CT测量的肾周脂肪密度也是有参考价值的。我们发现无论是单因素分析还是多因素分析,MAP评分都是预测APF最强的因素(OR=2.717,P<0.051)。术前CT断层上的肾周脂肪显像是预测APF存在的最重要的因素之一。肾周后脂肪厚度已被证明与APF的存在显著相关,因此,为了准确预测APF,将肾周后脂肪厚度作为MAP评分的计分项目是有价值的。KOCHER等[9]也证实MAP评分是最能准确预测APF的因素。该评分系统预测性能已在小样本研究中得到验证,对我国APF患者需行进一步临床和前瞻性研究证实。本次研究仍有不足之处,本文为回顾性研究,样本数量有限,会出现一些偏畸,研究对象主要为T1N0M0患者,其他肿瘤分期APF的影响仍需进一步研究。患者APF的分组主要靠泌尿外科医师结合术前CTA和术中观察作出主观判断,尚没有统一的客观标准。
本次研究的单因素分析结果显示,高BMI、男性、高龄、合并高血压、糖尿病、高脂血症、高MAP评分均是APF的危险因素,而多因素分析显示高的MAP评分是早期局限性肾癌患者APF的独立危险因素。因此在对患者进行治疗的过程中不仅要注意肿瘤大小、解剖位置、是否转移,也应及时评估肾周脂肪的粘连情况,制定合理的术前计划并提高手术治疗效果。
总而言之,本研究发现MAP评分是一个能准确预测APF的评分系统。我们相信MAP评分在泌尿科医生关于肾肿瘤治疗的决策上具有重要作用。
