氮素和红蓝复合光配比对苋菜幼苗亚硝酸还原酶活性及其基因表达的影响
2021-07-29赵春丽郑友峰刘生财
陈 何 王 乐 赵春丽 肖 昉 郑友峰 刘生财
(福建农林大学 园艺植物生物工程研究所,福州 350002)
苋菜(AmaranthustricolorL.)是石竹目苋科苋属下的一年生草本植物,茎叶茂盛,在我国南北各地均有栽培,是夏季的主要蔬菜之一,苋菜不论茎叶还是种子均具有营养价值和药用价值[1]。为了保证苋菜周年生产,可以利用光源植物工厂进行生产。而营养元素和光照是植物工厂最重要的2个调控因素[2]。氮素是植物生长发育所必须的基本营养元素之一,在植物生长发育中发挥着重要作用,直接影响蔬菜的产量和品质。硝态氮(NO3-)和铵态氮(NH4+)是植物吸收和利用的2种主要的无机氮素形态,影响植物的氮素同化过程,调控植物生长[3-4]。亚硝酸还原酶(nitrite reductase,NiR)是氮素同化途径的关键控制酶[5]。与硝酸还原酶(nitrate reductase,NR)相比较,有关NiR的研究较少。Lahners等[6]首先提出了玉米NiR分子结构。随后在菠菜、水稻、烟草、拟南芥、白菜和小麦等高等植物中均克隆出NiR基因[7-11]。此外,光质对植物氮代谢关键酶表达调控也有着十分重要的作用,在对水稻、番茄、黄瓜和烟草等作物的研究中发现[12-15],蓝光处理可提高植株NiR基因的相对表达量,有效改善氮代谢,进而促进其总氮升高;而红光有利于提高植株碳水化合物含量,能够促进植株茎粗和干鲜重[13]。近年来的研究发现红蓝组合光能够显著提高植物氮代谢相关酶活性和植株体内游离氨基酸含量[16];增加红蓝复合光中蓝光比例可增强苦瓜幼苗和桑树幼苗叶片氮代谢[17-18]。
但是目前对于不同红蓝复合光配比对氮代谢的影响更多集中于硝酸还原酶(NR)、谷氨酰胺合成酶(glutamine synthetase,GS)及谷氨酸合成酶(glutamate synthase,GOGAT)这3种酶活性而对NiR酶活性的研究很少,在转录水平上研究也多集中于NR和NiR基因,本研究则从NR、NiR、NRT和AMT4个基因来分析不同配比红蓝复合光对苋菜氮代谢的影响。以苋菜幼苗为材料,克隆了氮代谢关键基因AtrNiR基因,测定了不同氮素形态配比处理后NiR酶的活性,以及转录水平下AtrNiR基因的表达变化,以此来确定最佳氮素形态配比;在最佳氮配比条件下,再进行红蓝复合光配比筛选,为最适宜苋菜植物工厂的光环境参数[19]设计提供依据,为将来进一步研究苋菜AtrNiR基因功能奠定基础,同时改善因过量施肥所导致的硝酸盐和亚硝酸盐积累的污染[20]。
1 材料与方法
1.1 材料
本研究以‘大红’苋菜为材料,试验材料由福建农林大学园艺植物生物工程研究所提供。
1.2 方法
1.2.1材料处理
将‘大红’苋菜种子均匀地播种于铺有2层滤纸的塑料培养皿上(每个培养皿约80粒),然后将培养皿随机分为6组,每组3盘,每个培养皿加入5 mL的蒸馏水,放入光照培养室(25 ℃,白光,光照时间12 h/d)培养7 d,期间每个培养皿补充200 μL的蒸馏水,保证滤纸的湿润。
然后向5个处理N1~N5(表1)的每个培养皿中加入5 mL N溶液,以添加蒸馏水为对照(CK)。之后将材料继续放入光照培养室培养,将每3个培养皿材料作为一次重复用于取样,分别在培养3和6 d时,取样品的胚轴和子叶,用液氮冻存并保存于-80 ℃冰箱用于NiR酶活性测定、苋菜总RNA提取及qRT-PCR分析。为后续试验确实最佳氮配比。每种处理设置3次重复。
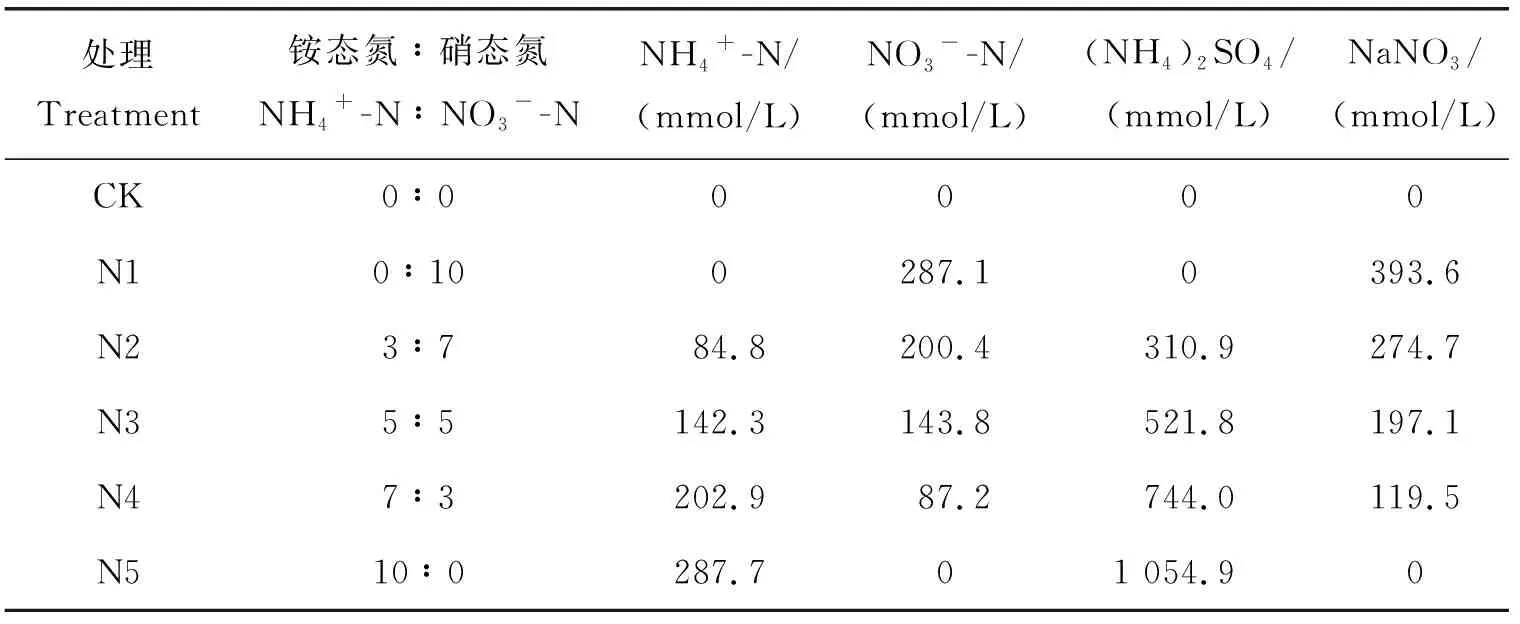
表1 不同处理下N溶液的铵硝摩尔配比Table 1 Ammonium and nitrate molar ratio of N solution under different treatment
同样,按照上述方法获得7 d苋菜幼苗后,向每组培养皿加入5 mL N3(最佳氮配比)溶液,随即将材料分别放入不同红蓝复合光下培养,培养条件设置R∶B(即Red∶Blue)=0∶10(116 μmol/(m2·s))、R∶B=2∶8(108 μmol/(m2·s))、R∶B=4∶6(148 μmol/(m2·s))、R∶B=6∶4(159 μmol/(m2·s))、R∶B=8∶2(171 μmol/(m2·s))、R∶B=10∶0(201 μmol/(m2·s))下培养,光照时间12 h/d。将每3个培养皿材料作为1次重复,在培养3 d取样品的胚轴和子叶,用液氮冻存并保存于-80 ℃冰箱用于NiR酶活性测定及qRT-PCR分析。每种处理设置3次重复。
1.2.2苋菜总RNA提取及cDNA合成
利用购买于北京百泰克生物技术有限公司的多糖多酚RNA提取试剂盒,提取苋菜材料总RNA,提取后利用1%琼脂糖凝胶电泳检测其完整性,之后利用实验室的超微量分光光度计(Thermo Electron Corp,USA)检测提取出的苋菜RNA样品浓度,再利用Gene RacerTM试剂盒(TaKaRa)将提取出的苋菜材料总RNA反转录为cDNA,用反转录出的cDNA进行NiR基因克隆。
1.2.3苋菜AtrNiR基因的克隆
根据苋菜转录组数据库(SRA:SSR924089-SSR924092),查找数据库中NiR基因序列片段,查找出后将其与NBCI中登录的NiR基因进行序列比对,找出具有完整ORF序列片段,利用DNAMAN软件设计苋菜NiR基因的ORF克隆引物(表2)。参照TaKaRa LA Taq说明书进行PCR扩增,扩增后首先用琼脂糖凝胶电泳分析扩增产物长度及完整性,随即将长度正确且完整的目的片段切胶回收,之后通过TA克隆,挑取生成的阳性克隆进行摇菌,菌液浑浊后进行菌液PCR扩增,用1%的琼脂糖凝胶电泳检测后将菌液中有目的条带的样品送到北京六合华大基因科技有限公司进行测序。

表2 引物序列Table 2 Primer sequence
1.2.4生物信息学分析
使用ExPASy-Prot-param(https:∥web.expasy.org/protparam)、Plant-mPLoc (https:∥www.csbio.sjtu.edu.cn/bioinf/plant-multi)、NCBI-CDS(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、ExPASy-PROSITE数据库(https:∥prosite.expasy.org)、NetPhos 3.1(https:∥www.cbs.dtu.dk/services/NetPhos)、PSIPRED(http:∥bioinf.cs.ucl.ac.uk/psipred)及SWISS-MODEL(https:∥swissmodel.expasy.org/interactive)等在线软件预测编码蛋白的理化性质亚细胞定位、蛋白结构域、蛋白功能位点、蛋白质磷酸化位点、蛋白二级结构以及蛋白三级结构。使用DNAMAN软件进行苋菜NiR引物设计、序列拼接及比对,使用MEGA-X软件Neighbor-Joining法参数都设为默认值,构建NiR蛋白系统进化树。
1.2.5NiR酶活性测定
按照苏州科铭生物技术有限公司的NiR酶试剂盒说明书,测定上述苋菜材料中酶的活性并进行计算。
1.2.6qRT-PCR分析
在克隆出苋菜AtrNiR基因ORF基础上设计相对定量表达特异引物,并根据苋菜转录组数据库(SRA:SSR924089-SSR924092)设计植物氮代谢途径中的关键基因AtrNR(nitrate reductase)、AtrAMT(ammonium transporter)和AtrNRT(nitrogen transporter)相对定量表达特异引物(表2)。通过qRT-PCR检测不同处理下AtrNiR、AtrNR、AtrNRT和ArtAMT基因在上述材料中的表达情况。参照SYBR Premix ExTaqTM试剂盒(TaKaRa),qRT-PCR反应体系为20 μL,每个样品设置3次生物学重复,利用罗氏LightCycler 480仪器分别扩增4个基因及内标基因EF1a,利用2-ΔΔCt法分别计算4个基因的相对表达量。
1.2.7数据分析
使用Excel 2010统计数据,使用SPSS 22.0分析数据差异显著性,使用Origin 2017绘制柱形图。
2 结果与分析
2.1 苋菜AtrNiR cDNA序列的克隆
以上述苋菜材料提取出的cDNA作为模板,通过苋菜转录组数据库信息筛选苋菜NiR基因cDNA片段来设计引物,进行PCR扩增验证ORF(图1)。最终获得苋菜NiR基因的ORF序列,命名为AtrNiR(GenBank登录号:MT374155)。苋菜AtrNiR基因ORF全长为1 785 bp,编码594个氨基酸。
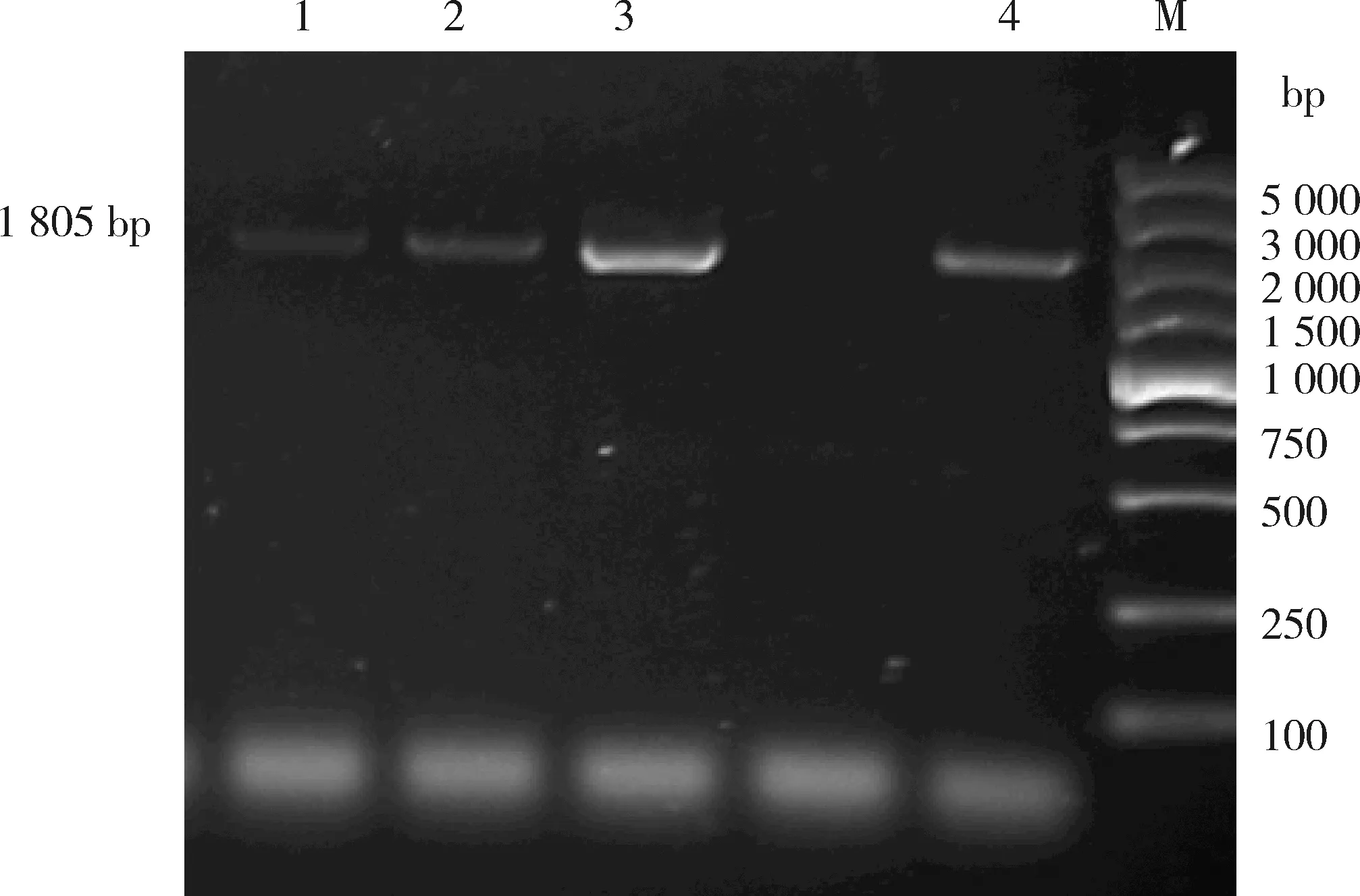
M,DNA标准DL.5 000;1~4,AtrNiR基因的扩增产物。M, DL.5 000 DNA Marker; 1-4, products of AtrNiR gene.图1 苋菜AtrNiR基因的PCR扩增Fig.1 PCR amplification of AtrNiR gene
2.2 苋菜AtrNiR基因生物信息学分析
使用在线软件ProtParam预测苋菜AtrNiR基因编码蛋白质理化性质,发现AtrNiR蛋白分子式为C2937H4692N828O873S28,相对分子质量为66.47 ku,理论等电点为6.00,总原子数为9 358,总平均疏水指数为-0.316,可以得知AtrNiR是亲水性蛋白。使用NCBI-CDS及PROSITE预测蛋白结构域及功能位点,发现该蛋白含有1个保守结构域,即PLN02431 superfamily(图2),也就是ferredoxin-nitrite reductase,功能位点位于序列的中后位置。使用PSORT预测亚细胞定位,发现该蛋白65.2%可能性位于线粒体(mitochondrial),21.7%可能性位于细胞核(nuclear)以及13.0%可能性位于细胞质(cytoplasmic)。使用在线软件PSIPRED预测AtrNiR蛋白二级结构,发现该蛋白二级结构是以无规则卷曲和α-螺旋为主,分别占43.03%和36.81%。利用SWISS-MODEL预测蛋白三级结构,发现该模型是以菠菜NiR作为结构基础建模,两者序列一致性达91.68%(图3)。通过MEGA-X将苋菜AtrNiR蛋白与NCBI中登录的20种植物的NiR蛋白作进化树分析发现,20种NiR蛋白分为5个分支,苋菜AtrNiR与拟南芥、菠菜、甜菜及藜麦的NiR 蛋白聚为1个分支(图4)。

图2 苋菜AtrNiR蛋白氨基酸序列保守结构域检索Fig.2 Conservative domain search of amino acid sequence of AtrNiR
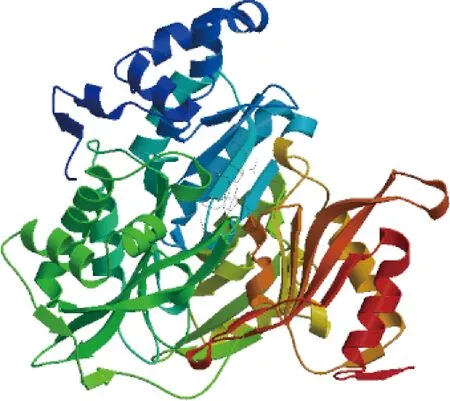
图3 预测的苋菜AtrNiR三维结构Fig.3 Predicted three-dimensional structure of amaranth AtrNiR

分支上的数值表示1 000次重复抽样符合聚类的百分数。The number on the branch represents the percentage of 1 000 repeated samples in accordance with the clustering.图4 AtrNiR蛋白系统进化树Fig.4 Phylogenetic tree for AtrNiR protein
2.3 不同处理对苋菜幼苗中NiR酶活性的影响
不同铵硝配比N溶液处理3 d后,苋菜幼苗NiR酶活性最高的是N5溶液处理,与对照组相比有显著差异,最低的是N2溶液处理,与CK有极显著差异,但是N2,N3和N4处理之间NiR酶活性没有显著差异(图5(a))。不同铵硝配比N溶液处理6 d后,苋菜幼苗NiR酶活性最高的是N2溶液处理,除N1溶液处理,其它N溶液处理的苋菜幼苗NiR酶活性含量高与对照组相比显示出极显著差异,此时苋菜幼苗NiR酶活性含量随着NH4+-N配比的增加呈现先上升后下降趋势(图5(b))。当相同铵硝配比(N3溶液)不同红蓝复合光配比下处理3 d,苋菜幼苗NiR酶活性含量最高的处理是R∶B=2∶8,以全蓝光为对照,不同红蓝光配比处理下的苋菜幼苗NiR酶含量都与对照有着极显著差异,但是除对照外,不同红蓝光配比处理间苋菜幼苗NiR酶活含量差异不明显(图5(c)),可能是因为处理3 d时间过短。
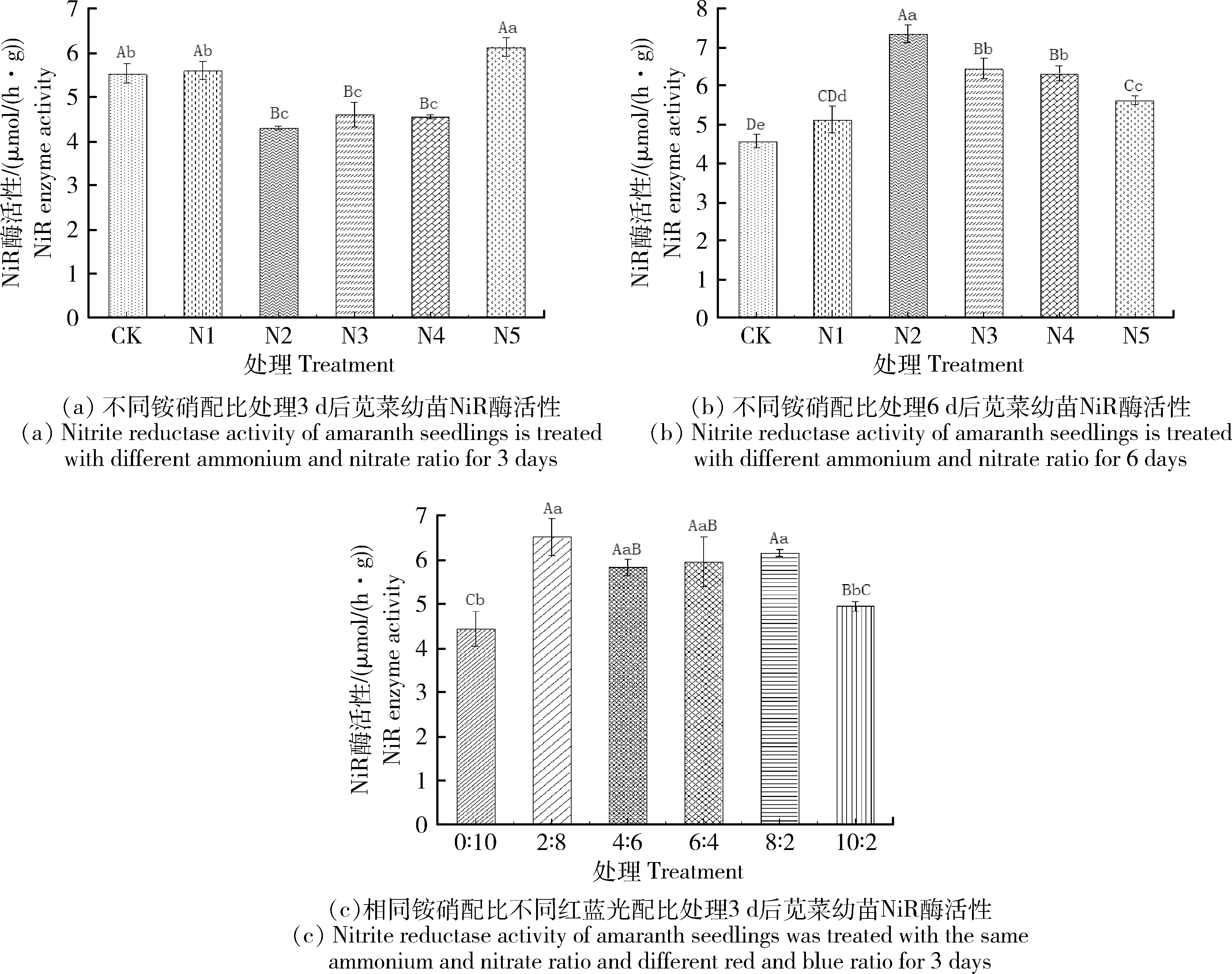
CK~N5表示不同铵硝摩尔配比(0∶0、0∶10、3∶7、5∶5、7∶3、10∶0)。不同大写字母表示0.01水平差异极显著,不同小写字母表示0.05水平差异显著。下同。CK-N5 represents different ammonium and nitrate molar ratio (0∶0, 0∶10, 3∶7, 5∶5, 7∶3, 10∶0). Different uppercase letters indicate extremely significant difference at 0.01 level, and different lowercase letters indicate significant difference at 0.05 level. The same below.图5 不同处理下苋菜幼苗中NiR酶活性Fig.5 Nitrite reductase activity of amaranth seedlings under different treatments
2.4 不同处理对AtrNiR、AtrNR、AtrNRT和AtrAMT基因在苋菜幼苗表达量的影响
当苋菜幼苗在不同铵硝配比的N溶液处理3 d后,AtrNiR和AtrNR表达量最大的都是N3溶液处理,表达量最低的都是N5溶液处理(图6(a)和(b)),说明N3溶液处理对苋菜幼苗氮代谢有最大促进作用,以此确定了N3是后续研究不同红蓝光配比处理的最佳氮配比条件。经过不同铵硝配比N溶液处理后,AtrAMT基因表达量与CK相比均呈现极显著下降(图6(c));而AtrNRT基因在N1处理下相对表达量最高,与CK相比有极显著差异,随着N溶液中NH4+-N配比的增加,AtrNRT基因表达量呈现先上升后下降的趋势,其中N4和N5溶液处理下AtrNRT基因表达量的差异不显著(图6(d))。
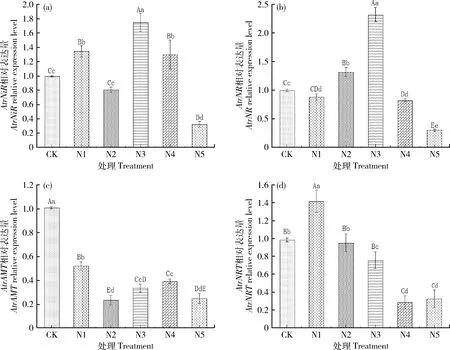
图6 不同铵硝配比处理3 d后AtrNiR(a)、AtrNR(b)、AtrAMT(c)和AtrNRT(d)基因的相对表达量Fig.6 Relative expression of AtrNiR (a), AtrNR (b), AtrAMT (c) and AtrNRT (d) genes in 3 days treated with different ammonium and nitrate ratio
向苋菜幼苗培养皿中加入N3溶液,以全蓝光(R∶B=0∶10)为对照,苋菜幼苗经过不同红蓝光配比处理3 d后,4个基因在R∶B=0∶10和R∶B=2∶8 处理下的基因相对表达量均较高且与其它4个处理有极显著差异。对AtrNiR和AtrNRT基因而言,R∶B=2∶8处理下基因相对表达量最高,与CK相比均有极显著差异(图7(a)和(d));对AtrNR和AtrAMT基因而言,全蓝光(R∶B=0∶10)处理下基因相对表达量最高,与其它处理相比有极显著差异(图7(b)和(c))。
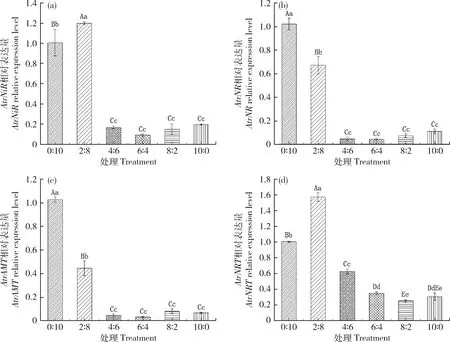
图7 不同红蓝光配比(R∶B)处理3 d后AtrNiR(a)、AtrNR(b)、AtrAMT(c)和AtrNRT(d)基因的相对表达量Fig.7 The relative expression of AtrNiR (a), AtrNR (b), AtrAMT (c) and AtrNRT (d) genes under different red and blue ratios treatment for 3 days
3 讨论与结论
3.1 苋菜AtrNiR基因分析
本研究通过克隆首次在苋菜中获得了NiR基因的ORF序列,命名为AtrNiR并在NCBI上提交,得到GenBank登录号:MT374155。生物信息学分析及进化树分析表明,苋菜AtrNiR编码的蛋白属于氮代谢相关蛋白,其氨基酸序列具有完整NiR结构,与其他物种NiR蛋白具有高度相似性。与苋菜AtrNiR蛋白亲缘关系最近的是菠菜、甜菜和藜麦的NiR蛋白,并且和石竹目植物及拟南芥聚为一个分支[21]。以上结果表明苋菜AtrNiR属于NiR家族,与其它植物中的NiR蛋白具有类似的功能,在生物进化过程中是保守的[22]。
3.2 不同氮素形态配比对苋菜NiR酶活性及AtrNiR基因相对表达量的影响
在高等植物叶片中,从 NO2-到NH4+的同化通过电子供体铁氧还蛋白在叶绿体中由 NiR 完成[23]。在本研究中,不同氮素配比处理3 d后NiR酶活性在N5处理下最高,这与前人研究结果不一致,可能是处理时间不一致,NiR受到高浓度NH4+-N的短时诱导,活性提高;随着处理时间增加,高浓度NH4+-N会抑制NiR活性,同时NO3--N 对NiR有促进作用[24]。当处理6 d时,NiR酶活性在N2处理下最高,说明不同氮素配比下的NiR酶活性比单一氮素下的更高,植物中NiR的基因表达规律会受到各种内在和外在因素的影响。对于不同氮素配比处理3 d后基因表达结果,AtrNiR与AtrNR都在N3处理下表达量最高,说明NR与NiR存在共促进和共抑制现象,二者是内在的偶联关系[25],AtrNR在N3处理下表达量最高且随着NH4+-N配比的增加基因相对表达量呈现先上升后下降的趋势,这与孙敏红等[26]在枳橙幼苗中的研究结果一致。但是不同氮素形态配比下处理3 d苋菜NiR酶活性与AtrNiR基因变化趋势不一致,可能是因为本研究只是克隆和定量分析了苋菜NiR基因家族其中1个成员,还有其他成员起到了协同或者相互抑制作用。有研究发现,参与茶氨酸合成途径中相关基因家族不同成员在茶树不同组织及发育时期也存在明显表达差异[27],因此对于苋菜NiR酶活性可能也是受整个NiR基因家族表达影响,而不是单一NiR基因影响,所以在本研究中AtrNiR基因表达变化趋势与酶活性不一致,这还需要进一步研究。
3.3 不同红蓝光配比对苋菜NiR酶活性及AtrNiR基因相对表达量的影响
光是植物生长发育重要环境因子之一,植株体内合成氨基酸和蛋白质的主要途径是植物氮代谢,增加红蓝复合光中蓝光比例可促进植株的氮代谢[12,15]。NiR是氮同化过程中第二个关键酶,从本研究结果可以看出,不同红蓝复合光可显著提高苋菜幼苗NiR酶活性且远高于单一蓝光和红光处理,说明红蓝复合光能够提升苋菜中将NO2-同化为NH4+的能力,这与王丽伟[28]在番茄幼苗中的结果相一致。在本研究中,在R∶B=0∶10与R∶B=2∶8处理下,AtrNiR、AtrAMT、AtrNR与AtrNRT的相对表达量都远高于其他处理,可以说明氮代谢相关基因受蓝光影响更大,增加复合光中蓝光比例能够提高苋菜氮代谢基因的转录水平,改善苋菜氮代谢,提升苋菜品质。在红蓝复合光处理下AtrNiR和AtrNRT相对表达量高于单一蓝光,而AtrNR和AtrAMT刚好相反,变化趋势不一致说明氮代谢相关基因转录水平的表达虽然受红蓝复合光调节,但是红蓝复合光对植株氮代谢部分基因转录水平的调节可能有着一个相对滞后的过程[28]。
有研究表明NiR对氮同化及NO生产这2个决定植物生长速率因素有着关键作用[29],在获得苋菜AtrNiR基因后,研究苋菜NiR基因结构,以及其在不同处理下的表达特性,可整体认识苋菜氮素初级同化,为后续更加全面分析NR、NiR、AMT及NRT等氮代谢关键基因间的相互作用奠定基础。环境参数改变会导致植物代谢性状显著变化[30],红光和蓝光处理能促进植物生长以及代谢物积累[31-32]。本研究结果表明,合适的铵硝配比和红蓝复合光配比可以显著提高苋菜幼苗相关氮代谢酶活性和氮代谢基因相对表达量。通过后续进一步研究可以提高苋菜对氮的吸收利用效率,改善苋菜幼苗氮代谢,促进总氮升高,有助于后续更深入研究苋菜的氮代谢调节机制,同时为基因操作培育苋菜氮高效利用品种提供分子生物学理论依据[33],对苋菜植物工厂环境参数设计及建立也具有重要的科学指导意义。
