MicroRNA-122-5p、microRNA-33a-3p在胃癌患者中的表达及与临床病理特征和预后的关系*
2021-07-29张伟蔡振花周瑞轻刘小慧江麒麟刘红波董永杰冯运章
张伟,蔡振花,周瑞轻,刘小慧,江麒麟,刘红波,董永杰,冯运章
(邯郸市中心医院1.普外二科,2.手术室,河北邯郸056001;3.邯郸市邯山区疾病预防控制中心,河北邯郸056008)
胃癌是人类常见的恶性肿瘤之一,高发病率和高病死率严重威胁人类的健康。中国是胃癌的高发地区,由于多数胃癌患者被诊断时已经处于胃癌晚期,因此胃癌患者的生存率较低且预后较差[1]。一些原癌基因和抑癌基因的异常表达是导致胃癌发生的主要原因[2],因此阐明胃癌的发病机制,为胃癌的早期诊断和治疗提供特异的生物标志物显得尤为重要。microRNA 是一类长度为22~28 个核苷酸序列的保守非编码RNA 分子,广泛存在于真核生物中,参与人类将近1/3 的基因表达调控。其在细胞周期、凋亡调控及发育时序的控制等过程中发挥重要作用[3]。microRNA-122-5p(miR-122-5p)参与多种肿瘤的发生、发展过程,研究[4-5]表明在胃癌和乳腺癌细胞中过表达miR-122-5p会抑制细胞的生长、侵袭和迁移,miR-122-5p 主要发挥抑癌基因的作用。miR-122-5p 在黑色素瘤血清中异常高表达,提示其在黑色素瘤的发生和发展过程中发挥重要作用[6]。 microRNA-133a-3p(miR-133a-3p)在多种肿瘤中存在异常表达,如膀胱癌[7]、结直肠癌等[8]恶性肿瘤。有研究发现,miR-133a-3p 在胃癌组织中异常表达,并抑制胃癌发生、发展[9];miR-133a-3p 与胃癌的发生、发展密切相关,有研究报道miR-133a-3p 能够抑制胃癌细胞SGC-7901 的增殖和迁移[10]。本研究主要检测miR-122-5p 和miR-133a-3p 在胃癌患者血清中的表达,分析两者与胃癌患者临床病理特征及预后的关系,为胃癌的预测和预后判定提供依据。
1 资料与方法
1.1 研究对象
收集2011年1月—2014年4月邯郸市中心医院94 例胃癌患者的血清标本,以相同例数的健康体检者的血清标本作为对照。纳入标准:所有胃癌患者临床资料及随访资料完整;术后病理学诊断为胃癌;患者术前未进行任何放疗和辅助治疗。排除标准:合并其他恶性肿瘤;术前已接受抗肿瘤治疗者;全身感染性疾病,肝、肾疾病者。本研究胃癌患者年龄25~71 岁,<60 岁患者53 例,≥60 岁患者41 例;男性65 例,女性29 例;低分化48 例,中、高分化46 例;淋巴结转移55 例,无淋巴结转移39 例;浸润深度:黏膜下各层36 例(黏膜层8 例,黏膜下层9 例,肌层19 例),浆膜层58 例;TNM 分期:Ⅰ+Ⅱ期43 例,Ⅲ+Ⅳ期51 例。本研究经医院医学伦理委员会批准,患者家属签署同意书。
1.2 标本采集及检测
体检当日采集健康体检者空腹静脉血5 ml,胃癌患者于住院第2 天采集空腹静脉血5 ml,将采集的静脉血标本放至促凝管中,温度4℃,1 600 r/min离心10 min,取上清液进行分装标记,置入-80℃冰箱冷冻保存待用。
1.3 血清总RNA提取及实时荧光定量聚合酶链反应(qRT-PCR)
Trizol(TaKaRa)提取来自受试者血清中的总RNA。琼脂糖凝胶电泳鉴定总RNA 纯度和浓度。按HiScript II Reverse Transcriptase(Vazyme)说明书步骤进行操作,将总RNA 逆转录为cDNA。然后以cDNA 为模板,按LC480 SYBR Green Master Mix(Roche)进行PCR 扩增。所有引物序列由上海捷瑞生物工程有限公司设计合成。反应条件:95oC 预变性2 min,95oC 变性30 s,65oC 退火1 min,70oC 延伸90 s,共45 个循环。U6为内参基因。miR-122-5p 正向引物:5'-GGAGTGTGACAATGGTG-3',反向引物:5'-GAACATGTCTGCGTATCTC-3';miR-133a-3p正向引物:5'-CGAGCCTTTGGTCCCCTTCAAC-3',反向引物:5'-TCAACTGCTGGTGTCGTGGAGTCGGC-3';U6正向引物:5'-CTTCGGCAGCACATATACT-3',反向引物:5'-AAAATATGGAACGCTTCACG-3'。采用2-ΔΔCt法计算miR-122-5p 和miR-133a-3p mRNA 相对表达量。所有实验均重复3 次。
1.4 随访
以电话或门诊复查的方式对所有患者进行随访,2~3 个月进行1 次随访,随访时间为患者确诊后1~60 个月至患者死亡或截止随访时间。
1.5 统计学方法
数据分析采用SPSS24.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;绘制Kaplan-Meier 生存曲线,比较采用Log rank χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清miR-122-5p 与miR-133a-3p mRNA相对表达量的比较
胃癌患者与健康体检者血清miR-122-5p 和miR-133a-3p mRNA 相对表达量比较,差异有统计学意义(P<0.05),胃癌患者低于健康体检者。见表1。
表1 两组血清miR-122-5p、miR-133a-3p mRNA相对表达量比较 (n=94,±s)
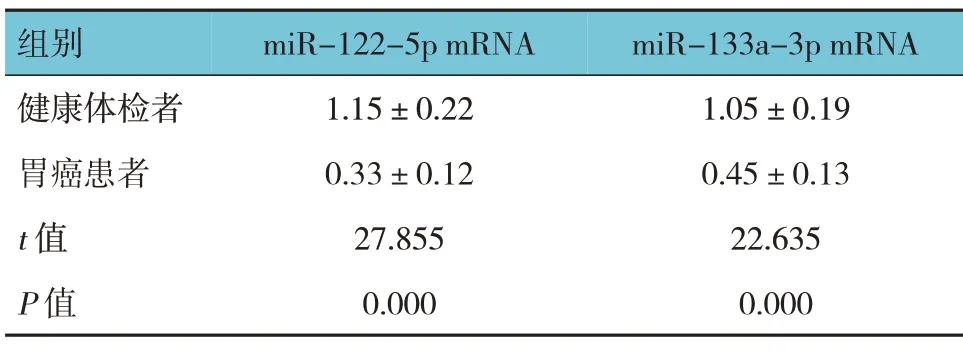
表1 两组血清miR-122-5p、miR-133a-3p mRNA相对表达量比较 (n=94,±s)
组别miR-122-5p mRNA miR-133a-3p mRNA健康体检者胃癌患者t 值P 值1.15±0.22 0.33±0.12 27.855 0.000 1.05±0.19 0.45±0.13 22.635 0.000
2.2 不同临床病理特征胃癌患者血清miR-122-5p和miR-133a-3p mRNA相对表达量比较
不同临床病理特征胃癌患者血清miR-122-5p mRNA 相对表达量比较,有淋巴结转移、低分化程度、浸润至浆膜层的患者低于无淋巴结转移、分化程度中高、浸润至黏膜下各层的患者(P<0.05);不同年龄、性别、TNM 分期患者血清miR-122-5p mRNA 相对表达量比较,差异无统计学意义(P>0.05)。不同临床病理特征胃癌患者血清miR-133a-3p mRNA 相对表达量比较,有淋巴结转移、低分化程度、浸润至浆膜层、TNM 分期为Ⅲ+Ⅳ期的患者低于无淋巴结转移,中、高分化程度中、浸润至黏膜下各层,TNM 分期为Ⅰ+Ⅱ期的患者(P<0.05);不同年龄、性别患者血清miR-133a-3p mRNA 相对表达量比较,差异无统计学意义(P>0.05)。见表2。
表2 不同临床病理特征胃癌患者血清miR-122-5p和miR-133a-3p mRNA相对表达量比较 (±s)
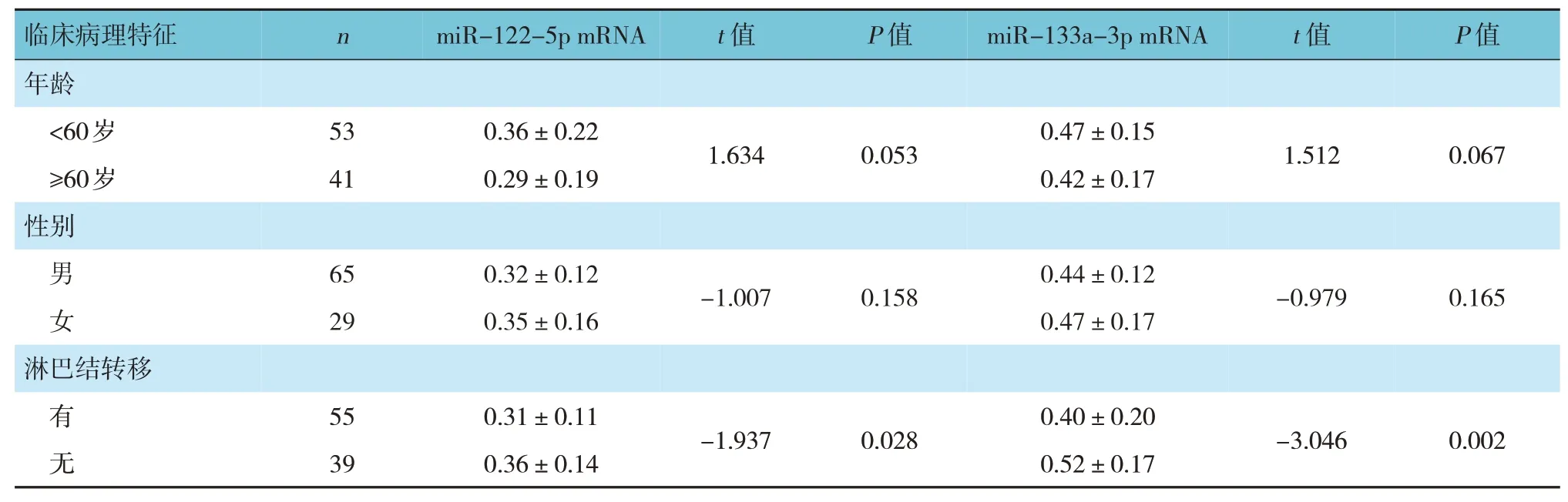
表2 不同临床病理特征胃癌患者血清miR-122-5p和miR-133a-3p mRNA相对表达量比较 (±s)
临床病理特征年龄n miR-122-5p mRNA t 值P 值miR-133a-3p mRNA t 值P 值<60岁≥60岁性别男女65 29 0.32±0.12 0.35±0.16-1.007 0.158 0.44±0.12 0.47±0.17-0.979 0.165淋巴结转移53 41 0.36±0.22 0.29±0.19 1.634 0.053 0.47±0.15 0.42±0.17 1.512 0.067有无55 39 0.31±0.11 0.36±0.14-1.937 0.028 0.40±0.20 0.52±0.17-3.046 0.002

续表2
2.3 胃癌患者血清miR-122-5p、miR-133a-3p表达水平与患者预后的关系
以miR-122-5p mRNA 相对表达量均值(0.33)为界,将胃癌患者分为miR-122-5p 低表达组和miR-122-5p 高表达组,每组47 例。Kaplan-Meier 生存曲线分析结果显示,miR-122-5p 低表达组与高表达组术后5年生存率分别为17.02%(8/47)和29.79%(14/47),两组比较,差异有统计学意义(χ2=5.135,P=0.023),miR-122-5p 低表达患者5年生存
3 讨论
胃癌是我国最常见的恶性肿瘤之一,恶性肿瘤主要来自胃黏膜上皮。目前手术切除是治疗胃癌的主要策略。虽然手术切除可极大提高胃癌患者生存率,但是,由于胃癌在早期阶段无明显的临床症状,大多数患者确诊时已处于癌症晚期,因此胃癌患者普遍具有较差的预后[11]。虽然世界范围内胃癌率低于miR-122-5p高表达患者。见图1。

图1 miR-122-5p表达与患者预后的Kaplan-Meier生存曲线
以miR-133a-3p mRNA 相对表达量均值(0.45)为界,将胃癌患者分为miR-133a-3p 低表达组和miR-133a-3p 高表达组,每组47 例。Kaplan-Meier生存曲线分析结果显示,miR-133a-3p 低表达组与高表达组的术后5年生存率分别为19.15%(9/47)和27.66%(13/47),两组比较,差异有统计学意义(χ2=4.492,P=0.034),miR-133a-3p 低表达患者5年生存率低于miR-122-5p高表达患者。见图2。的发病率和病死率近几年出现下降趋势,但胃癌仍然是威胁人类健康的恶性程度很高的肿瘤之一。根据研究者的统计数据,胃癌是第5 大最常见的恶性肿瘤,2012年新增近100 万的胃癌病例,占总数的6.8%[12]。此外,越来越多的人死于胃癌,使其成为死亡的第3 大原因。由于缺乏有效的治疗方法,准确预测胃癌患者的预后对其治疗十分重要。因此,寻找胃癌的具体发病机制,为胃癌的早期诊断和治疗及预后提供特异性的生物学标志物是目前研究的重中之重。

图2 miR-133a-3p表达与患者预后的Kaplan-Meier生存曲线
MicroRNA(miRNA)是一类序列高度保守的单链非编码RNA,这类非编码RNA 分子参与人类将近1/3 的基因表达调控过程,在多种癌症的发生、发展过程中发挥着不可替代的作用[13];同时已有研究表明,在多种肿瘤中,miRNA 可以作为特异性的分子标志物在癌症的早期和治疗过程中以及患者的预后检测方面发挥不可替代的作用[14]。根据目前的研究报道,miRNA 在乳腺癌、肺癌、前列腺癌等多种肿瘤中存在差异性表达[15-17]。miR-122-5p 在调控肿瘤的发生、发展中发挥重要作用,如在肝癌中miR-122-5p 异常高表达可以抑制癌细胞的生长、侵袭和迁移,同时诱导细胞发生凋亡[18]。在人透明细胞肾细胞癌中,miR-122-5p 高表达可以促进细胞的侵袭和迁移,进而发挥促癌基因的功能[19]。研究表明,异常高表达的miR-122-5p 可能通过NOP14 调控黑色素瘤细胞系SKMEI-110 和A-375 的细胞周期,进而导致细胞增殖抑制[20]。miR-133 序列在小鼠体内首次被发现,人类基因组中存在3 个已知的miR-133:miR-133a-1、miR-133a-2 和miR-133b[21]。有研究表明miR-133a在胃癌细胞系SGC-7901、MNK-45 和原发胃癌组织中均表现为下调,证实了miR-133a 在胃癌的发生、发展过程中发挥不可替代的功能和作用[8]。在胃癌组织和细胞中,miR-133a-3p 表现为异常表达,主要通过靶向Bcl-xL、Mcl-1 从而促进细胞发生凋亡[9]。
本文主要通过qRT-PCR 检测miR-122-5p 和miR-133a-3p 在94 例胃癌患者血清和健康体检者血清中的表达水平,实验结果显示,miR-122-5p 和miR-4317 在胃癌患者血清中表达较健康体检者均下调。同时对胃癌患者的临床病理特征进行分析,结果显示,当胃癌患者血清miR-122-5p 低表达时,发生明显的淋巴结转移,并且肿瘤出现低度分化和较深的浸润,浸润至浆膜层,结果表明miR-122-5p 在胃癌的发生、发展中主要发挥抑癌的作用,其低表达与肿瘤的恶性程度有关。同时Kaplan-Meier 生存曲线分析结果显示,miR-122-5p高表达的患者具有较高的术后生存率,可以作为辅助判断患者预后的一项指标。本研究还发现,当胃癌患者血清miR-133a-3p 低表达时,具有较晚的TNM 分期,且发生明显的淋巴结转移,同时肿瘤出现高度分化和较深的浸润,浸润至浆膜层,结果表明miR-133a-3p 在胃癌的发生、发展中主要发挥抑癌功能,其低表达与肿瘤的恶性程度有关。同时Kaplan-Meier 生存曲线分析结果显示,miR-133a-3p 高表达的患者具有较高的术后生存率,也可以作为辅助判断患者预后的一项指标。
综上所述,在胃癌的发生和发展过程中,miR-122-5p、miR-133a-3p 可能发挥着抑癌基因的功能,miR-122-5p、miR-133a-3p 的高表达能够抑制胃癌的形成和恶性进展过程,且均与患者的预后密切相关。因此miR-122-5p、miR-133a-3p 可能作为胃癌预测和预后的潜在靶点。
