龙虎人丹改善糖尿病小鼠肾损伤和纤维化的药效研究
2021-07-29高诗雨梁兰妹张荠李颖任梓漠赖文杰熊诗琳丁礼琴金家骅兰天
高诗雨,梁兰妹,张荠,李颖,任梓漠,赖文杰,熊诗琳,丁礼琴,金家骅,兰天
(1.广东药科大学药学院,广东广州 510006;2.上海中华药业有限公司,上海 201707)
糖尿病肾病(DN)是最常见且最严重的糖尿病微血管并发症,占糖尿病患者总数40%,是导致终末期肾病(end‑stage renal disease,ESRD)和糖尿病患者死亡的主要原因[1‑2]。DN临床主要特征为持续的蛋白尿及肾功能进行性下降,而肾小球硬化和肾小管间质纤维化病变与之密切相关。DN典型的肾形态学变化包括肾小球系膜扩张、基底膜(glomeru‑lar basement membrane,GBM)增厚、肾小管损伤、肾脏炎症浸润和肾小管间质纤维化等[3‑4]。纤维粘连蛋白(fibronectin,FN)和胶原是细胞外基质的主要成分,其过度分泌是促进肾小球硬化和肾间质纤维化的主要原因[5]。由于DN发病机制复杂,目前治疗DN的药物以降血糖类和肾素血管紧张素类药物为主,但它们在发挥治疗作用的同时也对机体产生不同程度的副作用。因此,开发治疗DN的新型靶向药物已成为国内外研究的热点。
龙虎人丹(LHRD)是由甘草、儿茶、肉桂、薄荷脑、冰片等11味中药材组成的中药复方,具有开窍醒神、和中止呕、祛暑化浊功效。可用于中暑头晕、恶心呕吐、腹泻及晕船、晕车[6]。该功效提示其具备调理脾胃、化浊健运的功能,而临床期糖尿病肾病的病机特点为“脾肾两虚,淤血阻滞肾络”[7],故探索LHRD健脾化浊功能对DN的干预作用具有十分重要的意义。此外,目前已有研究表明LHRD能显著降低STZ诱导的糖尿病小鼠的血糖,并可以通过抑制炎症因子释放和氧化应激途径改善CCl4诱导的慢性小鼠肝纤维化,或是通过提高肝脏抗氧化应激能力,抵制过量APAP诱导的急性肝损伤,进而起到肝保护作用[8‑10]。基于LHRD已有的临床用途及上述相关研究结果,本研究拟对LHRD在糖尿病肾脏并发症中的药效进行评价,以挖掘其潜在的应用价值,为LHRD的临床研究提供理论支持。
1 材料与方法
1.1 实验动物
38只SPF级C57BL6/J雄性小鼠,体质量22~25 g,8周龄,购自广东省医学实验动物中心,动物生产许可证号:SCXK(粤)2018‑0034。所有动物实验均按照中国动物福利法相关规定进行,并得到广东药科大学实验室动物伦理委员会的批准(No.gdpu‑lac2018062)。
1.2 药物及试剂
龙 虎 人 丹(LHRD,规格:0.04 g/丸,批号:161006,上海中华药业有限公司);阳性药氯沙坦(规格:50 mg/片,批号:2018005,杭州默沙东制药有限公司);链脲佐菌素(STZ,批号:WXBD0304V,美国Sigma公司);葡萄糖(批号:2018052069,天津致远化学试剂有限公司);尿蛋白、血肌酐和尿素氮检测试剂盒(批号:20181023、20181128、20181011,南京建成生物技术研究所);BCA蛋白定量试剂盒(批号:UD282629,美国Thermo Fisher Scientific公司);FN一抗(批号:CR3274504‑2,英国abcam公司);an‑ti‑GAPDH抗体(批号:N20908,北京全式金生物技术有限公司);苏木素伊红(H&E)染液(批号:0729A20,北京雷根生物技术有限公司);Masson三色染色液(批号:0928A20,北京雷根生物技术有限公司);SYBRGreen Supermix(批号:64309999,美国Bio‑Rad公司);TAKALA逆转录试剂盒(批号:AJ2014A,大连TAKALA公司);HRP标记羊抗兔、抗鼠二抗(批号:0000390794、0000379490,美国Pro‑mega公司)。
1.3 主要仪器
One‑Touch Ultra型血糖仪(型号:One‑Touch Ultra Vue,美国强生公司);多功能酶标仪(型号:1510,美国Thermo Fisher Scientific);LC480荧光定量PCR仪(型号:Roche LC 480,瑞士Roche);微型蛋白电泳转印系统(型号:PowerPac Basic,美国Bio‑Rad);化学发光仪(型号:3300029‑7Q,上海勤翔科学仪器有限公司);荧光显微镜(型号:BX51,日本Olympus);切片机(型号:RM2135,HistoCore MUL‑TICUT,德国Leica公司)。
1.4 方法
1.4.1 糖尿病肾病小鼠模型的构建、分组及给药 48只雄性小鼠,随机选取42只小鼠,用STZ合并HFD诱导糖尿病引起的C57BL/6L小鼠肾损伤模型[11]。选取雄性小鼠隔夜禁食不禁水12 h(9:00 pm−9:00 am),以40 mg/kg剂量连续5 d腹腔注射给药,第7天小鼠血糖稳定后禁食6 h,小鼠尾静脉取血测空腹血糖,血糖值大于11.1 mmol/L视为小鼠糖尿病模型成功[11‑12]。实验分组情况如下:正常对照组(0.5%CMC‑Na)小鼠6只,模型组(0.5%羧甲基纤维素钠,0.5%CMC‑Na)、LHRD 100 mg/kg组、LHRD 200 mg/kg组、氯沙坦(阳性药,30 mg/kg)组,每组各8只。研究表明,LHRD 100 mg/kg对STZ诱导的糖尿病小鼠具有明显的降糖作用[8];同时,氯沙坦30 mg/kg剂量能显著改善2型糖尿病小鼠蛋白尿水平升高和肌酐清除率下降情况,明显改善肾损伤,包括肾小球硬化和间质纤维化[13]。在此基础上,本研究设置给药剂量为LHRD100 mg/kg、200 mg/kg和氯沙坦30 mg/kg。分组后,每天固定时间灌胃给药,灌胃量10μL/g,正常对照组小鼠和模型组小鼠灌胃给予0.5%CMC‑Na。治疗期间,所有小鼠同时给予HFD饲料,实验周期为12周。HFD购自广东省医学实验动物中心,批号181106054,成分包括蛋白质19%,脂肪18%,碳水化合物50%。
1.4.2 检测各组小鼠肾质量体质量比 取材前各组小鼠禁食不禁水12 h,12 h后先记录所有小鼠体质量,再麻醉取材。乙醚麻醉小鼠昏迷后眼球取血,血液室温放置30 min后常温3 000 r/min离心15 min,吸取上层血清储存于−80℃以待检测。剪取小鼠肾脏并去除外层包膜及所有脂肪组织,记录每只小鼠肾脏质量。各组小鼠肾质量体质量比即为:各小鼠肾脏质量(mg)÷体质量(g)。
1.4.3 检测各组小鼠24 h尿蛋白水平 代谢笼收集各组小鼠24 h尿液排泄量,记录所收集的尿液体积。24 h尿蛋白检测及计算方法按照使用说明书(南京建成生物工程研究所)进行。
1.4.4 检测各组小鼠血肌酐和尿素氮水平 血肌酐和尿素氮水平的检测,按照南京建成生物工程研究所相应检测试剂盒中的使用说明进行操作。
1.4.5 小鼠肾脏HE和Masson病理染色 小鼠肾脏用福尔马林溶液固定24 h(4℃),石蜡包埋,用切片机将肾脏切成3μm厚病理切片。按照HE、Masson试剂盒的使用说明进行肾脏病理染色。后期通过显微镜拍片观察组织病理损伤程度,每个样本随机采集6个视野。对Masson染色的阳性面积统计,采用ImageJ软件对每个样本所采集的6个视野进行阳性表达面积统计。
1.4.6 Westernblot检测小鼠肾脏FN蛋白表达情况 取20 mg肾脏组织,加300μL RIPA裂解液,通过机械匀浆2 min(60 Hz/min)。高速离心机4℃,12 000 r/min离心30 min后收集上清液,按照说明书用BCA试剂盒进行蛋白定量。将15μL含等量蛋白(30μg)样本通过SDS‑PAGE凝胶电泳进行蛋白条带分离。将分离的蛋白转移到聚偏二氟乙烯(PVDF)膜上。室温下,PVDF膜用5%脱脂牛奶封闭1 h,用一抗(1∶1 000)在4℃下孵育过夜。第2天,用二抗(1∶5 000)室温孵育1 h,PVDF膜用电化学发光显影液结合化学发光系统检测灰度,以GAPDH为内参。
1.4.7 荧光定量PCR检测小鼠肾脏FN基因表达 用Trizol法提取肾脏组织总RNA并使用Takara逆转录试剂盒进行逆转录。按照SYBR Green Super Mix说明书进行实时荧光定量PCR,并测定Ct值。所使用引物信息如下:FN引物序列:上游5’‑GATTGGC‑GACAAGTGGAG‑3’,下游5’‑TAGGTGAACGGG AG GACA‑3’;β‑actin引物序列:上游5’‑ATGGAG GGGAATACAGCCC‑3’,下游5’‑TTCTTTGCAGCTC CTTCGTT‑3’。PCR扩增反应条件为:95℃5 min;95℃10 s,60℃15 s,72℃20 s,循环40个周期。以β‑actin为内参基因,使用2−△△Ct法计算每个基因mRNA的相对表达量(△Ct=目的基因Ct值−内参基因Ct值)。
1.5 统计学分析
实验所得数据均用(±s)表示,采用SPSS16.0统计软件进行统计分析,多组间比较采用单因素方差分析,两组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 LHRD对糖尿病小鼠肾脏生理和生化参数的影响
糖尿病小鼠肾脏生理和各项代谢生化指标变化如表1所示,与正常对照组小鼠对比,模型组小鼠肾质量体质量比明显升高(P<0.01),LHRD 100、200 mg/kg组和氯沙坦组小鼠的肾质量体质量比均明显下调(P<0.01)。结果表明LHRD对糖尿病小鼠肾脏的整体肥大病变具有改善作用。与正常对照组小鼠相比,模型组小鼠24 h尿蛋白、血肌酐和尿素氮水平显著升高(P<0.01),表明经STZ合并HFD诱导后,糖尿病小鼠肾脏功能受损,肾脏滤过率下调。与模型组相比,LHRD 100、200 mg/kg组小鼠24 h尿蛋白(P<0.05)、血肌酐和尿素氮的表达水平均明显下降(P<0.01),氯沙坦组小鼠的24 h尿蛋白、血肌酐和尿素氮的表达水平也明显下降(P<0.01)。表明LHRD可改善糖尿病引起的小鼠肾脏滤过率下调。
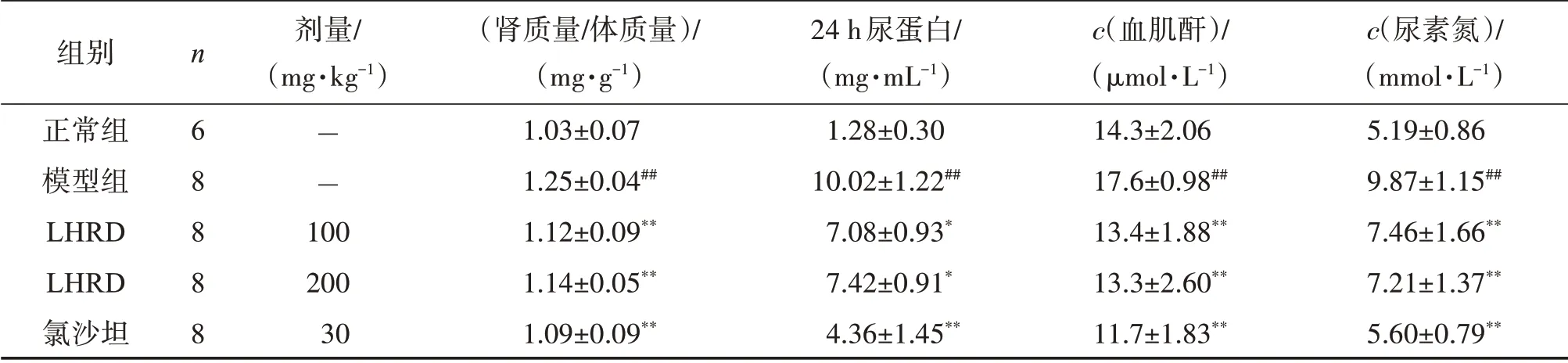
表1 各组糖尿病小鼠肾质量体质量比、24 h尿蛋白、血肌酐和尿素氮水平Table1 Levels of kidney weight/body weight,24 h urine protein,serum creatinineand urea nitrogen of mouse in each group(x±s)
2.2 LHRD对糖尿病小鼠肾小球肥大和肾小管损伤的影响
HE染色观察各组小鼠肾脏组织病理学变化,HE染色结果显示,与正常对照组相比,模型组小鼠肾小球明显肥大,部分肾小管内皮发生脱落,小管形态不完整,肾小管明显扩张。此外,模型组小鼠肾小球区域及部分肾小管中细胞核数量增加、胞核排列紊乱,表明肾脏发生炎性浸润。与模型组相比,LHRD 100、200 mg/kg组和氯沙坦30 mg/kg组小鼠上述情况明显减轻。结果表明LHRD对糖尿病引起的小鼠肾脏结构病变具有保护作用,能改善糖尿病小鼠肾小球肥大、肾小管损伤情况,抑制糖尿病小鼠肾脏炎症反应的发生。见图1。

图1 LHRD改善糖尿病小鼠肾小球扩张和肾小管损伤(HE染色,40×)Figure 1 LHRD improves glomerular hypertrophy and renal tubular damage in diabetic mice(HEstaining,40×)
2.3 LHRD改善糖尿病小鼠肾脏胶原沉积情况
Masson病理染色检测各组小鼠肾脏胶原沉积结果如图2所示。与正常对照组小鼠相比,模型组小鼠肾小球和肾小管间质Masson染色呈深蓝色,表明糖尿病小鼠肾脏胶原沉积明显增加,肾纤维化加重。与模型组相比,各给药组小鼠肾脏胶原分泌和沉积明显被抑制。Masson阳性表达面积统计结果与肾脏Masson病理染色结果相符,与正常对照组小鼠相比,模型组小鼠胶原阳性表达面积显著增加(P<0.01),LHRD 100、200 mg/kg组和氯沙坦30 mg/kg组小鼠明显抑制胶原表达(P<0.05或P<0.01),结果见表2。表明LHRD能减轻STZ‑HFD诱导的糖尿病小鼠肾脏胶原沉积,改善肾纤维化情况。

表2 各组小鼠肾脏Masson染色阳性面积统计表Table 2 Statistical table of Masson staining positive area of kidney in each group(x±s)

图2 LHRD改善糖尿病小鼠肾脏胶原沉积(Masson染色,40×)Figure 2 LHRD improves collagen deposition in kidney of diabetic mice(Masson staining,40×)
2.4 LHRD改善糖尿病小鼠肾脏FN过度表达情况
结果见图3。与正常对照组相比,模型组小鼠肾脏中FN蛋白显著上调,LHRD 100、200 mg/kg和氯沙坦30 mg/kg组糖尿病小鼠的FN蛋白条带变细、颜色变浅,表明LHRD显著抑制糖尿病小鼠肾脏过分泌FN蛋白。为进一步观察LHRD对FN的调控作用,提取各组小鼠肾脏中的mRNA,从基因水平检测FN mRNA变化情况。FN mRMA检测结果与蛋白检测结果一致,见表3。与正常对照组相比,模型组小鼠肾脏的FN mRNA水平显著上调(P<0.01),LHRD 100、200 mg/kg和氯沙坦30 mg/kg组糖尿病小鼠肾脏的FN mRNA水平明显下调(P<0.05)。结果表明LHRD能抑制糖尿病小鼠肾脏中FN的表达,进而延缓肾脏的纤维化进程。

表3 LHRD降低糖尿病小鼠肾脏FN mRNA表达Table 3 LHRD reduces the expression of FN mRNA in kid‑ney of diabetic mice(x±s)

图3 LHRD降低糖尿病小鼠肾脏FN蛋白表达Figure 3 LHRD reduces the expression of FN protein in kid‑ney of diabetic mice
3 讨论
文献报道显示,预计到2025年,全球糖尿病患者将由2007年2.46亿上升至3.8亿,增幅55%,其中,糖尿病发展成DN的患者将超过1亿[14]。在DN形成早期若不及时加以干预,最终可发展为ESRD,ESRD患者只能进行血液透析或换肾。据统计53%的ESRD确诊患者仅有3年的生存时长[15]。因此,DN是继脑血管动脉、冠状动脉硬化症后最危害人体健康的疾病,开展DN的防治工作刻不容缓。
DN起因是高血糖,并伴随着肾脏功能逐渐下调和恶化。一般DN病理进程起始于肾小球高灌注,导致滤过功能异常,继而发生GBM增厚,系膜扩张,肾小球过度肥大,此时出现微量白蛋白尿,若不加以药物干预治疗,将会出现持续性蛋白尿,肾功能下调,肾小球硬化、肾小管损伤,最终导致不可逆性肾病。中药复方具有多靶点、多途径以及整体调节等优势,具有临床用药开发的潜质。LHRD作为具有百年发展史的中华中药复方,具备调理脾胃、化浊健运的功能。关于LHRD的临床前研究表明,LHRD对STZ诱导的糖尿病小鼠具有显著的降糖作用[11],提示LHRD可能具有抗DN的功效,即减轻高糖血症引起的肾脏高滤过负荷。有研究表明,将近端肾小管上皮细胞(PTECs)暴露在高水平白蛋白会激活PTECs,从而诱导趋化因子和炎症因子表达,如IL‑1β、IL‑6、IL‑8、和CCL2等,进而引起炎症反应[16‑18]。本研究结果发现,给予LHRD 100、200 mg/kg治疗的糖尿病小鼠24 h尿蛋白排泄量降低,还能减轻血肌酐和尿素氮含量,表明LHRD可能通过提高肾小管重摄取功能和肾小球滤过率,进而干预DN进程。此外,肾脏病理染色结果发现,LHRD可改善糖尿病小鼠肾脏肥大和肾小管损伤,抑制糖尿病引起的小鼠肾脏炎症浸润。肾脏纤维化是DN发展至ESRD的关键病理进程,促纤维化相关蛋白,如胶原、FN等的过度合成和分泌是纤维化形成的重要环节,抑制该类蛋白表达可延缓DN进程[19]。本研究结果显示,LHRD能明显抑制糖尿病小鼠肾脏胶原沉积和FN的表达。
LHRD由多味中药组成,其中甘草、肉桂、木香、八角茴香、丁香、砂仁和胡椒中均含有黄酮类成分,如丁香总黄酮对DPPH自由基有很好的清除率,且清除效果呈浓度依赖性[20]。研究表明,八角茴香中除黄酮类对DPPH自由基有较好的清除作用外,八角茴香油成分也具有较强的抗氧化活性[21]。此外,具有抗氧化活性成分的还有砂仁多糖、肉桂黄酮类等[22‑23]。龙虎人丹各味单体药除具有抗氧化活性外,还具有抗炎作用,而作为LHRD的主要成分,甘草可以通过调控ERK/NF‑κB/miR‑155信号通路改善脂质代谢紊乱并具有抗炎活性[24]。此外,其他成分如薄荷脑、丁香和木香也具有抗炎活性[25‑27]。研究发现LHRD具有较强的抗氧化和抗炎症能力[9‑10]。DN发病机制复杂,其中高血糖、氧化应激和炎症是糖尿病诱发肾损伤和纤维化的关键因素。因此,推测LHRD可能是通过血糖控制、抗氧化和(或)抗炎症途径发挥肾脏保护作用。
综上所述,LHRD可改善STZ合并HFD诱导的糖尿病小鼠肾脏功能受损情况,具体表现为LHRD治疗的糖尿病小鼠肾质量体质量比、24 h尿蛋白、血肌酐和尿素氮水平显著下调。同时,LHRD明显改善糖尿病小鼠肾小球肥大、肾小管损伤和肾脏炎症浸润现象。此外,LHRD明显抑制糖尿病小鼠肾脏中促肾脏纤维化因子、胶原和FN的表达,治疗效果与氯沙坦治疗效果相当。以上研究结果均表明LHRD对糖尿病合并肾脏并发症具有保护作用,其具体的作用机制有待进一步研究。
