黄连素通过调控Hippo信号通路抑制人胃癌细胞系HGC‑27的机制研究
2021-07-29王思敏陈紫航罗雪霞杨艳红雷自立
王思敏,陈紫航,罗雪霞,杨艳红,雷自立
[1.广东药科大学附属第一医院(临床医学院),广东广州 510080;2.广东药科大学中医药研究院,广东广州 510006]
胃癌(gastric cancer,GC)已成为威胁全球健康的主要疾病之一,根据报道,2018年全球胃癌新发病例约为103万,在全部恶性肿瘤中排名第5[1],胃癌在东亚地区特别是中国发病率极高[2]。尽管在过去几年,胃癌的存活率有所提高,但预后仍不容乐观,大大降低了人们的生活质量,加重了家庭负担[3]。胃癌主要治疗方法有手术、放疗、化疗等[4‑5],化疗通常有较大不良反应。因此,需要寻找更多具有抗肿瘤潜能的药物。
黄连素(berberine,BBR)是一种生物活性碱,其成分主要是小檗碱,可以从我国传统中药黄连、黄柏等中提取[6]。黄连素在临床上多用来治疗腹泻和胃肠炎症[7],近几年发现黄连素有抗炎、抗氧化和器官保护作用,在肝癌、肺癌、乳腺癌等肿瘤中有明显的抗肿瘤作用[8‑10],但目前黄连素与胃癌相关的研究不多,黄连素抑制胃癌的机制尚不完全清楚。本实验室前期研究工作发现黄连素可以通过调控增殖、凋亡、坏死、自噬及细胞连接相关基因的表达发挥抑制胃癌细胞的作用,进一步采用miRNA测序和RNA测序方法建立了黄连素处理SGC‑7901的miR‑NA和mRNA表达谱,在RNA测序中鉴定出1 960个上调基因和4 837个下调基因;Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)分析表明,这些差异表达的基因与癌症和代谢等途径有关,进一步分析了细胞周期、凋亡、炎症、代谢、细胞连接、乙酰化过程等基因的miRNA‑mRNA调控网络,在黄连素处理的SGC‑7901细胞中发现了一些新的抗肿瘤途径,提示黄连素有可能通过调控Hippo信号通路发挥抑制肿瘤的作用[11]。
Hippo信号通路作为近年来新发现的一条通路,在器官发育调控方面起重要作用,越来越多的研究表明Hippo信号通路在多种癌症包括胃癌的发生发展中起着关键作用[12]。幽门螺旋杆菌感染是近年来公认的重要胃癌危险因素之一,Amieva MR等[13]报道在胃炎和幽门螺旋杆菌感染患者中往往有细胞间连接失调,导致Hippo信号通路紊乱,加大了胃癌的患病风险。miR‑375是一种能抑制胃癌的microRNA,异位表达的miR‑375在体内外均能抑制胃癌细胞的生长,Kang等[14]发现Hippo通路中3个组分YAP1、TEAD4和CTGF的表达水平与miR‑375的表达水平呈负相关,是miR‑375的直接靶点。有关Hippo信号通路在胃癌中发挥重要作用的报道不少,但此前未见关于黄连素通过调控Hippo信号通路发挥抑制胃癌作用的类似报道。本实验室前期工作通过RNA测序提示黄连素可能通过调控Hip‑po信号通路发挥抑制胃癌的作用,本研究进一步利用人胃癌细胞系HGC‑27验证黄连素通过调控Hip‑po通路作用抑制胃癌的分子机制,为黄连素在胃癌临床防治中的潜在应用提供更充足的理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 人胃癌细胞系HGC‑27(中国科学院上海细胞库);黄连素(碧云天生物技术公司,质量分数≥98%,相对分子质量371.82);DMSO(广州瑞舒生物科技有限公司);10%(φ)胎牛血清、RP‑MI1640培养基、胰酶以及PBS缓冲溶液(美国Hy‑Clone公司);Trizol、反转录试剂盒(日本Takara公司);DEPC·H2O、引物(上海生工生物工程股份有限公司);氯仿、异丙醇(天津市大茂化学试剂厂);生化培养箱(上海精宏实验设备有限公司);超微量紫外分光光度计(美国Thermo Scientific公司);Piko‑Real 96型Real‑time PCR仪(美国Thermo Fisher公司)。
1.2 方法
1.2.1 细胞培养与药物处理 人胃癌细胞HGC‑27常规置于1640完全培养基,内含10%胎牛血清,1%青霉素和链霉素,在37°C、5%(φ)CO2条件下培养。将对数生长期的胃癌细胞消化计数,以1×105/孔接种于6孔板中,将细胞分为3组:对照组、黄连素5μmol/L浓度组和黄连素10μmol/L浓度组。将黄连素溶于DMSO,配制浓度为5μmol/L和10μmol/L的黄连素。待细胞长至80%~90%时弃培养液,每孔加入新鲜的培养基2 mL,对照组、黄连素5μmol/L浓度组和黄连素10μmol/L浓度组分别加入20μL DMSO、5μmol/L和10μmol/L黄连素,继续培养,24 h后收集细胞。
1.2.2 利用Real‑time PCR检测Hippo信号通路重要基因的表达水平 对照组及黄连素组的细胞弃上清,用PBS清洗3遍。加入RNA裂解酶Trizol裂解。裂解液经氯仿抽提(每1 mL Trizol加0.2 mL)、异丙醇沉淀(每1 mL Trizol加入0.5 mL)、75%(φ)乙醇(每1 mLTrizol加入1 mL)洗盐,沉淀干燥后以适量DEPC‑H2O溶解,紫外分光光度计测吸光度(A)值,−80℃保存。反转录按PrimeScript RT reagent Kit说明书操作,得到cDNA作为Real‑time PCR反应的模板。根据NCBIGene网页公布的基因序列,利用NCBI在线引物设计软件设计引物,引物由生工生物工程(上海)股份有限公司合成,具体引物序列见表1。使用Thermo Piko Real‑time PCR系统,10μL反应体系包括:上下游引物(10μmol/L)各0.2μL,cDNA模板(100 ng)1μL,SYBR Green反应液5μL,dH2O补齐至10μL。PCR循环参数为:95°C预变性30 s,95°C 45 s,60°C 20 s,65°C 15 s,40个循环。采用标准曲线法分析数据,GAPDH作为内对照,检测黄连素处理后Hippo信号通路关键基因表达水平的变化,融解曲线用来保证扩增产物的特异性。

表1 引物序列Table1 Primer sequence
1.2.3 利用Western blot检测Hippo信号通路重要蛋白的表达水平 用1×PBS充分洗涤细胞,再用裂解液(按RIPA∶蛋白酶抑制剂=100∶1的体积比)裂解细胞抽提总蛋白,采用BCA法测定蛋白浓度。取20μg总蛋白上样,进行SDS‑PAGE凝胶电泳,转PVDF膜,脱脂牛奶封闭1 h后加入一抗。电转后的PVDF膜用含5%BSA的TBST封闭1 h,再分别加入相应的一抗,4℃孵育过夜。次日,经TBST(10 min×3次)洗涤后,分别加入相应辣根过氧化物酶(horse‑radish peroxidase,HRP)标记的二抗室温孵育1 h。使用ECL化学发光试剂显影,以GAPDH为内参,利用image Lab和image J计算灰度值,对目的蛋白表达量进行分析。抗体信息见表2。

表2 抗体信息Table2 Antibody information
1.2.4 统计分析 所有实验重复3次,计量资料以±s表示。使用SPSS16.0软件进行统计学分析,正态分布变量多组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 黄连素对HGC‑27细胞形态学的影响
黄连素处理24 h后镜下可观察到,视野中黄连素5、10μmol/L组贴壁细胞数量明显减少,有些出现了空泡,悬浮细胞增加(见图1),提示黄连素对HGC‑27胃癌细胞有抑制作用。

图1 黄连素对HGC‑27细胞形态的影响Figure 1 Effect of berberine on the morphology of HGC‑27 cells
2.2 黄连素对HGC‑27胃癌细胞中Hippo通路相关分子mRNA表达水平的影响
与对照组相比,黄连素组中TEAD3(5μmol/L组P<0.05;10μmol/L组P<0.01)、TEAD4(5μmol/L组P<0.05;10μmol/L组P<0.01)、YAP(10μmol/L组P<0.01)及CyclinE1(10μmol/L组P<0.01)表达水平显著下降,呈浓度依赖性的趋势;MST1表达水平显著高于对照组(10μmol/L组P<0.05)。见图2。

图2 利用Real‑time PCR检测黄连素处理后HGC‑27细胞中Hippo信号通路基因表达的影响Figure 2 Effect of berberine on the expression of Hippo signaling pathway genes in HGC‑27 cells detected by real‑time PCR
2.3 黄连素对HGC‑27胃癌细胞中Hippo通路相关分子蛋白表达水平的影响
进一步利用Western blot检测了MST1、YAP、TEAD3、TEAD4及CyclinE蛋白的表达水平。与对照组相比,黄连素组中TEAD4(5μmol/L组P>0.05;10μmol/L组P<0.05)、YAP(5μmol/L组P>0.05;10μmol/L组P<0.01)及CyclinE1(10μmol/L组P<0.01)表达水平显著下降,TEAD3表达水平有降低趋势,但差异无统计学意义;MST1和p‑YAP表达水平显著升高(10μmol/L组P<0.05),p‑MST1表达水平也呈现上升趋势,但差异无统计学意义。见图3和图4。

图3 Western blot检测黄连素处理后HGC‑27细胞中Hippo信号通路蛋白表达的影响Figure 3 Effect of berberine on the expression of Hippo signaling pathway proteins in HGC‑27 cells detected by western blot
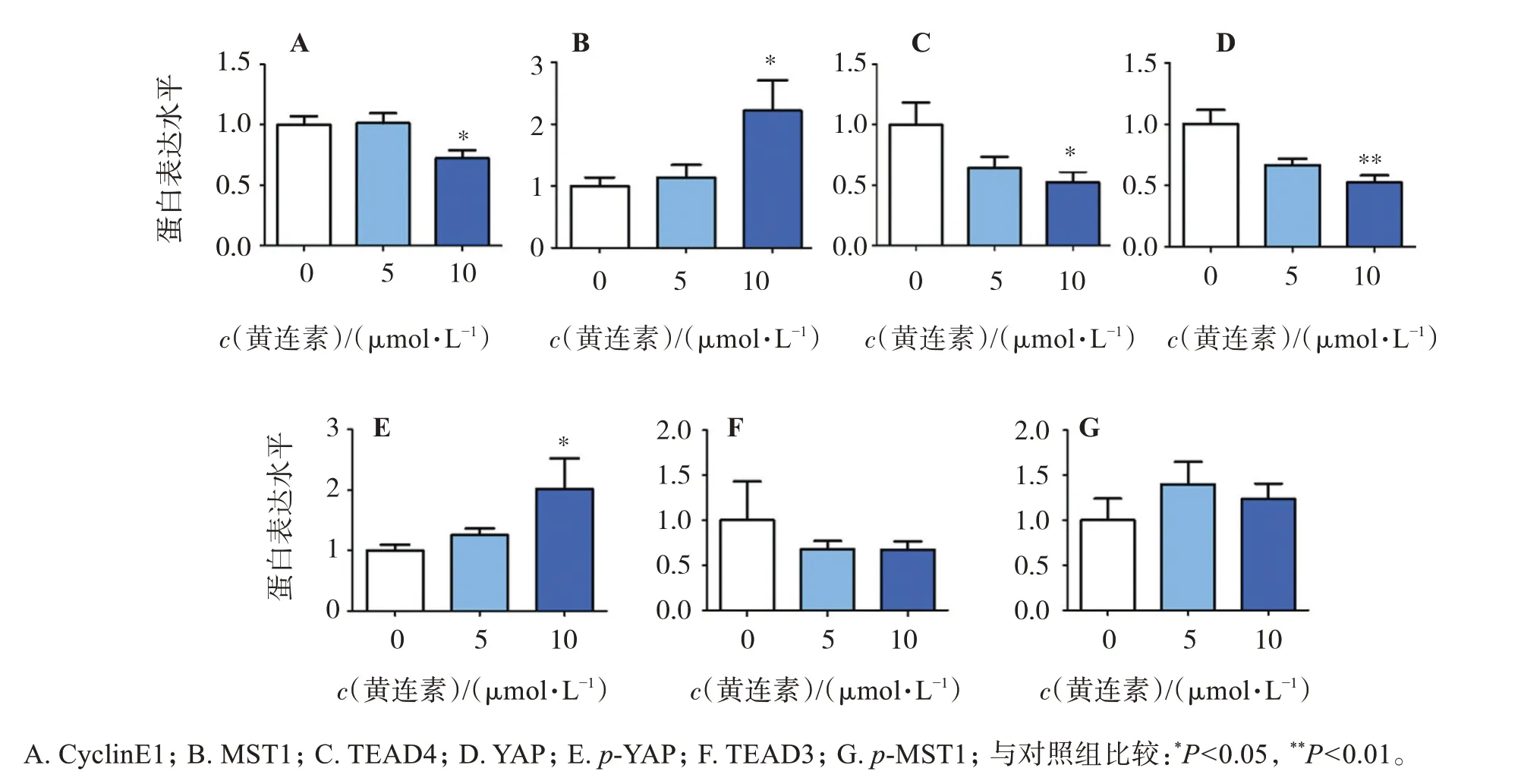
图4 利用灰度计算黄连素处理后HGC‑27细胞中Hippo信号通路蛋白表达的影响Figure 4 Effect of berberine on the expression of Hippo signaling pathway proteins in HGC‑27 cells by gray calculation
3 讨论
在肿瘤化疗治疗中,寻找高效低毒且多靶点的药物已成为研究热点[5,15],而黄连素作为一种多年来在临床中应用于胃肠道炎症的中药,目前发现有抗肿瘤的作用[16]。
Hippo通路研究始于1994年果蝇wts基因的发现[17],故以果蝇ste‑20样激酶Hippo命名。研究表明Hippo信号通路在细胞增殖与分化、组织损伤再生、肿瘤发生和发展过程中起重要作用,并参与肠道中众多生理及病理进程的调控[18]。Hippo信号通路包括上游调节分子、核心分子及主要的下游效应分子3部分,其核心激酶链包括MST1/2、SAV1、LATS1/2和MOB1等,而YAP/TAZ为主要的下游效应分子[19]。Hippo信号通路受到机械环境、G蛋白耦联受体信号、细胞能量水平、氧化应激和缺氧等多种信号调控,当Hippo信号通路被激活时,MST1/2在支架蛋白SAV1的协助下,磷酸化MOB1和LATS1/2并加强它们之间的相互作用,磷酸化的LATS1/2被激活,然后在多个位点上磷酸化YAP/TAZ,磷酸化的YAP/TAZ滞留在细胞质中,被泛素化降解,从而抑制细胞生长、增殖和诱导细胞凋亡[18]。当Hippo信号通路受到抑制时,YAP去磷酸化后进入细胞核中,主要与TEAD家族的DNA结合因子配对,通过调控细胞周期蛋白CyclinE、结缔组织生长因子CT‑GF等基因的表达来刺激细胞增殖[20]。Hippo信号通路失调会导致细胞过度增殖,与癌症的发生和发展密切相关[21]。
蛋白激酶(mammalian sterile 20‑like kinase1/2,MST1/2)是体内普遍表达的一类丝/苏氨酸蛋白激酶,可在外界刺激下参与细胞凋亡,是哺乳动物中重要的抑癌基因[22]。MST1/2基因全身敲除的小鼠胚胎中,往往有肝脏、心脏、胃和脾的急剧过度生长[23]。与正常胃黏膜相比,胃癌组织中的MST1/2水平通常降低[24]。本实验用黄连素处理HGC‑27细胞系24 h后,MST1基因表达水平显著上升,Western blot结果表明磷酸化和非磷酸化MST1蛋白水平表达上调,说明黄连素可通过激活MST1的表达来抑制肿瘤的生长,诱导胃癌细胞凋亡。
Yes相关蛋白(Yes‑associated protein,YAP)是一种转录共激活因子,是Hippo信号通路的一个关键蛋白,最近研究表明,YAP和许多癌症的启动和实体瘤增长有关[25‑26]。在胃癌黏膜中Hippo通路的YAP表达水平明显高于其在正常胃黏膜中的表达水平,在胃癌MKN‑28/74细胞系中敲除YAP基因,细胞的增殖侵袭能力下降[27]。这些均提示Hippo通路通过YAP这一转录调控因子对胃癌具有一定影响。本研究结果表明,与对照组相比,黄连素处理后的HGC‑27胃癌细胞中YAP的mRNA和蛋白表达水平均显著降低。随着黄连素浓度升高,YAP磷酸化失活,p‑YAP蛋白表达水平上调,而YAP表达水平则下降。这表明黄连素有可能通过激活Hippo通路中的关键下游效应因子YAP,使其磷酸化后被泛素化降解,无法进入细胞核发挥作用,从而抑制了下游相关增殖、生长基因的表达。
TEA domain transcription factors(TEAD)是YAP在下游调控基因转录的关键分子,在细胞增殖再生和组织内稳态中发挥着重要作用[28]。Guan实验室对人类转录因子库进行筛选,发现TEADs可作为YAP激活最强的转录因子[29]。VGLL4与TEAD竞争结合YAP阻碍TEAD的激活,抑制胃癌细胞的生长[30]。Jiao等[31]通过转染TEAD4突变体破坏DNA结构,阻碍YAP诱导的TEAD4激活和靶基因转录,抑制胃癌细胞HGC‑27的生长和集落形成。本研究检测到黄连素处理组TEAD3和TEAD4的mRNA和蛋白表达水平均显著下降,证明黄连素有可能是通过YAP磷酸化降解、抑制TEADs,从而抑制胃癌HGC‑27细胞的生长。
CyclinE是G1期细胞周期增殖信号的蛋白,过表达促使细胞过度增殖而发生癌变[32]。YAP通过直接靶向细胞周期蛋白调节细胞周期,加速细胞分裂[17]。Zhang等[33]通过Oncomine、The Cancer Genome Atlas datasets等基因库的数据分析,发现Cyclin家族的高表达往往与胃癌患者的不良预后紧密相关,其中胃癌组织CyclinE的mRNA水平往往高于正常胃组织。前期实验室研究结果发现黄连素将MCF‑7细胞明显阻滞在细胞周期G1期[11]。在本研究中,CyclinE1表达水平的下降表明黄连素的抗肿瘤作用与调控Hippo通路有关。
本实验室前期工作通过生物信息学分析预测到黄连素可能通过调控Hippo信号通路这一潜在靶点抑制胃癌细胞的增殖,为了进一步阐明黄连素抗肿瘤作用的分子机制,本研究利用Real‑time PCR和Western blot检测了黄连素处理人胃癌细胞HGC‑27中Hippo信号通路中的重要分子MST1、YAP、TEAD3、TEAD4和CyclinE1等的表达水平,发现在胃癌细胞HGC‑27中黄连素通过促进MST1磷酸化激活Hippo信号通路,进而磷酸化关键效应因子YAP,使其失活,并且降低了TEAD4、YAP的靶基因CyclinE1的表达水平,从而抑制了胃癌细胞的增殖和侵袭。本研究探讨了黄连素通过调控Hippo信号通路抑制胃癌细胞的分子机制,为黄连素在胃癌临床治疗方面的潜力和机制提供了一定的理论基础,也为胃癌治疗和预后的分子机制提供了新靶点。
