NOX4抑制剂GKT137831诱导肺鳞癌H226细胞凋亡及增强紫杉醇敏感性的研究
2021-07-29宋少飞刘冰
宋少飞,刘冰
(广东药科大学药学院,广东广州 510006)
癌症是目前影响人类生命健康的重要疾病。近年来死于癌症的人数逐年增加,其中肺癌作为最常见的癌症之一,其发病率和致死率在众多癌症中位居榜首。肺癌主要有两种类型,小细胞肺癌(small cell lung carcinoma,SCLC)和非小细胞肺癌(non‑small cell lung carcinoma,NSCLC),其 中NSCLC约占肺癌总数的80%~85%,而NSCLC又包括肺鳞癌、肺腺癌、大细胞癌。与肺腺癌不同的是,肺鳞癌的发病与吸烟密切相关,多为中央型,容易累及大血管,出现中心空泡和大出血,危及生命。且现有化疗效果较差,治疗方案有限,预后不良[1]。因此迫切需要探索新的、更加有效的抗肺鳞癌药物以及治疗方案。
还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotnamide adenine dinucleotide phosphate oxidase,NOX)是一种广泛分布于机体内各个组织的跨膜蛋白,包括NOX1,NOX2,NOX3,NOX4,NOX5,以及Duox1和Duox2等7个亚型[2]。其中NOX4与癌症的发生发展密切相关,抑制NOX4活性能够抑制肿瘤的生长并促进癌细胞的死亡[3]。此外,有研究发现,在肺腺癌及肺鳞癌中,NOX4在癌组织中的表达量显著高于癌周组织[4]。除此之外,目前已证实在A549细胞中,NOX4过表达能提高白细胞介素‑6(interleukin‑6,IL‑6)的自分泌水平。IL‑6是促进NSCLC恶性进展最重要的炎症因子之一,可由多种炎性细胞产生并分泌,肿瘤细胞自身也可产生大量IL‑6[5‑6]。体内外实验表明,IL‑6促进NSCLC细胞增殖的原因,可能与肿瘤细胞中激活Jak2/Stat3信号通路有关[7‑9]。上述提示NOX4可能是抗NSCLC的一个潜在有效靶点。
GKT137831是NADPH氧化酶NOX4和NOX1亚型的双重抑制剂。其在体外和体内动物药理模型中显示出生物学活性,包括治疗肝纤维化、动脉粥样硬化等[10‑11]。在肺腺癌A549细胞中,GKT137831能够增强顺铂对细胞的毒性效应[12]。因此,GKT137831对于肺鳞癌的治疗值得进一步探讨。
本研究以肺鳞癌H226细胞为实验对象,检测GKT137831和紫杉醇单用以及二者联用对细胞生存的影响,检测GKT137831对肺鳞癌H226细胞凋亡的影响,检测GKT137831对肺鳞癌H226细胞中IL‑6 mRNA表达的影响,并初步探讨GKT137831是否通过IL‑6/Jak2/Stat3信号通路诱导肺鳞癌H226细胞凋亡,有望为GKT137831的临床抗肺鳞癌应用提供实验依据。
1 材料
1.1 药物与试剂
GKT137831、紫杉醇均购于美国Selleck公司。细胞培养试剂购于美国Gibco公司。Annexin V‑FITC/PI细胞凋亡检测试剂盒购于贝博生物科技公司。BCA蛋白定量试剂盒购于Thermo Scientific公司。SDS‑PAGE蛋白上样缓冲液购于Mikx公司。p‑Jak2、Jak2、p‑Stat3、Stat3、Bcl‑2、Bax及β‑Tubulin抗体购于美国Abcam公司。山羊抗兔IgG购于Cell Signaling Technology公司。RNA快速提取试剂盒(RN001)购于上海奕杉生物科技公司。Rever Tra Ace recerse transcriotase和SYBR Green Realtime PCR Master Mix均购于TOYOBO。
1.2 主要仪器
HF151UV型CO2培养箱购于上海力申科学仪器有限公司。A35062CN流式细胞仪、1510酶标仪购于Thermo Scientific公司。Microfugu20R冷冻离心机购于Beckman coulter公司。3300029‑7Q化学发光成像系统购于上海勤翔科学仪器有限公司。
2 方法
2.1 细胞培养
将肺鳞癌H226细胞于液氮罐中取出,37℃水浴融化,用1 mL移液枪快速将细胞吸到提前准备好的15 mL的离心管中,然后于低温离心机中1 000 r/min离心2 min,去除培养基。同时于离心管中加入4 mL新鲜培养基,用移液枪吹打培养基,使H226细胞均匀分布,转入25 mL培养瓶中,放置于37℃5%(φ)CO2培养箱中。24 h后,在同一时间点更换新鲜培养液。待细胞铺满培养皿80%~90%以上时,进行传代。
2.2 MTT法检测细胞存活率
采用MTT法检测GKT137831对肺鳞癌细胞生存的影响。将H226细胞消化并计数,以每孔4 000个细胞接种于96孔板中。待细胞贴壁后,用GKT137831(0、5.0、10.0、20.0μmol/L)分别处理肺鳞癌H226细胞24 h、48 h和72 h、用紫杉醇(0、5.0、10.0、20.0、40.0μmol/L)处理H226细胞48 h,并选取合适浓度的紫杉醇与GKT137831联用处理48 h。药物干预结束后,加入浓度为0.5 mg/mL的MTT,每孔加20μL并在37℃下避光孵育4 h。最后,吸去96孔板中液体,每孔加入二甲基亚砜150μL,并用酶标仪在570 nm处测量每个孔的吸光度(A)值。细胞存活率=(实验组A值−对照组A值)/对照组A值×100%。
2.3 Annexin V‑FITC/PI法检测细胞凋亡
用细胞凋亡Annexin V‑FITC和碘化丙啶(PI)双染测定试剂盒染色,并通过流式细胞仪检测细胞凋亡。将H226细胞接种于60 mm培养皿中,待细胞贴壁后给予不同浓度GKT137831(0、5.0、10.0、20.0μmol/L)处理24 h。药物干预结束后,用不含EDTA胰酶消化并收集细胞。PBS重悬2次后,加入Annexin V结合缓冲液并在避光条件下用5.0μmol/L Annexin V‑FITC孵育15 min,然后加入10.0μmol/L碘化丙啶(PI)避光孵育5 min。用流式细胞仪进行分析。
2.4 Real‑time qPCR法检测IL‑6 mRNA的表达
采用Real‑time qPCR法检测IL‑6 mRNA的表达。将肺鳞癌H226细胞消化并接种于小皿中,待细胞贴壁后用不同浓度GKT137831(0、5.0、10.0、20.0μmol/L)处理12 h。药物干预结束后,使用试剂盒从细胞中提取总RNA,然后根据说明书要求,使用Rever Tra Ace逆转录酶合成互补DNA(cDNA)。按照SYBRGreen实时PCR预混液在iCycler(Bio‑Rad)上进行RT‑PCR。引物序列如下:IL‑6上游引物:5’‑GGTGTTGCCTGCCTTCC‑3’;IL‑6下 游 引 物:GTTCTGAAGAGGTGAGTGGCTGTC‑3’;GAPDH上 游 引 物:5’‑GGCACCGTCAAGGCTGAGAAC‑3’;GAPDH下游引物:5’‑CATGGTGGTGAAGAC‑GCCAGTG‑3’。
使用2−ΔΔCt方法计算每次扩增的基因表达水平,并对GAPDH的mRNA进行标准化。
2.5 Western blot法检测蛋白表达
用Western blot法检测肺鳞癌H226细胞中p‑Jak2、Jak2、p‑Stat3、Stat3、Bcl‑2、Bax蛋白的表达水平。将肺鳞癌H226细胞接种于小皿中,待细胞贴壁后用不同浓度GKT137831(0、5.0、10.0、20.0μmol/L)处理12 h。药物干预结束后加入细胞裂解缓冲液与0.5%蛋白酶抑制剂混合物获得全细胞提取物。经过电泳、电转及封闭的过程后,分别在4℃下孵育抗体过夜,二抗孵育1 h,显色。
2.6 统计学方法
实验所得数据计量资料以均数±标准差(±s)表示,应用GraphPad Prism 7.01软件,采用Student’s test检验,P<0.05为差异有统计学意义。
3 结果
3.1 GKT137831对肺鳞癌H226细胞存活率的影响
MTT实验结果显示,GKT137831(0、5.0、10.0、20.0μmol/L)给药干预肺鳞癌H226细胞24 h、48 h和72 h后可呈时间和剂量依赖性抑制肺鳞癌H226细胞的存活,见图1。

图1 GKT137831对肺鳞癌H226细胞存活率的影响Figure 1 Effect of GKT137831 on the survival of lung squa‑mous cell carcinoma H226 cells
3.2 GKT137831对肺鳞癌H226细胞凋亡的影响
采用Annexin V‑FITC/PI法检测细胞凋亡,结果显示,GKT137831(0、5.0、10.0、20.0μmol/L)给药干预24 h后呈剂量依赖性诱导H226细胞凋亡(见图2A)。Western blot实验结果显示,GKT137831呈剂量依赖性减少抗凋亡蛋白Bcl‑2的表达量及增加促凋亡蛋白Bax的表达量(见图2B和图2C)。

图2 GKT137831对肺鳞癌H226细胞凋亡及相关凋亡蛋白的影响Figure 2 Effect of GKT137831 on apoptosis and apoptosis related proteins of lung squamous cell carcinoma H226 cells(n=3)
3.3 GKT137831对肺鳞癌H226细胞中IL‑6 mRNA表达的影响
Real‑time qPCR实验结果显示,GKT137831(0、5.0、10.0、20.0μmol/L)给药干预12 h后呈剂量依赖性降低肺鳞癌H226细胞中IL‑6 mRNA的表达水平(P<0.05),见图3。

图3 GKT137831对肺鳞癌H226细胞中IL‑6 mRNA表达的影响Figure 3 Effect of GKT137831 on the expression of IL‑6 mRNA in lung squamous cell carcinoma H226 cells
3.4 GKT137831对肺鳞癌H226细胞Jak2/Stat3通路的影响
Western blot实验结 果显示,GKT137831(0、5.0、10.0、20.0μmol/L)给药干预12 h后呈剂量依赖性减少肺鳞癌H226细胞中磷酸化Jak2、磷酸化Stat3,见图4A~图4C。

图4 不同浓度GKT137831对肺鳞癌H226细胞中Jak2/Stat3通路蛋白表达的影响Figure 4 Effect of GKT137831 on the expression of JAK2/STAT3 pathway protein in lung squamous cell carcinoma H226 cells(n=3)
3.5 GKT137831对紫杉醇的增敏作用
MTT实验结果显示,用不同浓度紫杉醇(0、5.0、10.0、20.0、40.0μmol/L)给药干预48 h后,紫杉醇可呈剂量依赖性抑制肺鳞癌H226细胞的存活率(见图5A)。此外,本研究选取10.0μmol/L GKT137831和20.0 μmol/L紫杉醇作为联合用药的浓度,结果表明,与单独用药组相比,联合用药组更显著抑制肺鳞癌H226细胞的存活(P<0.05),见图5B。
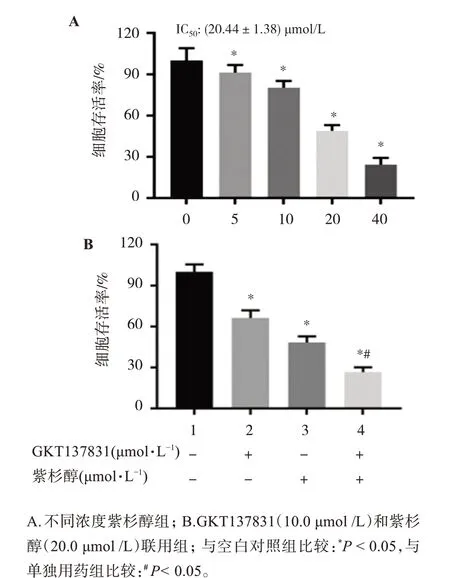
图5 GKT137831对紫杉醇的增敏作用Figure 5 Sensitization of GKT137831 to paclitaxel
4 讨论
既往研究表明,NOX与癌症的发生发展密切相关,抑制NOX的活性能够抑制肿瘤生长并促进癌细胞的死亡[3]。此外,研究证实NOX4在NSCLC中高表达,且在不同层次上证实其可通过激活ROS/PI3K/Akt信号通路促进NSCLC增殖[13]。而在NSCLC中,肺鳞癌目前现有化疗效果较差,治疗方案有限,预后不良。故急需要探索新的更加有效的抗肺鳞癌药物以及治疗方案。本研究发现GKT137831可呈时间和剂量依赖性抑制肺鳞癌H226细胞的存活,并且可呈剂量依赖性诱导肺鳞癌H226细胞凋亡,同时减少抗凋亡蛋白Bcl‑2的表达量及增加促凋亡蛋白Bax的表达量。
目前已证实在肺腺癌A549细胞中,NOX4过表达能提高IL‑6自分泌水平[6]。但目前尚未有研究报道肺鳞癌细胞中NOX4抑制剂GKT137831是否能够影响IL‑6的表达。本研究发现,GKT137831可呈剂量依赖性降低IL‑6 mRNA的表达水平。体内外实验表明IL‑6可促进NSCLC细胞增殖,这一效应主要通过激活Jak2/Stat3信号通路而产生[7,9]。Jak2/Stat3信号通路是近年来发现的一条与细胞增殖、肿瘤发生发展密切相关的信号通路。通过阻断Jak/Stat3信号通路的传导能够诱导癌细胞凋亡[14]。本研究结果显示,GKT137831可呈剂量依赖性减少磷酸化Jak2、磷酸化Stat3。因此GKT137831可能通过降低IL‑6的表达从而抑制Jak2/Stat3信号通路来诱导肺鳞癌细胞凋亡。
紫杉醇是晚期肺癌治疗的常用化疗药物,但众多患者对紫杉醇的敏感性不高[15],联合用药是目前解决病人对紫杉醇敏感性下降的主要手段之一[16]。本研究结果表明,与单独用药组相比,GKT137831与紫杉醇联合使用,对肺鳞癌H226细胞存活的抑制显著增强,故GKT137831能增强紫杉醇的敏感性。但GKT137831增强紫杉醇敏感性的机制仍需进一步深入研究。
综上所述,NOX4抑制剂GKT137831能诱导肺鳞癌细胞凋亡并增强紫杉醇的敏感性,且其诱导肺鳞癌H226细胞凋亡可能与抑制IL‑6/Jak2/Stat3信号通路有关。本研究结果提示,GKT137831可能在肺鳞癌的治疗中发挥重要作用,为临床抗肺鳞癌提供了依据。
