10‑羟基‑α‑癸烯酸对氧化应激损伤血管内皮细胞的保护作用
2021-07-29黄琼马心超袁义强
黄琼,马心超,袁义强
(河南省胸科医院,河南郑州 450000)
近年来,心血管疾病发病呈年轻化趋势,已经严重危害人类的健康,不但给患者带来经济负担,还给人类的健康带来了巨大的威胁[1]。国家心血管病中心组织编撰的《中国心血管病报告2018》统计我国心脑血管病现患人数2.9亿,其中脑卒中1 300万,冠心病1 100万,肺源性心脏病500万,心力衰竭450万,风湿性心脏病250万,先天性心脏病200万,高血压2.7亿[2]。动脉粥样硬化和高血压等多种心血管疾病的发生是因为血管内皮细胞的损伤导致的,而氧化应激和细胞凋亡可直接造成内皮细胞损伤现象的出现,也就是说氧化应激和细胞凋亡会直接导致多种心血管疾病的发生[3]。10‑羟基‑α‑癸烯酸(10‑hydroxy‑2‑decenoic acid,10‑HDA)是一种在蜂王浆中发现的一种独特的脂肪酸,由于其他蜂产品不含10‑HDA,所以其存在可以作为区分蜂王浆与其他蜂产品的一个指标。10‑HDA具有抗肿瘤、促进胶原蛋白、免疫调节、抗菌和抗炭疽等多种生理活性[4]。有研究报道指出,10‑HDA在人结肠癌细胞中具有杀菌和抗炎活性;同时10‑HDA还具有治疗类风湿关节炎的潜力,能够通过下调PI3K‑AKT通路来抑制类风湿性滑膜细胞增殖[5]。同时10‑HAD因其独特的分子结构,具有抗氧化活性,清除机体中多余的氧化自由基的功效[6]。本研究在建立体外内皮细胞过氧化氢(H2O2)损伤的基础上,探讨10‑HAD对氧化所致的血管内皮细胞损伤的影响,并进一步探讨其作用机制。
1 材料与方法
1.1 细胞
人脐静脉血管内皮细胞株EVC304购自中国科学院细胞研究所。
1.2 药品与试剂
10‑HDA(CAS:14113‑05‑4,货号:YS014080)购自湖北广奥生物科技有限公司;H2O2溶液(30%,货号:216763)和BCA蛋白浓度测定试剂盒(货号:AR0146)购自上海钰博生物科技有限公司;FBS胎牛血清、DMEM高糖培养基、胰蛋白酶和青/链霉素(P/S)购自北京泰新生物科技有限公司;实验所用一抗抗体均购自上海爱必信生物科技有限公司;HRP辣根过氧化物酶标记的IG二抗购自中国北京中杉金桥生物技术有限公司;CCK‑8试剂盒(货号:LHK900)购自上海宇淳生物科技有限公司;细胞凋亡试剂盒(货号:556547)、一氧化氮(NO)试剂盒(货号:584159)、丙二醛(MDA)试剂盒(货号:358418)、超氧化物歧化酶(SOD)试剂盒(货号:574158)和ECL发光液(货号:325874)购自南京森贝伽生物科技有限公司。
1.3 细胞系与细胞培养
将含10%FBS,1%P/S的DMEM培养液加入EVC‑304细胞,并将培养皿置于37℃、5%CO2饱和湿度的细胞培养箱中。待细胞满度为70%~80%左右,利用胰蛋白酶消化离心后传代。
1.4 实验分组及H2O2损伤模型的建立
取对数生长期的EVC‑304细胞经消化制成细胞悬液,以1×105个/孔接种于96孔板中,随机分为空白对照组(不作任何处理)、H2O2模型组(100 μmol/L H2O2)和10‑HAD低、中、高剂量组(10、30、50 μmol/L),各组培养条件保持完全一致,模型组H2O2浓度为100μmol/L作为造模浓度,10‑HAD低、中、高剂量组分别用10‑HDA 10、30、50μmol/L+H2O2100μmol/L。
1.5 CCK‑8实验检测细胞增殖抑制率
按照“1.4”的方法建立H2O2损伤模型并加药处理24 h后,将10μL CCK‑8试剂加入孔中并在37℃下孵育1.5 h。随后,通过酶标仪在490 nm处测量吸光度(A),并计算细胞存活率。增殖抑制率={1−(实验组A空白调零组A/对照组A−空白调零组A)}×100%。
1.6 流式细胞术检测10‑HAD对内皮细胞活性氧(ROS)的影响
按照“1.4”的方法建立H2O2损伤模型并加药处理24 h后,将细胞收集到Tube管中,离心并弃去上清,加PBS重悬并洗涤1次,随后加入5μL的DCFH‑DA,随后置于37℃条件下避光孵育30 min,离心重悬,流式细胞仪检测细胞内ROS水平。
1.7 ELISA法测定细胞中NO、MDA的含量和SOD的活性
前期处理同“1.4”,模型建立后药物处理1 d,随后用PBS洗涤2次,分别将各组细胞裂解液收集,高速离心,保留离心后的上清液,按照试剂盒说明书,分别检测相同体积细胞上清液中NO、MDA的含量和SOD的活性。
1.8 流式细胞术检测10‑HAD对内皮细胞凋亡的影响
按照“1.4”的方法建立H2O2损伤模型并加药处理不同时间(3、6、12、24 h)后,用胰酶消化,离心,收集细胞并进行Annexin V‑FITC和PI染色,染色方法参照试剂盒,最后于流式细胞仪上检测分析。
1.9 Western blot检测蛋白变化情况
前期处理同“1.4”,到处理时间后,收集各组EVC‑304细胞,以PBS洗2次,用PIPA细胞裂解液置冰浴裂解,4℃离心机中以12 000 r/min离心30 min,收集上清。利用BCA试剂盒定量,沸水浴变性5 min,SDS‑PAGE分离目标蛋白,上样量为20μL。转至PVDF膜上,TBST漂洗后,5%脱脂奶粉封闭液封闭2 h,孵一抗抗过夜,TBST漂洗5次(每次5 min),加入二抗摇床孵育1 h,TBST漂洗5次(每次5 min),用ECL显影液显色,最后显影拍照,并用Image J软件对图片进行分析。
1.1 0统计学分析
采用SPSS19.0软件进行统计分析,计量资料数据以x±s表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 10‑HAD对H2O2诱导的血管内皮损伤细胞活力的影响
结果如表1所示,在24 h,与空白对照组相比,模型组细胞增殖率显著下降(P<0.01),说明实验造模成功;与模型组相比,10‑HAD组细胞增殖率均显著提高,差异有统计学意义(P<0.01),且10‑HDA浓度越高,效果越显著,呈剂量依赖性,高浓度的10‑HDA(50μmol/L)促进细胞增殖作用最显著(P<0.01)。

表1 10‑HAD对H2O2诱导的血管内皮损伤细胞活力的影响Table 1 Effect of 10‑HDA on the viability of vascular endo‑thelial cells injured by H2O2
2.2 10‑HAD对H2O2损伤的EVC‑304细胞中ROS水平的影响
如图1所示,流式细胞术检测结果示,与对照组比较,模型组细胞的平均荧光强度显著升高,差异有统计学意义(P<0.01),表明H2O2可诱导胞内ROS升高;与模型组比较,10‑HAD组细胞的平均荧光强度显著下降,差异有统计学意义(P<0.01),表明10‑HAD能减少H2O2诱导胞内ROS的生成。

图1 10‑HAD对H2O2损伤的EVC‑304细胞中ROS水平的影响Figure 1 Effect of 10‑HDA on the apoptosis of EVC‑304 cells induced by H2O2
2.3 10‑HAD对H2O2损伤的EVC‑304细胞上清液中NO、MDA的含量和SOD活性的影响
结果如表2所示,与空白对照组相比,模型组中EVC‑304细胞上清液中NO、SOD活性明显下降,而MDA的含量大幅度升高,差异有统计学意义(P<0.01);与模型组比较,10‑HAD组能提高细胞上清液中的NO含量和SOD活性,下调MDA活性,差异有统计学意义(P<0.01)。
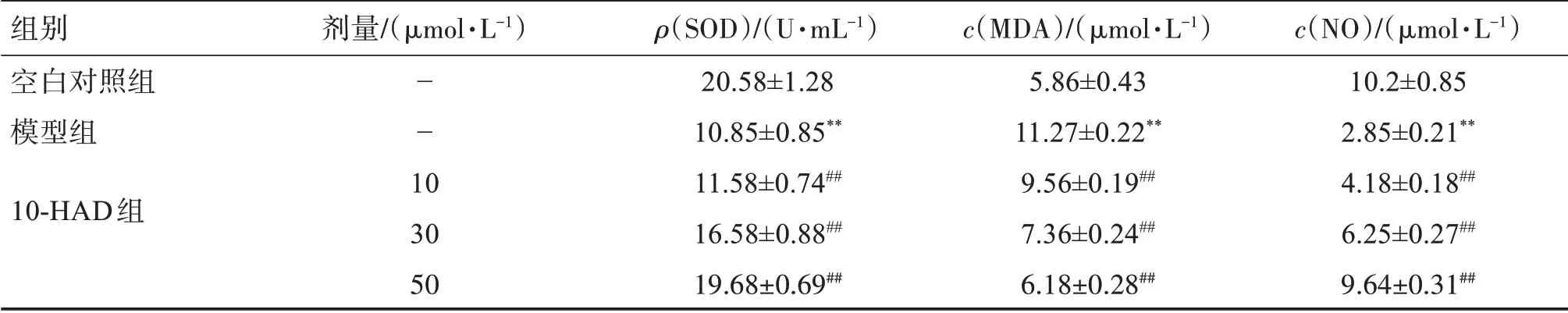
表2 10‑HAD对H2O2损伤的EVC‑304细胞上清液中NO、MDA的含量和SOD活性的影响Table 2 Effect of 10‑HDA on the content of NO,MDA and the activity of SOD in the supernatant of EVC‑304 cells injured by H2O2(x±s)
2.4 10‑HAD对H2O2损伤后血管内皮细胞凋亡率的影响
如图2所示,与空白对照组相比,模型组中血管内皮细胞凋亡率显著增加,差异有统计学意义(P<0.01)。在10‑HAD处理组中,随着10‑HAD处理浓度的增加,H2O2损伤后内皮细胞凋亡率呈现浓度依赖性的降低,与模型组相比,差异有统计学意义(P<0.01)。说明10‑HAD能够抑制H2O2诱导的血管内皮细胞凋亡。并进一步检测了细胞中凋亡相关蛋白的表达量变化情况,Bax的表达量和Bax/Bcl‑2的比值显著降低,Bcl‑2的表达量显著升高,且10‑HAD浓度越高,效果越明显,呈剂量依赖性,10‑HAD组与模型组相比,cleaved Caspase‑3的表达含量显著降低,差异有统计学意义(P<0.01)。

图2 10‑HAD对H2O2损伤后血管内皮细胞凋亡的影响Figure 2 Effect of 10‑HDA on the apoptosis of EVC‑304 cells injured by H2O2
2.5 10‑HAD对Nrf2、HO‑1信号通路蛋白表达的影响
如图3所示,对照组中Nrf2、HO‑1蛋白呈少量表达,模型组Nrf2和HO‑1蛋白表达与对照组比较差异有统计学意义(P<0.01)。10‑HAD组明显上调Nrf2、HO‑1蛋白表达,与模型组比较差异具有统计学意义。
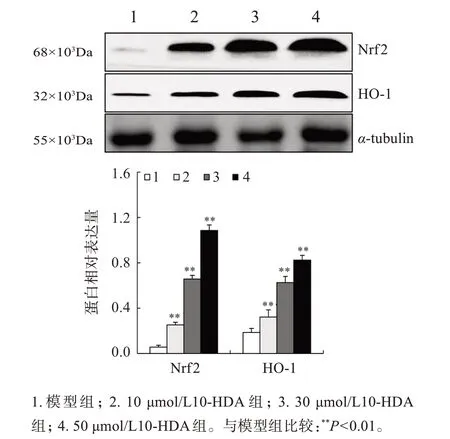
图3 10‑HAD上调H2O2损伤后血管内皮细胞Nrf2/HO‑1信号通路蛋白的表达Figure 3 Effect of 10‑HDA on the expression of Nrf2/HO‑1 signaling pathway proteins in vascular endothelial cells after H2O2 injury
3 讨论
完整的血管内皮系统是心血管系统维持稳态的基石,血管内皮细胞的紧密结合保证了血管壁通透性完整,同时也使血管舒张和收缩处在一个平衡状态,参与各组织器官营养物质供应与废物清理等多项生理进程,内皮细胞损伤与功能失常可导致多种疾病的发生。氧化应激是最常见的内皮损伤因素,降低氧化应激反应能够很大程度上降低细胞损伤程度,而近年来的研究都证实天然来源的物质可以在降低氧化应激损伤过程中起到较强的作用,被公认为是血管内皮细胞氧化应激损伤的可靠研究方向[7‑8]。
本研究利用100μmol/LH2O2损伤EVC‑304细胞构建氧化应激损伤模型进行研究。SOD和MDA是氧化应激反应的直接表现因素,MDA是脂质过氧化物,其过量会对细胞产生损伤作用;SOD是体内清除自由基的抗氧化酶,不但能够将自由基消解还抑制脂质过氧化反应;NO是由内皮细胞的线粒体产生的“信使分子”,改善机体的代谢,在维持内皮细胞稳态以及免受伤害方面作用很大。CCK‑8实验结果和ELISA实验结果表明,H2O2引起的氧化应激损伤使EVC‑304细胞的存活率显著降低,ROS水平升高,NO、SOD活性明显下降,而MDA的含量大幅度升高。在加入10‑HAD之后可显著提高H2O2损伤的EVC‑304细胞的存活率,降低细胞ROS和MDA水平,提高细胞上清液中的NO含量和SOD活性,表明10‑HDA可以减轻EVC304的氧化应激损伤,增强细胞的抗氧化能力。
细胞凋亡是指细胞由基因调控的细胞死亡,是维持机体内环境稳定的重要生理进程,与这一进程关系最为密切的包括Bcl‑2、Caspase两大家族[9]。通过Annexin V‑FITC配合PI进行双染,并利用流式细胞仪检测细胞凋亡情况,反映细胞凋亡的进程。本实验发现,H2O2损伤EVC‑304细胞后,细胞早期凋亡和晚期凋亡数目均大幅增大。而10‑HAD组中凋亡细胞随着10‑HDA处理浓度的升高而减少,说明10‑HDA具有明显抵抗H2O2诱导的细胞凋亡作用。在蛋白分子水平的检测中,10‑HDA能够抑制H2O2诱导的Caspase‑3蛋白的活化,增加抗凋亡蛋白Bcl‑2的表达,降低Bax和Bax/Bcl‑2的比值,表明10‑HDA抑制H2O2引起的线粒体途径细胞凋亡。
Nrf2/ARE是机体内重要的内源性抗氧化应激通路,Nrf2即核因子E2相关因子2,是氧化应激基本表达的关键转录因子;ARE是抗氧化反应元件,是一个特异的DNA‑启动子结合序列,当机体氧化应激反应发生后,Nrf2受到多种蛋白的调控转移到细胞核中,与ARE结合后直接调控HO‑1启动转录,从而发挥抗氧化作用[10‑11]。本实验对这两条信号通路进行了检测,从实验结果中可以看出,与模型组相比,10‑HAD组Nrf2/ARE抗氧化信号通路中关键分子Nrf2及HO‑1表达增多,因此推测10‑HDA能够调节Nrf2/ARE信号通路来发挥抗氧化效应。
本实验证明了10‑HAD可以提高损伤的血管内皮细胞的增殖率,增加细胞内抗氧化酶的活性,抑制细胞凋亡,并激活Nrf2/ARE抗氧化信号通路。为研究10‑HAD在保护心血管疾病中的应用提供了一定的实验基础。
