粗多糖检测结果异常问题的探究
2021-07-29张宗煜
张宗煜
(1. 天津市工业微生物研究所有限公司 天津 300462;2. 天津实发中科百奥工业生物技术有限公司 天津 300462;3. 天津市工业微生物工程技术中心 天津 300462;4. 天津市工业微生物企业重点实验室 天津 300462;5. 天津量信检验认证技术有限公司 天津 300462)
1 反应历程的探究
1.1 异常情况的发现
在实验室中,测定粗多糖含量采用的是NY/T 1676—2008的苯酚-硫酸法。该方法的原理:多糖在浓硫酸作用下,先水解成单糖,并迅速脱水生成糖醛(糠醛)衍生物,与苯酚反应生成橙黄色溶液,在490 nm处有特征吸收,与标准系列比较定量[1]。在实际工作中,偶尔出现过一些异常情况,如:同一个样品测定的2个结果不平行,标准曲线的R2偏低等。分析了这些问题产生的可能原因,为了验证这些想法是否正确,并探究这个反应的历程,设计了一些试验。
1.2 试验药品与仪器
试验药品:葡萄糖(分析纯),天津市江天化工技术有限公司;苯酚(分析纯),东方化工厂;浓硫酸(分析纯),利安隆博华(天津)医药化学有限公司;蒸馏水,自制。
试验仪器:U-3010紫外可见分光光度计,日本日立公司。
1.3 试验部分
将葡萄糖用蒸馏水配制成0.1 g/L水溶液、苯酚用蒸馏水配制成5%水溶液,加入的各种物料的体积:1 mL 0.1 g/L葡萄糖水溶液,1 mL 5%苯酚水溶液,5 mL浓硫酸,比色以蒸馏水为空白。表1中试验序号1~4均是加完前2种物质并混匀后,放置24 h再加入第3种物质,其余试验则是加完前两种物质并混匀后,立刻加入第3种物质。所有物质都加完后静置10 min,使用涡旋震荡器使反应液充分混合,然后“室温”反应20 min,490 nm测吸光度(表1)。
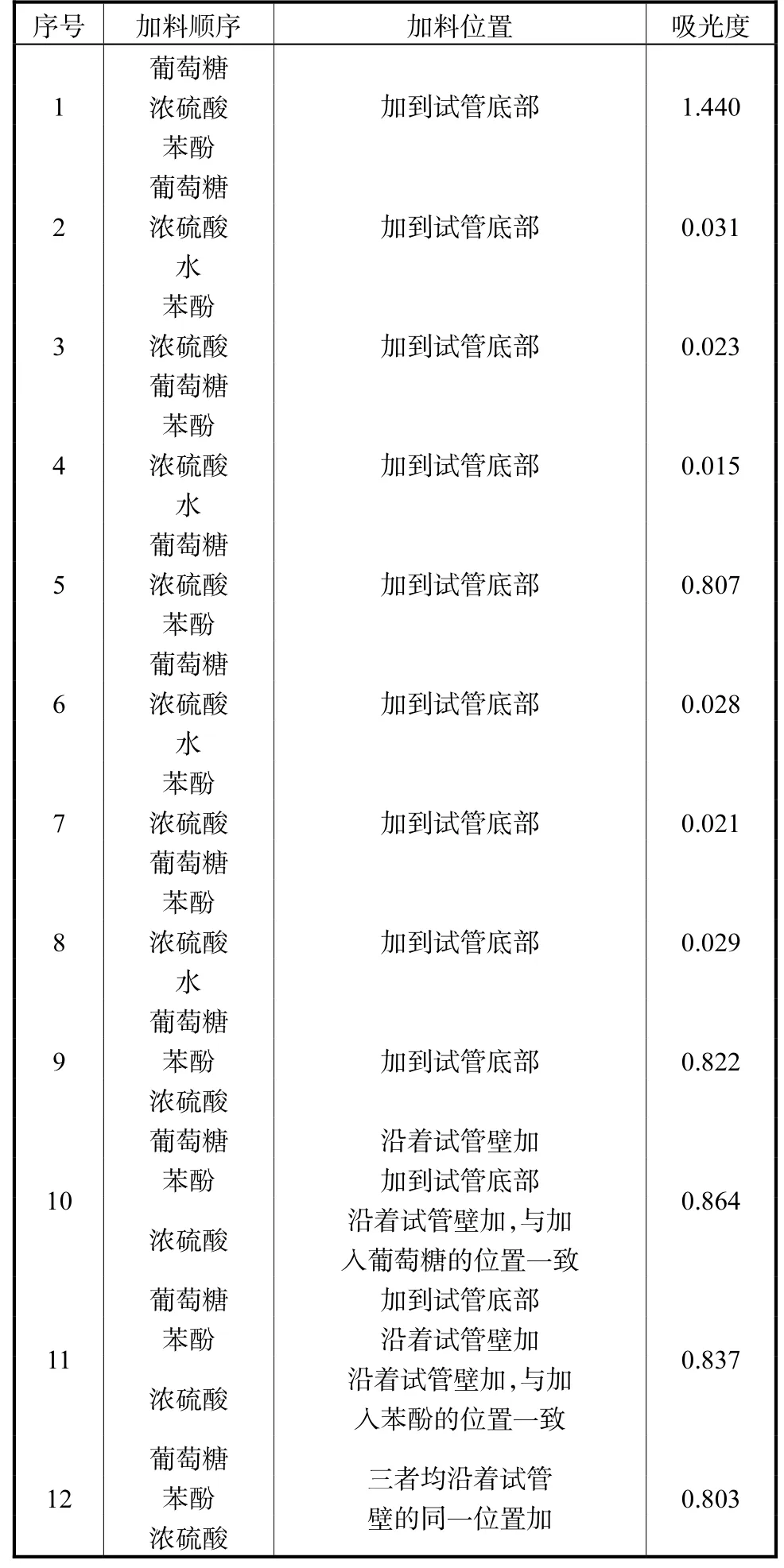
表1 反应历程探究试验结果Tab.1 Test results of reaction process
1.4 试验结果分析
根据试验1~8,可以分析出该反应可能的历程(图1):葡萄糖在浓硫酸作用下脱水,生成5-羟甲基糠醛,该过程比较缓慢,5-羟甲基糠醛再与苯酚反应,其产物在490 nm处有吸收。
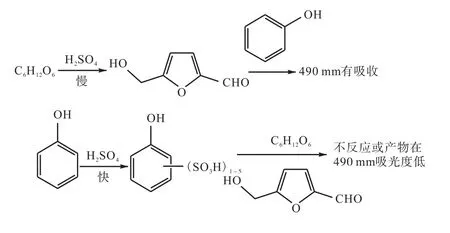
图1 葡萄糖与浓硫酸、苯酚的可能反应历程Fig.1 Possible reaction process of glucose with concentrated sulfuric acid and phenol
可能发生的副反应:苯酚与浓硫酸发生磺化反应,该反应很快。其产物或者是不与葡萄糖及5-羟甲基糠醛反应,或者是与葡萄糖或5-羟甲基糠醛中的1种或2种物质有反应,但其产物在490 nm处吸光度较低。
根据文献报道[2],苯酚类化合物与浓硫酸的摩尔比在1∶1.1时,苯酚类化合物在25℃即可被硫酸磺化,标准NY/T 1676—2008中,苯酚与浓硫酸的摩尔比大约是1∶173,且浓硫酸加入到苯酚水溶液的一瞬间,温度远高于25℃,因此苯酚水溶液与浓硫酸混合后,溶液中的苯酚会有一部分甚至全部被磺化,而且由于浓硫酸比例过高,甚至可能苯环上会有多个磺酸基(实际可能是苯环上磺酸基数量不同,取代位置不同的多种化合物的混合物)。当苯酚被磺化后,反应活性降低[3],且磺酸基越多,活性越低。因此苯酚磺酸与葡萄糖和5-羟甲基糠醛可能几乎不发生反应。即使由于温度较高,使苯酚磺酸与葡萄糖或5-羟甲基糠醛发生了反应,由于磺酸基团中的硫氧双键(O=S=O)与苯环共轭,也会导致产物的最大吸收波长向长波方向移动,因而在490 nm处吸收较低或几乎没有吸收。
有文献报道磺酸基是非典型生色团[4-5]。化合物中有磺酸基对最大吸收波长的影响在文献中也有报道[6]:对苯二酚(1,4-苯二酚,CAS:123-31-9)在289 nm处有最大吸收,羟苯磺酸(2,5-二羟基苯磺酸,CAS:88-46-0)在301 nm处有最大吸收(见图2)。

图2 对苯二酚、羟苯磺酸的最大吸收Fig.2 Maximum absorption of hydroquinone and dobesilic acid
根据试验10~12可以得到的结论:在检测过程中,标准品溶液或样品溶液、苯酚溶液、浓硫酸如有少量溅到试管壁上,对比色结果几乎无影响。在试验5和9~12中造成吸光度微小差别的原因,一是仪器的误差,二是在移取浓硫酸时,由于浓硫酸密度和黏度均较大,导致加入到反应体系中的浓硫酸不是5 mL,而是略有偏差,使得反应体系的体积不完全一致,产物的浓度因此不完全一致。
2 异常情况原因探析
2.1 模拟试验
为了模拟实验室检测样品较多,苯酚、浓硫酸不能及时加入,以及不能及时比色等情况,并参考标准QB/T 5176—2017[7]、GB/T 18672—2014[8]的反应条件,设计了4个试验,比色均以蒸馏水为空白。
①向试管中加入1 mL 0.1 g/L葡萄糖水溶液、1 mL 5%苯酚、5 mL浓硫酸,静置10 min,使用涡旋震荡器使反应液充分混合,然后“室温”反应20 min,于490 nm处测吸光度=0.758。
②向试管中加入1 mL 0.1 g/L葡萄糖水溶液,1 h后加入1 mL 5%苯酚,1 h后加入5 mL浓硫酸,静置10 min,使用涡旋震荡器使反应液充分混合,然后“室温”反应1 h,于490 nm处测吸光度=0.826。
③向试管中加入1 mL 0.1 g/L葡萄糖水溶液、1 mL 5%苯酚、5 mL浓硫酸,静置5 min,沸水浴加热15 min,冷却至室温,于490 nm处测吸光度=0.678。
④向试管中加入1 mL 0.1 g/L葡萄糖水溶液,1 h后加入1 mL 5%苯酚,1 h后加入5 mL浓硫酸,静置1 h,沸水浴加热15 min,冷却至室温,1 h后,于490 nm处测吸光度=0.739。
2.2 讨论分析
通过以上4个试验的结果可以看出,在反应温度相同的情况下,随着反应时间的延长,吸光度在升高。在加入1 mL 0.1 g/L葡萄糖溶液、1 mL 5%苯酚溶液、5 mL浓硫酸后,迅速检测反应体系的温度,大约是113℃,因此沸水浴(100℃)相当于给反应体系降温,这也就解释了相同反应时间,“室温”反应的吸光度大于沸水浴反应的吸光度这个现象。
实验室被检测的样品一般是经过复杂的生物反应得到的,其中的多糖在浓硫酸作用下水解后可能会产生多种戊糖或己糖,根据文献,己糖、己糖醛酸及其衍生物和苯酚、浓硫酸反应的产物在490 nm有吸收,戊糖及其衍生物和苯酚、浓硫酸反应的产物在475 nm有吸收[9](图3)。因实验室没有戊糖及其衍生物的标准品,就未进行相关反应及475 nm比色研究。
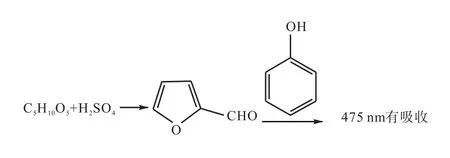
图3 戊糖与浓硫酸、苯酚的反应Fig. 3 Reaction of pentose with concentrated sulfuric acid and phenol
在检测过程中,当样品量较多时,会出现苯酚、浓硫酸不能及时加入,以及不能及时比色等情况。在用少量待测液体置换比色皿中原有液体时,偶尔会有待测液体流到比色皿外壁,因其中有硫酸,将比色皿外壁彻底擦干净也比较耗时。在这个过程中,未检测的样品中仍然在发生反应。另外,标准NY/T 1676—2008中多糖的提取是在沸水条件下,也有文献说,某些糖在煮沸情况下会发生分解[10]。这些都能解释偶尔出现的同一个样品测定的2个结果不平行,标准曲线R2偏低等现象。
对于产生上述现象的原因,我们也进行了分析。因为该反应有3步:多糖在浓硫酸条件下水解成己糖;己糖在浓硫酸条件下脱水生成5-羟甲基糠醛;5-羟甲基糠醛在浓硫酸条件下和苯酚反应。
对于第一步反应,根据标准NY/T 1676—2008[1]、SN/T 4260—2015[11]、QB/T 5176—2017[1]、GB/T 18672—2014[8]中的描述,算出了硫酸在反应体系中的浓度为60%或70%。根据文献的研究[12],在60%或70%的浓硫酸中,60℃反应条件下糖的收率最高,但反应体系的温度大约为110℃,该文献指出,在100℃时会有副反应,导致糖的收率降低。也有文献研究指出了高温下糖收率降低的原因[13],是小分子糖在强酸性体系中会转化为糠醛及其他副产物,因糠醛是第二步产物,就直接查找了用多糖合成糠醛的文献。
有文献对用农作物秸秆或纤维素(其中含有五碳单糖及六碳单糖缩合而成的多糖)或单糖合成糠醛、5-羟甲基糠醛(统称糠醛衍生物)的反应进行了相关研究[14-22],所报道的很多反应条件都是在高温(120℃甚至更高),或高压,或有催化剂存在的条件下,反应若干小时,还存在着一些副反应。可见随着反应条件的变化,糠醛衍生物的收率及糖发生副反应的比例也在变化。
对于第三步反应,考虑到在浓硫酸存在条件下,戊糖生成的糠醛和己糖生成的5-羟甲基糠醛都有醛基(—CHO),查阅了涉及苯酚和醛基反应的几篇文献,表明苯酚和醛在酸性条件下会形成不溶于水的聚合物[23-25],苯酚和醛在碱性条件下会形成小分子化合物[26-29],均与标准中的现象不一样。而在教材和文献中均未找到苯酚和呋喃反应的条件,于是查找了苯酚与羟甲基(—CH2OH),即醇类反应的文献[30-32],均需要加入固体酸催化剂反应若干小时,而且有时在醇过量的情况下,也不能保证所有的苯酚都能发生反应。鉴于标准中是苯酚过量,而且没有固体酸催化剂,根据文献可以推测,苯酚过量的情况下,同样不能保证所有的5-羟甲基糠醛都发生反应。
在前面提到的用苯酚-硫酸法测定多糖的标准中,反应条件是“室温”(实际体系温度>100℃)放置5 min或10 min,再在30℃常压反应20 min,或在100℃常压反应15 min。由于反应时间比文献短,反应温度比文献低,而且没有加入任何催化剂,在这种反应条件下,肯定没有将所有的多糖都转化为5-羟甲基糠醛,也无法确定有多少多糖发生副反应,同时无法确定与苯酚发生反应的5-羟甲基糠醛有多少。根据前文对反应历程的研究,在苯酚、葡萄糖的混合溶液中加入浓硫酸时,很难确定被磺化的苯酚与脱水生成5-羟甲基糠醛的葡萄糖的比例。当样品过多时,由于样品及标准曲线在高于100℃时(即“室温”放置)的反应时间不一样,在保温反应后比色时,继续反应的时间也不一样,在这种情况下,同一个样品生成的糠醛有可能不平行,不同反应体系中苯酚被磺化的比例可能不一样。这可能是导致最终产品的含量,即检测结果不平行的原因之一。
此外,文献中也提到[12],多糖在浓硫酸中水解成单糖的过程中可能会发生局部碳化。一般在有机合成中要保持良好的搅拌,而在检测多糖的加料过程的瞬间,物料很难做到混合均匀,这就加大了局部碳化的可能性。也偶尔发现在加入浓硫酸的瞬间,溶液中局部颜色明显变深的现象,这可能就是文献中说的局部碳化。遇到这种情况时,会将该样品重新取样,加苯酚、硫酸。当同一个样品的平行样中只有1个发生局部碳化,或者2个局部碳化的程度不一样,而且现象不是很明显时,检测结果不平行就属于“正常现象”了。为了排除平行样前处理操作过程、取样不均等带来的误差,曾经尝试过将定容后的粗多糖待测液取2~3份,分别与苯酚硫酸反应,出现过吸光度差别较大的情况。我们认为这也可以用上述理论解释。造成表1中试验5和9~12中吸光度微小差别的原因,除了本文第一部分提到的操作误差外,也可以用文献中的理论解释。
在绘制标准曲线时,NY/T 1676—2008、SN/T 4260—2015是将不同浓度的1 mL葡萄糖标准溶液,1 mL 5%苯酚、5 mL浓硫酸混合后比色;QB/T 5176—2017、GB/T 18672—2014则是将不同浓度的2 mL葡萄糖标准溶液,1 mL 5%苯酚、5 mL浓硫酸混合后比色。因不同浓度的葡萄糖标准溶液的密度不一样,导致溶液之间的分子间隙、分子间作用力等不同,从而混合后体积可能会有所不同,这也可能是造成标准曲线R2偏低的原因之一。
3 操作中断对样品检测结果的影响
当实验室检测的样品较多时,会出现操作中断的情况。为了验证这种情况对样品检测结果是否有影响,并结合实验室曾经出现的操作中断的阶段,用同一个样品做了3个试验,按照NY/T 1676—2008测定其粗多糖含量:
①前处理当天比色,结果为6.35%;
②前处理当天过滤,第二天定容、反应、比色,结果为5.61%;③前处理第二天过滤、定容、反应、比色,结果为5.38%。
根据以上检测结果可以看出,操作中断会导致检测出的粗多糖含量下降。因此在实际工作中,检测人员应该合理安排时间,以便从样品前处理到比色在一天内完成,这样才能使检测结果更加准确。
4 结论与展望
多糖是由若干个相同或不同种类的单糖缩合而成的,在形成多糖的过程中,由于单糖的种类、个数、连接方式等的区别,导致多糖的种类多至无法计算,如采用液相法或气相法测定粗多糖含量,需要有对应的标准品,因此不可能采用液相法或气相法测定其含量。在介绍糖类化合物性质的书中,既没有找到能让所有类型多糖在短时间内完全水解成单糖的试剂,也没有找到能让所有类型的单糖在短时间内定量转化为某一种化合物的试剂(单糖可以与高碘酸发生定量反应生成醛及酸,但在该反应中,每摩尔单糖消耗高碘酸的摩尔数,及生成醛、酸的摩尔数与单糖的碳数、结构有关[33],同样难于通过滴定等方法确定混合单糖的量)。因此,将多糖水解、衍生后用比色法测定含量时,一旦样品量较多,由于衍生试剂加入不及时、物料混合不均匀、比色不及时等原因,标准曲线及检测结果就可能出现异常,这些原因也有可能导致检测结果不准确。
在本文提到的4个粗多糖检测标准中,样品前处理方式均不相同,见表2。
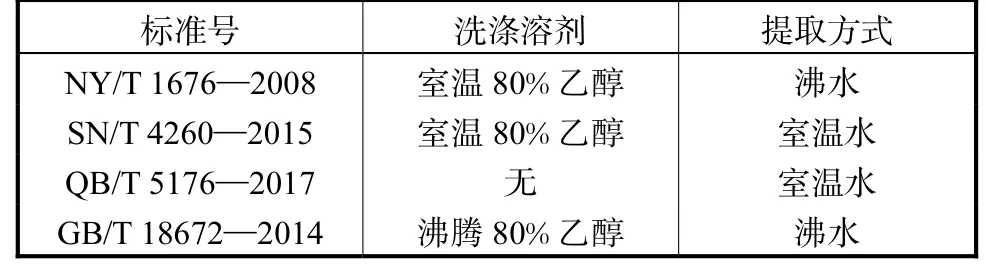
表2 不同标准中的样品前处理方式Tab.2 Sample pretreatment methods in different standards
预尝试不同的前处理方式对于检测结果的影响,通过本文中的试验和查找到的文献,发现其中涉及到的化学反应较复杂,且难以解决,就没有进行相关试验。
如何准确地测定样品中的粗多糖含量,仍然是需要标准制定者和相关领域人员研究的课题。■
