NLRP3 的过度激活与ARDS和损伤性机械通气诱导的肺损伤的关系
2021-07-29王婷婷左祥荣
刘 军 石 颖 王婷婷 左祥荣
南京医科大学第一附属医院重症医学科,江苏南京 210029
急性呼吸窘迫综合征(ARDS)是急性弥漫性损伤导致的急性缺氧性呼吸衰竭。在全世界,每年约有300 万ARDS 患者,占重症监护病房住院人数的10%[1-2],院内死亡率仍然高达46.1%[3]。机械通气是ARDS 的有效治疗手段之一,但它是一把“双刃剑”,可能会导致呼吸机相关性肺损伤(VILI)[4-5]。机械牵张刺激肺泡上皮细胞,激活肺泡巨噬细胞等炎症细胞,释放大量炎性因子,导致失控性“瀑布样”炎症反应[6]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体的是一种由传感器蛋白NLRP3、接头蛋白ASC 和效应蛋白半胱氨酸天冬氨酸酶(Caspase)-1 组成多蛋白复合物,可被病原体相关分子模式或损伤相关分子模式激活,如细菌、病毒和ATP 等[7-9]。NLRP3 过度激活也会导致组织损伤和器官功能障碍[10]。研究表明NLRP3炎症小体在ARDS 或VILI 中发挥了重要作用[11-13]。但既往研究通常使用40 mL/kg 的潮气量诱导肺损伤,远超过临床常用量[6]。在动物模型中,20 mL/kg 是造成肺损伤较为合适的潮气量[14]。本研究拟以潮气量为20 mL/kg 来模拟损伤性机械通气,探讨NLRP3 过度激活是否参与ARDS 和损伤性机械通气诱导的肺损伤。
1 材料与方法
1.1 实验动物及ARDS 模型的制备
清洁级雄性SD 成年大鼠50 只,体重(330±20)g,购于南京医科大学实验动物中心[SCXK(苏)2016-0002]。饲养于南京医科大学动物中心,饲养温度(23±2)℃,湿度(40±5)%,普食饲养,自由饮水。本研究经过南京医科大学动物伦理委员会批准(审批号:IACUC-1905030)。取10 只SD 大鼠按随机数字表法分为生理盐水(NS)组和油酸(OA)组。OA 组颈静脉注入OA(0.1 mL/kg)制备ARDS 模型[15-16],NS 组注入等量生理盐水。2 h 后通过氧合指数,肺损伤评分和肺湿干重比(W/D),确定造模成功。
1.2 实验分组及处置
另取40 只大鼠按随机数字表法分为对照组(n=10)、OA 组(n=30)。大鼠麻醉后行气管切开插管,2 h后开始机械通气,OA 组按通气方式不同分为ARDS组、小潮气量组(Vt=6 mL/kg)、损伤性通气组(Vt=20 mL/kg)。对照组和ARDS 组大鼠保留自主呼吸。其余两组机械通气4 h(吸入氧浓度为21%,呼吸频率为80 次/min,吸呼比为1∶2)。
1.3 检测指标及方法
1.3.1 血气分析 将大鼠麻醉(腹腔注射2%戊巴比妥钠),经左颈动脉置管并固定。在麻醉后2、3、4、5 h 和6 h 采集左颈动脉血行血气分析,记录pH 值、动脉血二氧化碳分压(PaCO2)、并根据测得氧分压和吸入氧浓度计算氧合指数。
1.3.2 肺湿/干重比(W/D)及肺病理学损伤评分 颈椎脱位法处死大鼠取右肺称湿重,随后在60℃的烤箱中干燥72 h 称干重,计算W/D。分离出左肺洗涤后用4%多聚甲醛固定,HE 染色。按随机双盲原则,由3 名病理医师按美国胸科学会的肺损伤评分标准[17]进行评分。
1.3.3 Western blot 取肺组织加入裂解液(含蛋白酶和酸酶抑制剂)提取总蛋白。采用BCA 试剂盒(碧云天,中国,P0010)测定总蛋白浓度。取等量蛋白质(30 μg)进行聚丙烯酰胺凝胶电泳,然后转到聚偏二氟乙烯膜(PVDF)膜上。用5%的脱脂牛奶进行封闭2 h,4℃一抗孵育过夜。所用一抗如下:NLRP3(1∶1000 Abcam UK,ab263899),Caspase-1(1∶1000 Invitrogen USA,MA5-32137),IL-1β(1∶3000 Abcam UK,ab9787),IL-18(1∶3000 Abcam UK,ab191860),and GAPDH(1∶1000 Cell Signaling Technology USA,97166S)。洗涤后,膜与二抗(1∶1000,碧云天,中国,A0208)室温下孵育1 h。ECL 发光液处理Western blot 条带后,使用GelDox XR系统(Bio-Rad,CA,USA)成像。
1.3.4 RT-PCR 检测NLRP3、Caspase-1、IL-18 及IL-1β 的mRNA 表达 从肺组织中提取总RNA,反转录合成cDNA。RT-PCR 扩增cDNA 反应体系为25 μL(2×qPCR Mix 12.5 μL,7.5 μmol/L 基因引物2.0 μL,反转录产物2.5 μL,ddH2O 8.0 μL),扩增条件:95℃热启动10 min 后;95℃30 s,58℃退火延伸30 s,共40 循环。每份样本重复检测3 次,取平均Ct 值,用相对定量法(2-△△Ct)计算各组小鼠目的基因表达。引物序列如下:NLRP3 正向引物为5’-CAGACCTCCAAGACCACGACTG-3’,反向引物为5’-CATCCGCAGCCAATGAACAGAG-3’。Caspase-1 正向引物为5’-ACTGAACAAAGAAGGTGGCG-3’,反向引物为5’-CAAGACGTGTACGAGTGGGTG-3’。IL-18 正向引物为5’-GACTGGCTGTGACCCTATCTGTGA-3’,反向引物为5’-TTGTGTCCTGGCACACGTTTC-3’。IL-1β 正向引物为5’-CTGTGACTCGTGGGATGATG-3’,反向引物为5’-AGGGATTTTGTCGTTGCTTG-3’。GAPDH 正向引物为5’-TGCCGCCTGGAGAAACCTGC-3’,反向引物为5’-TGCCGCCTGGAGAAACCTGC-3’。
1.4 统计学方法
应用SPSS 20.0 软件对所得数据进行统计学分析,计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t。两组比较采用t 检验。重复测量数据采用双因素重复测量方差分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 ARDS 模型判定
注入OA 2 h 后,OA 组氧合指数低于NS 组,肺损伤评分、W/D 比高于NS 组(P <0.01),见表1。肺组织HE 染色可见OA 组大鼠肺泡腔内有淡红色均质状水肿液渗出,肺泡间隔增厚,红细胞及中性粒细胞浸润,见图1。

图1 OA 注射2 h 后两组大鼠肺组织病理变化(HE,200×)
表1 油酸注射2 h 后两组大鼠氧合指数、肺损伤评分、W/D 比较()
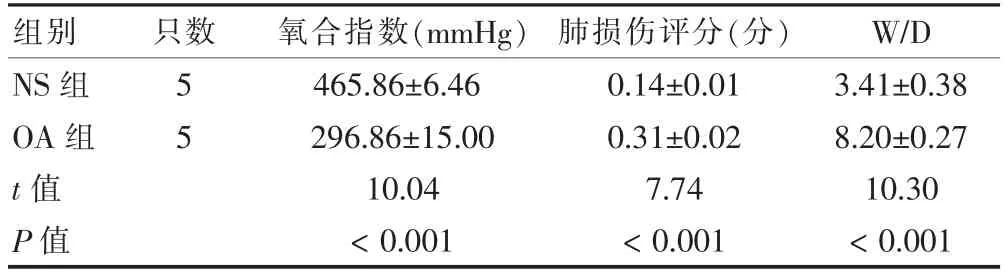
表1 油酸注射2 h 后两组大鼠氧合指数、肺损伤评分、W/D 比较()
注:NS:生理盐水;OA:油酸;W/D:肺湿/干重比。1 mmHg=0.133 kPa
2.2 各组大鼠血气参数和肺损伤
整体分析发现,麻醉后2、6 h,ARDS 组pH 和氧合指数均低于对照组,差异均有统计学意义(均P <0.05),见图2A。麻醉后6 h,损伤性机械通气组pH和氧合指数低于ARDS 组,差异均有统计学意义(均P <0.05),图2A。麻醉后6 h,小潮气量组氧合指数和pH 高于ARDS 组(P <0.05),见图2A。整体分析发现,麻醉后2 h PaCO2组间比较,差异无统计学意义(均P >0.05),见图2A。麻醉后6 h,小潮气量组PaCO2高于ARDS 组,ARDS 组PaCO2高于对照组和损伤性通气组,差异均有统计学意义(均P <0.05),见图2A。麻醉后6 h,ARDS 组肺损伤评分和W/D 高于对照组;损伤性通气组高于ARDS 组,小潮气量组低于ARDS 组(均P <0.001),见表2。
表2 各组大鼠肺损伤评分及W/D 比较()

表2 各组大鼠肺损伤评分及W/D 比较()
注:与对照组比较,aP <0.01;与ARDS 组比较,bP <0.01;与小潮气量组比较,cP <0.01。ARDS:急性呼吸窘迫综合征;W/D:肺湿干重比

图2 各组大鼠血气参数及肺组织HE 染色(200×)
2.3 各组大鼠NLRP3、Caspase-1、IL-18 及IL-1β 表达
ARDS 组NLRP3、Caspase-1、IL-18 及IL-1β 蛋白表达高于对照组;损伤性通气组高于ARDS 组;而小潮气量组和ARDS 组比较,差异无统计学意义(P >0.05)。见图3。ARDS 组NLRP3、Caspase-1、IL-18 及IL-1β mRNA 的表达高于对照组(P <0.05)。损伤性通气组高于ARDS 组(P <0.05),而小潮气量组与ARDS组比较,差异无统计学意义(P >0.05)。见表3。
表3 各组大鼠NLRP3、Caspase-1、IL-18及IL-1β 相对表达量比较()

表3 各组大鼠NLRP3、Caspase-1、IL-18及IL-1β 相对表达量比较()
注:与对照组比较,aP <0.05;与ARDS 组比较,bP <0.05;与小潮气量组比较,cP <0.05。NLRP3:核苷酸结合寡聚化结构域样受体蛋白3;Caspase-1:天冬氨酸特异性半胱氨酸蛋白酶1;IL-18:白细胞介素18;IL-1β:白细胞介素1β;ARDS:急性呼吸窘迫综合征

图3 蛋白质免疫印迹试验检测各组大鼠肺泡巨噬细胞中NLRP3、Caspase-1 和IL-18 的蛋白表达
3 讨论
本研究通过右侧颈静脉注射OA 成功制备了ARDS 模型[18]。本研究结果显示损伤性机械通气和ARDS 均可使肺组 织中NLRP3、Caspase-1、IL-18 及IL-1β 表达增加,并且上述指标的高表达与肺损伤具有相关性。
NLRP3 炎症小体通过活化Caspase-1,促使pro-IL-β 和pro-IL-18 裂解、成熟、释放,参与先天免疫防御,是机体固有免疫系统的重要组成部分[19]。活性氧(ROS)是激活NLRP3 的重要途径,ARDS 会使内皮细胞/上皮细胞功能受损产生过多的ROS[20-21]。本研究中,ARDS 组肺组织中NLRP3 表达高于对照组,并且Caspase-1 活化表达增加,其下游的IL-1β、IL-18 表达也增加,提示ARDS 可诱导NLRP3 活化。另外,损伤性机械通气可以提高肺泡巨噬细胞中ROS 的表达水平[22],机械牵张也会直接激活肺泡巨噬细胞中的NLRP3[23]。本研究提示损伤性通气组的NLRP3 表达水平高于ARDS 组,并且肺损伤更严重。这可能是因为损伤性通气导致NLRP3 过度激活,引起由炎性介质、细胞因子和炎症细胞参与的生物损伤。而小潮气量组肺损伤较轻,可能与改善氧合抑制ROS 产生,减少对肺的过度牵张有关。这些结果提示损伤性通气和ARDS 都可激活肺组织中的NLRP3,并且损伤性机械通气NLRP3 过度激活。一旦NLRP3 被激活会导致Casepase-1、IL-1β、IL-18 表达升高。IL-1β 在急性肺损伤的发展中起着关键作用,可促使转化生长因子-β表达增加,后者是炎症和纤维化的标志[24]。有研究提示急性肺损伤的病症严重程度与IL-18 水平有直接关联[25]。Western blot 及RT-PCR 证实,与ARDS 组相比,损伤性通气组IL-1β、IL-18 的表达水平更高,病理分析提示肺损伤更严重。这就提示损伤性通气使NLRP3 过渡激活,释放大量炎症因子,加重了ARDS肺损伤。
综上所述,NLRP3 炎症小体激活与ARDS 所致肺损伤相关。在ARDS 基础上,损伤性通气进一步增加了NLRP3 及其下游炎症因子IL-1β、IL-18 的表达,提示损伤性通气可能通过过度激活NLRP3 加重ARDS 大鼠肺损伤,而小潮气量通气可以避免过度激活NLRP3炎症小体,可能是其发挥肺保护作用的机制之一。
