黏液溶解性祛痰药辅助治疗新型冠状病毒肺炎重症患者的回顾性分析*
2021-07-29周涛龚卫静蔡雪峰曾芳张玉
周涛,龚卫静,蔡雪峰,曾芳,张玉
(1.华中科技大学同济医学院附属协和医院药剂科,武汉 430022;2.湖北省重大疾病精准用药医学研究中心,武汉 430022)
呼吸综合征冠状病毒2(SARS-CoV-2)可对人体多个器官发起攻击,其中肺脏是主要靶器官。首例新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)死亡患者法医学检查结果[1]指出,该患者肺部切开可见大量灰白色黏稠液体溢出,气管腔内和右侧支气管腔内可见白色泡沫状黏液和胶冻状黏液附着。气道黏液增多、黏稠度增高会使患者通气功能发生障碍,极易诱发继发性细菌感染,最终形成难以纠正的低氧血症和急性呼吸窘迫综合征导致患者死亡[2]。迄今为止全球最大规模的新冠肺炎尸检结果[3]也表明死亡患者小气道分泌物增多,病程长的病例中存在肺间质纤维化,患者主要死因系多器官功能障碍综合征,尤其是急性呼吸窘迫综合征,与上述推测一致。
祛痰药促进排痰,帮助患者保持气道通畅,恢复通气和换气功能,在COVID-19患者中的辅助治疗作用得到广泛关注。祛痰药按作用机制可分为四类,其中黏液溶解性祛痰药因临床应用时间较长,不良反应较低。在《湖北省新型冠状病毒肺炎临床用药指引(第一版)》将N-乙酰半胱氨酸纳入到治疗方案中,《新冠肺炎病毒肺炎诊疗方案(试行第七版)》中也提出要根据气道分泌物情况,选择密闭式吸痰,提示及时祛痰的重要性。然而,目前尚缺乏临床证据支持黏液溶解性祛痰药在COVID-19治疗中的应用。本研究旨在通过回顾性分析探讨黏液溶解性祛痰药在COVID-19重症患者中的临床疗效,以期为临床治疗提供参考。
1 资料及方法
1.1一般资料 对2020年2月1日—3月10日收治于华中科技大学同济医学院附属协和医院西院的COVID-19患者进行回顾性分析。纳入标准:①实时荧光RT-PCR检测SARS-CoV-2核酸呈阳性的确诊患者;②达到《新型冠状病毒肺炎诊疗方案(试行第六版)》中的重型标准,即出现气促RR≥30次·min-1;或静息状态下指氧饱和度≤93%;或动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg;③临床结局明确,包含好转出院患者或死亡患者。④黏液溶解性祛痰药治疗组纳入使用黏液溶解性祛痰药治疗的患者,对照组为未接受过黏液溶解性祛痰药治疗的患者。排除标准:①孕妇;②住院时间≤48 h;③患者资料不能完整收集。
本研究共纳入COVID-19重症患者208例,其中治疗组127例,对照组81例。本研究经华中科技大学同济医学院附属协和医院伦理委员会批准([2020-0104]),为回顾性研究,可免于知情同意书。
1.2研究方法 根据患者临床症状及实验室检查结果,分别给予对症支持治疗和药物治疗,所有患者的治疗方案均按照国家卫生健康委员会印发的各版《新型冠状病毒肺炎诊疗方案》进行。所有临床资料均从医院信息系统中提取,包括患者个人信息、既往史、合并疾病、临床症状、实验室检查结果和治疗方案等信息,并由两名临床药师交叉核对。对纳入的208例COVID-19重症患者,应用7分等级量表对其入院第1天到第28天的病情严重程度进行评估。7分等级量表[4]标准如下,1分:出院已恢复正常功能状态;2分:出院但未恢复正常功能状态;3分:住院但不需要接受氧气治疗;4分:住院并接受氧气治疗;5分:住院并接受无创通气和(或)高流量氧气治疗;6分:住院并接受ECMO和(或)机械通气;7分:死亡。当患者评估得分提高两分或出院时(以先达到的条件为准),可认定其临床好转。本研究主要研究终点为:临床好转时间。次要研究终点为:死亡率和核酸转阴时间。
1.3统计学方法 使用SPSS 23.0版软件分析数据。连续变量以中位数(第一和第三四分位数Q1-Q3)表示,对正态分布的连续变量数据两组间采用t检验或单方差因素分析,否则采用Mann-Whitney U检验或Kruskal-Wallis检验;分类变量以n(%)表示,两组间比较采用χ2检验或Fisher精确检验;临床好转时间、核酸转阴时间和生存率使用K-M 曲线评价。采用COX 比例风险回归模型评价黏液溶解性祛痰药治疗对于患者预后的影响。P<0.05(双边)时提示差异有统计学意义。
2 结果
2.1两组患者临床基线资料比较 如表1所示,纳入分析的208例COVID-19重症患者平均年龄62岁,老年患者(>65岁)人数比例55.77%,男性为51.44%。患者从发病到住院天数为12 d,合并疾病患者比例58.17%,以高血压(31.73%)、糖尿病(25.48%)、心血管疾病(16.35%)、肝脏疾病(4.33%)、肾脏疾病(4.81%)和肿瘤(9.13%)为主要临床表现。治疗组和对照组分别纳入患者127例和81例,两组患者的人口统计学特征、合并疾病情况及实验室检查结果详见表1。除咳痰症状治疗组显著高于对照组外[47(37.01%)vs17(20.99%),P=0.0146]外,其他各项指标两组间差异均无统计学意义(P>0.05),临床一致性好,具有较强的可比性。
2.2两组患者用药情况比较 如表2所示,治疗组干扰素使用比例显著高于对照组[40(31.50%)vs15(18.52%),P=0.039],同时,治疗组的抗生素和糖皮质激素使用比例也显著高于对照组[119(93.70%)vs 61(75.31%),P=0.000 2;50(39.37%) vs 20(24.69%),P=0.029],其他用药两组间差异均无统计学意义(P>0.05)。
2.3两组患者临床疗效比较 如表3所示,主要研究终点临床好转时间治疗组为23 d,与对照组(22 d)比较虽有改善但无统计学差异(P=0.129),两组间的累计临床改善率亦无统计学差异[图1A,P=0.756,HR=0.949,95%CI(0.683,1.318)%]。次要研究终点核酸转阴时间治疗组为和对照组均为10 d,累计核酸转阴率差异无统计学意义[图1B,P=0.370,HR=0.752,95%CI(0.403,1.402)%];如表3所示,死亡人数治疗组有24例,与对照组17例比较差异无统计学意义(P=0.712),两组间患者累计生存率差异无统计学意义[图1C,P=0.749,HR=1.052,95%CI(0.770,1.438)%]。此外,患者在第1,7,14天的7分等级量表评估结果差异无统计学意义 (表3)。
如图2所示,主要研究终点临床好转时间N-乙酰半胱氨酸治疗组和对照组均为22 d,两组间的累计临床改善率差异无统计学意义[图2A,P=0.359,HR=0.845,95%CI(0.589,1.212)%]。次要研究终点核酸转阴时间N-乙酰半胱氨酸治疗组为10 d,对照组为11 d,累计核酸转阴率差异无统计学意义[图2B,P=0.162,HR=0.781,95%CI(0.553,1.104)%];死亡人数N-乙酰半胱氨酸治疗组有9例,对照组为17例,两组患者间的累计生存率差异无统计学意义[图2C,P=0.107,HR=1.946,95%CI(0.867,4.370)%]。
3 讨论
本回顾性研究共计纳入COVID-19重症患者208例,其中有127例接受黏液溶解性祛痰药治疗。本研究中的主要研究终点临床好转时间采用7分等级量表评估,这一评价方法常用于流感临床研究[5],在COVID-19相关研究中也被作为主要研究终点使用[6]。在校正了各项混杂因素后分析发现,黏液溶解性祛痰药不能缩短患者临床好转时间,提高临床好转率,对核酸转阴时间和死亡率亦无改善作用。
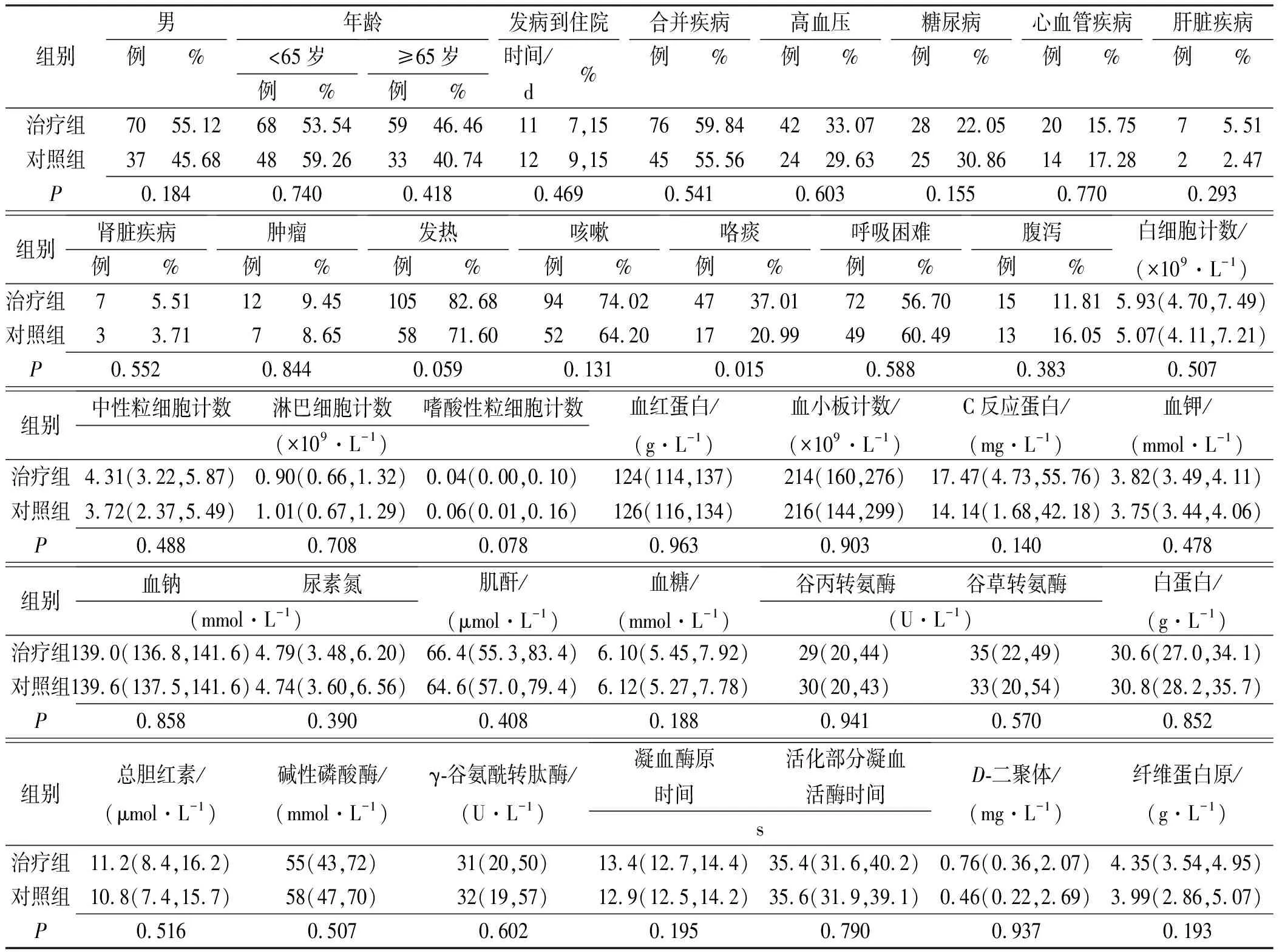
表1 COVID-19重症患者治疗组和对照组人口统计学特征和临床基本特征

表2 COVID-19重症患者治疗组和对照组住院期间用药情况①
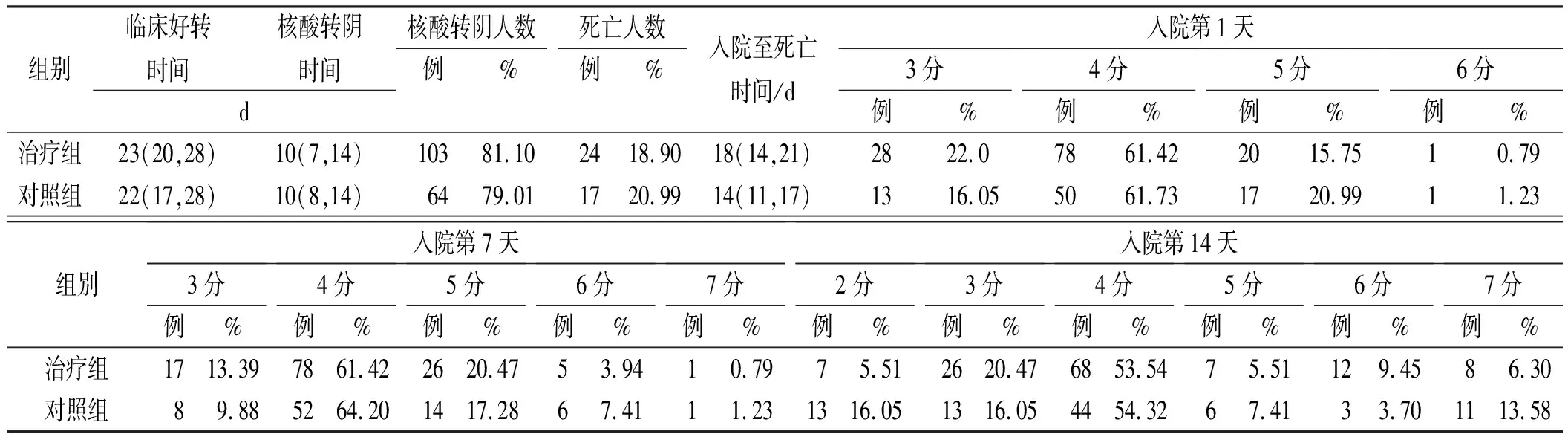
表3 COVID-19重症患者治疗组和对照组的临床研究终点
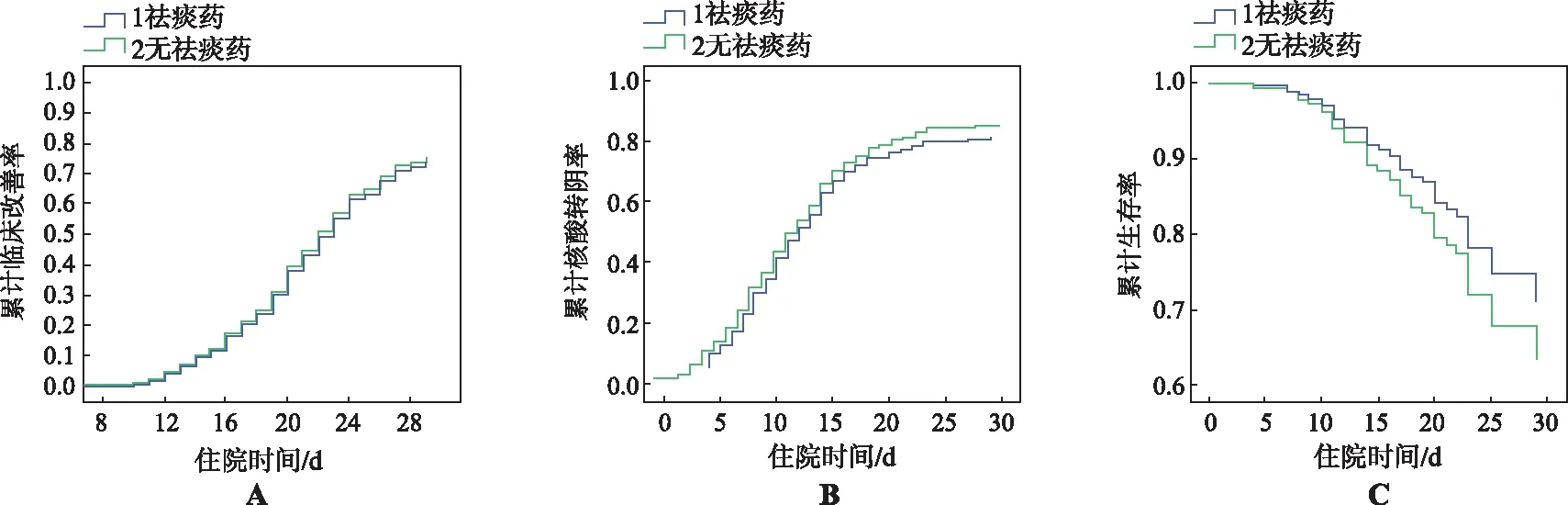
A.累计临床好转率;B.累计核酸转阴率;C.累计生存率。
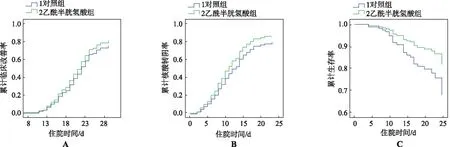
A.累计临床好转率;B.累计核酸转阴率;C.累计生存率。
本研究中治疗组所用黏液溶解性祛痰药为N-乙酰半胱氨酸、氨溴索或桉柠蒎肠溶软胶囊。N-乙酰半胱氨酸通过使痰液中糖蛋白多肽链的二硫键断裂而降低痰液的黏滞性,促进排痰,同时,它还可作为ROS的直接清除剂发挥抗氧化作用,调节炎症反应[7],临床研究表明N-乙酰半胱氨酸能显著减轻流感和流感样发作[8],且对与SARS-CoV-2同为β属冠状病毒的SARS-CoV感染患者也有一定的治疗作用[9];氨溴索可通过促进呼吸道表面活性物质形成,调节黏液性物质的分泌促进排痰,有研究者发现氨溴索是潜在的ACE2受体结合药,可能通过阻断SARS-CoV-2与ACE2受体结合减少病毒复制,达到治疗COVID-19的作用[10];桉柠蒎肠溶软胶囊主要成分为桉油精、柠檬烯和α-蒎烯,其可通过降低粘液黏滞度和恢复黏液纤毛清除系统促进排痰[11],动物实验证实其对炎症诱发的急性肺损伤有一定改善作用[12]。
在《新型冠状病毒肺炎诊疗方案(试行第七版)》中首次出现了关于病理改变的描述[13]:肺泡腔内有渗出物形成,肺内支气管腔内可见黏液及黏液栓形成。黏液痰栓的形成会阻碍气道通畅,极易造成继发细菌感染,推动新冠肺炎患者由重症转为危重症。因此,有专家推荐除必需的抗病毒治疗和人工机械通气外,还应选用黏液溶解性祛痰药来辅助治疗新冠肺炎患者[2]。然而,本回顾性研究结果表明黏液溶解性祛痰药对COVID-19重症患者的临床症状、核酸转阴时间和死亡率并无改善作用。
虽然N-乙酰半胱氨酸、氨溴索和桉柠蒎肠溶软胶囊同属黏液溶解性祛痰药,但具体作用机制不同。经统计,入组患者黏液溶解性祛痰药使用情况为N-乙酰半胱氨酸组(74例)、氨溴索组(24例)、桉柠蒎肠溶软胶囊(3例)、N-乙酰半胱氨酸+氨溴索组(19例)、氨溴索+桉柠蒎肠溶软胶囊组(1例)和N-乙酰半胱氨酸+桉柠蒎肠溶软胶囊组(6例)。受样本数量所限,笔者选择样本量相对较多的N-乙酰半胱氨酸组做进一步分析,但结果表明N-乙酰半胱氨酸对新冠肺炎重症患者作用亦不明显。
作为一项回顾性研究,本研究存在一定的局限性。首先,本研究的样本量偏小,仅纳入了2020年2月1日—3月10日好转或出院患者,研究结果可能存在偏差;此外,COVID-19重症患者病情复杂,临床表现各异,这可能对治疗方案产生影响,在用药情况中可以看出治疗组抗菌药和糖皮质激素使用情况显著高于对照组;由于下呼吸道样本中缺乏连续的病毒载量测量,因此无法探讨病毒载量变化与黏液溶解性祛痰药治疗之间的关系;且作为一种针对性治疗,相对于未出现咳痰相关症状的患者,临床上祛痰药的使用更倾向于出现咳痰相关症状的患者,这必然会造成基线不平,尽管笔者把这一因素作为协变量进行校正,但并不能完全消除基线不平的影响。黏液溶解性祛痰药治疗COVID-19的临床疗效尚需大样本、多中心的随机对照双盲的临床前瞻性研究进一步明确,将黏液溶解性祛痰药作为治疗和预防分别进行分析来进一步确定其对COVID-19疾病转归的影响亦很有必要。
