四川省细菌耐药监测网2016—2020年血流感染病原菌分布及耐药分析
2021-07-29龙姗姗黄湘宁张杰钟敏刘爱波喻华
龙姗姗,黄湘宁,张杰,钟敏,刘爱波,喻华
(电子科技大学附属医院·四川省人民医院临床医学检验中心,成都 610072)
血流感染是病原菌侵入宿主血液中生长繁殖并释放毒素及代谢产物,严重者可引起休克及全身多器官衰竭,甚至死亡,具有发病率高、病死率高的特点[1]。在欧洲,每年约有1200万例患者发生血流感染,因其死亡的数目为15万~270万例[2-3],而在我国,每年约超过20万例患者发生血流感染,其死亡率高,为5%~40%[4]。近年来,随着各种侵入性操作和介入治疗手段的增多,导致血流感染发生率升高,而临床抗菌药物和大量激素的广泛使用所导致耐药性问题也日益突出[5-16]。因此,动态监测血流感染病原菌的分布及耐药趋势对指导临床合理用药有重要意义。现将四川省细菌耐药监测网2016—2020年血流感染病原菌分布及耐药情况报道如下,旨在为临床合理使用抗菌药物,防控感染提供科学依据。
1 材料与方法
1.1菌株来源 收集四川省数据合格的86家三甲医院(东部医院11家,西部医院32家,南部医院27家,北部医院16家),2016—2020年住院和门诊患者临床血液标本中分离的非重复病原菌。
1.2细菌鉴定及药敏试验
1.2.1细菌鉴定 采用全自动VITEK系统、BD100系统、质谱系统鉴定细菌种类。
1.2.2药敏测定 参照2020年美国临床和实验室标准化协会(Clinical and laboratory standards institute,CLSI)推荐的MIC法、纸片扩散法进行。MIC法:采用VITEK系统、BD系统等进行MIC的测定。药敏纸片法:采用纸片扩散法为主(Kirby-Bauer法)(药敏纸片:BBL公司或Oxoid公司)。
1.3质量控制 在实验条件稳定下实行每周1次常规质量控制程序,药敏方法按照CLSI要求进行,采用纸片扩散法或自动化仪器法(包括VITEK系统、BD系统和MicroScan系统等),根据质控菌株的测定范围判断是否在控。药敏纸片法:以纸片扩散法为主(Kirby-Bauer法),药敏纸片使用Oxoid公司、温州康泰公司、杭州天和公司等生产的商品,普通细菌药敏试验培养基使用MH琼脂,流感嗜血菌药敏试验使用HTM培养基,肺炎链球菌及β-溶血链球菌使用5% 羊血MH琼脂培养基。从上海宝录公司购买标准质控菌株,包括:大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 25923、肺炎克雷伯菌ATCC 700603、阴沟肠杆菌 ATCC 700323、铜绿假单胞菌ATCC 27853、肺炎链球菌ATCC 49619和流感嗜血杆菌ATCC 49247等。
1.4数据分析 药敏判读标准:参照美国临床和实验室标准协会(CLSI)指南(2020版)细菌药敏折点进行结果判读,质控菌株药敏结果在控,研究菌株结果方可纳入数据分析。所得结果用WHONET 5.6版软件进行分析。
2 结果
2.1细菌种类及分布情况 2016—2020年四川省86家医院血液标本共分离病原菌84 232株,其中革兰阴性菌49 523株(58.8%),革兰阳性菌34 709株(41.2%)。检出率前5位的菌依次是大肠埃希菌(28 574株,占33.9%)、肺炎克雷伯菌(9225株,占11.0%)、表皮葡萄球菌(7824株,占9.3%)、金黄色葡萄球菌(5704株,占6.8%)、人葡萄球菌(5516株,占6.5%),见表1。
2.2主要革兰阴性菌药敏情况 5年间,大肠埃希菌对各类抗菌药物耐药率保持稳定,碳青霉烯类耐药率虽略有升高,但保持在约1.0%;肺炎克雷伯菌对碳青霉烯类药耐药率呈上升趋势,对厄他培南、亚胺培南、美罗培南耐药率从2016年的1.7%,2.4%,3.5%上升到2020年的3.6%,5.9%,6.8%,对其他抗菌药物耐药率保持稳定,见表2。铜绿假单胞菌对亚胺培南、美罗培南耐药率从2016年的12.6%,11.0%下降为2020年的7.5%,5.5%,对氨基苷类、喹诺酮类耐药率略有下降,其余药物则保持稳定;鲍曼不动杆菌除替加环素保持低耐药率外,其余药物耐药率均呈下降趋势,见表3。
2.3葡萄球菌药敏情况 检出的葡萄球菌以表皮葡萄球菌为主(9.3%),其次是金黄色葡萄球菌(6.8%)和人葡萄球菌(6.5%)。金黄色葡萄球菌和凝固酶阴性葡萄球菌中甲氧西林耐药株(MRSA和MRCNS)检出率分别为25.5%和71.7%。5年间,金黄色葡萄球菌对庆大霉素、利福平耐药率呈下降趋势,从2016年的20.4%,6.4%下降至2020年的13.8%,2.1%;对红霉素耐药率维持在约60.0%,对奎奴普丁/达福普汀耐药率低于10.0%。MRSA对青霉素耐药率为100.0%,对克林霉素、红霉素也维持较高耐药水平;对庆大霉素、利福平耐药率从2016年的37.2%、25.9%下降至2020年的11.7%、5.7%。均未发现对万古霉素、利奈唑胺不敏感的菌株见表4、表5。

表2 2016—2020年主要肠杆菌目细菌对抗菌药物的耐药率

表4 凝固酶阴性葡萄球菌、MRCNS、MSCNS对抗菌药物的耐药率和敏感率

表5 2016—2020年金黄色葡萄球菌和MRSA对抗菌药物的耐药率
2.4肠球菌药敏情况 检出的肠球菌主要以屎肠球菌、粪肠球菌为主。屎肠球菌和粪肠球菌对万古霉素、氨苄西林、高浓度庆大霉素、利奈唑胺耐药率分别为1.7%和0.4%,86.1%和4.4%,44.9%和32.7%,0.4%和1.9%。除利奈唑胺、四环素外,屎肠球菌对抗菌药物耐药率明显高于粪肠球菌,见表6。5年间,屎肠球菌和粪肠球菌对万古霉素、利奈唑胺的耐药率呈逐年递减趋势,屎肠球菌从2016年的2.9%,1.3%下降至2020年的0.2%,0.2%,粪肠球菌从2016年的0.9%,4.9%下降至2020年的0.0%,1.5%。屎肠球菌对青霉素类及喹诺酮类药物一直维持在较高耐药水平;粪肠球菌除了对克林霉素、四环素有较高耐药率外,对青霉素类、万古霉素、利奈唑胺及喹诺酮类药物一直保持较高活性,见表7。
3 讨论
监测显示,本省86家三甲医院2016—2020年从血液标本中分离出病原菌84 232株,以大肠埃希菌(33.9%)、肺炎克雷伯菌(11.0%)、表皮葡萄球菌(9.3%)、金黄色葡萄球菌(6.8%)和人葡萄球菌(6.5%)为主。其中革兰阴性菌(49 523株,58.8%)分离率高于革兰阳性菌(34 709株,41.2%),与国内其他报道一致[5-9,16-17]。四川省东部、南部、西部、北部医院检出率前3位菌均为大肠埃希菌、肺炎克雷伯菌、表皮葡萄球菌,第4位及第5位人葡萄球菌和金黄色葡萄球菌排序略微有差异,各类细菌耐药性差异无统计学意义。
5年间,大肠埃希菌对各类抗菌药物耐药率保持稳定,碳青霉烯类耐药率虽略有升高,但保持在约1.0%;肺炎克雷伯菌对厄他培南、亚胺培南、美罗培南的耐药率从2016年的1.7%,2.4%,3.5%上升到2020年的3.6%,5.9%,6.8%,对其他抗菌药物耐药率保持稳定。目前,对碳青霉烯类耐药的革兰阴性菌的流行播散是全球重大公共卫生问题,此次监测本省耐碳青霉烯类大肠埃希菌、肺炎克雷伯菌检出率分别为1.0%,5.9%,略低于全国平均水平[11-12],但近年来数据显示分离率逐步呈上升趋势[13-15]。药敏结果显示耐碳青霉烯类大肠埃希菌对阿米卡星、妥布霉素耐药率为23.4%、48.6%,对头孢菌素类、喹诺酮类药物耐药率均>85.0%;耐碳青霉烯类肺炎克雷伯菌除对阿米卡星、四环素耐药率低于50.0% 外,对其余药物均处于较高耐药水平。由于此类菌株有广泛耐药特征,在全国报道[11-12]显示常规药敏仅对替加环素、多粘菌素、头孢他啶-阿维巴坦敏感。碳青霉烯酶是肠杆菌目细菌对碳青霉烯类药物耐药的主要机制,主要包括KPC、NDM、OXA-48、VIP和IMP等[18],以往报道,大肠埃希菌主要产NDM金属酶,肺炎克雷伯菌产KPC酶,但近年来耐碳青霉烯类肺炎克雷伯菌流行D类OXA-48型酶[19-20]。研究显示,头孢他啶-阿维巴坦对产KPC或OXA-48型碳青霉烯酶菌株有高度抗菌活性,但对产NDM金属酶菌株活性较差[20]。因此,对耐碳青霉烯类菌株,建议微生物室可按照CLSI推荐的方法开展碳青霉烯酶耐药表型的测定,并可在现有药敏系统基础上补充替加环素、多粘菌素、磷霉素、头孢哌酮/舒巴坦等重要药物的最低抑菌浓度,同时测定头孢他啶/阿维巴坦的药敏结果。有条件的实验室还可开展联合药敏试验,如产KPC酶的耐碳青霉烯酶菌株,可用亚胺培南联合克拉维酸进行药敏试验[21],旨在能为临床提供更为精准的用药方案。
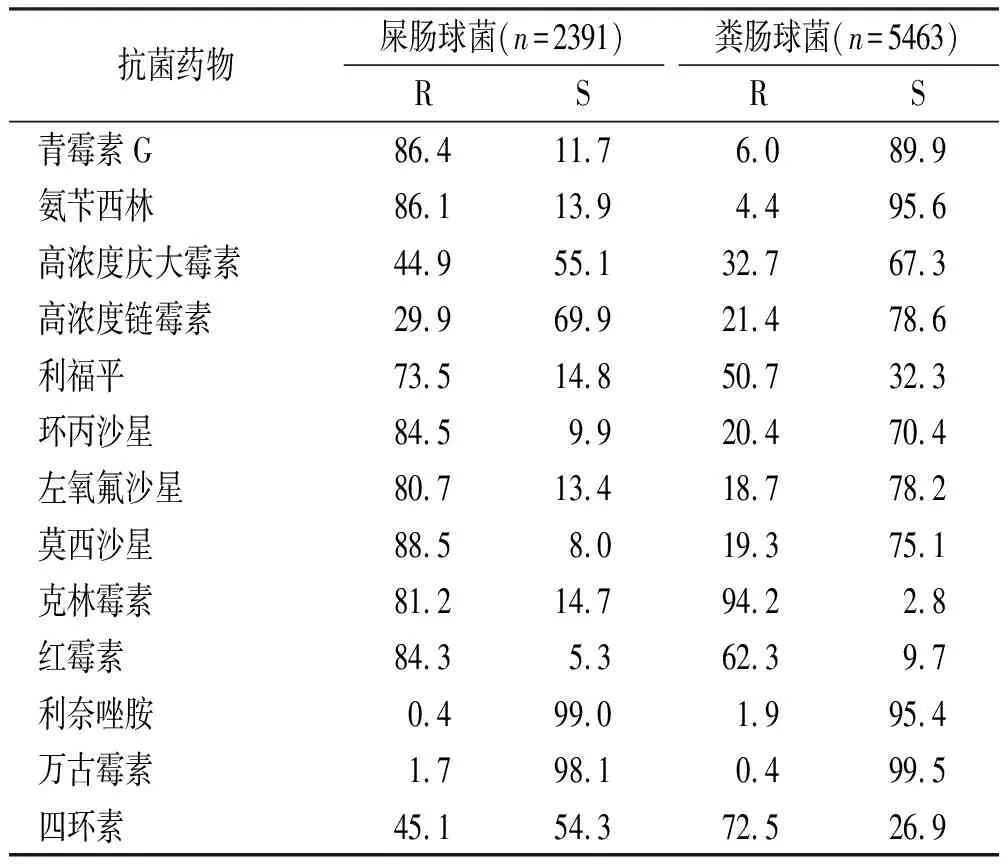
表6 主要肠球菌对抗菌药物的耐药率和敏感率
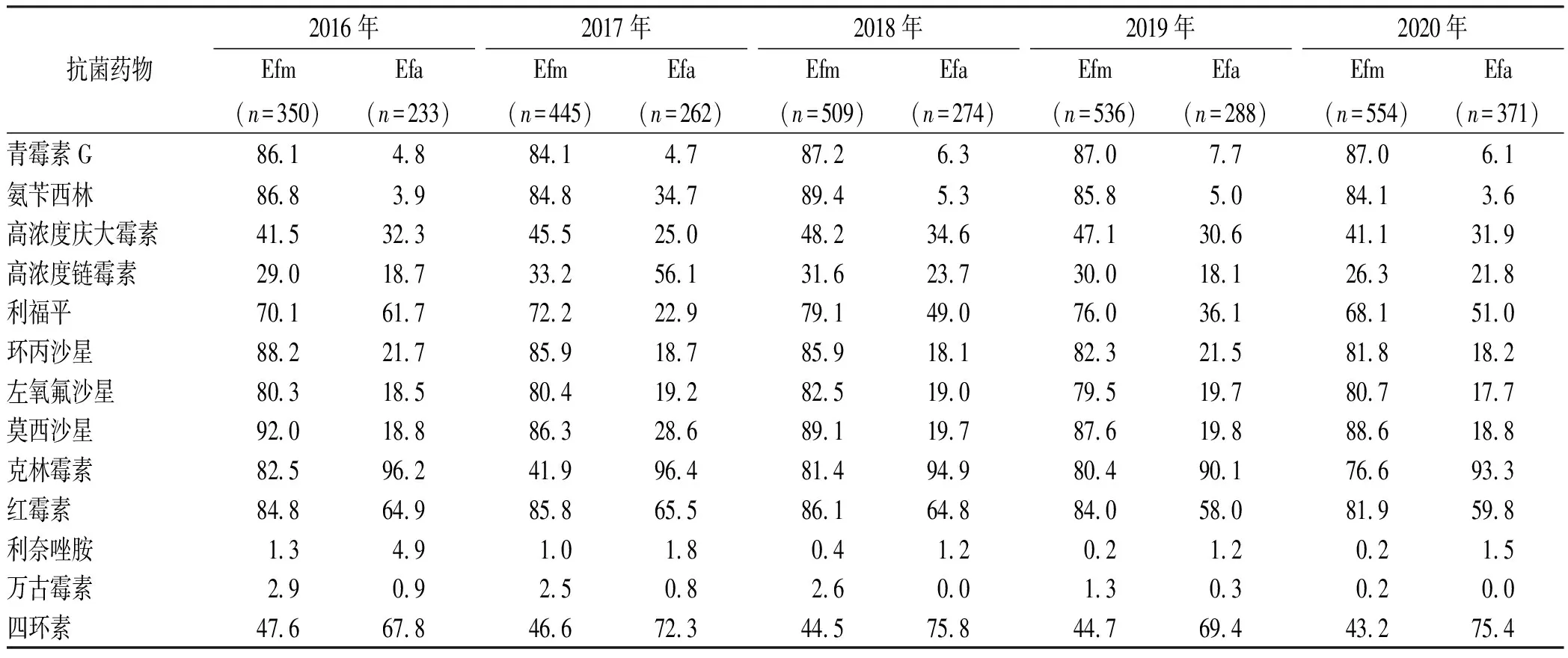
表7 2016—2020年屎肠球菌、粪肠球菌抗菌药物的耐药率
本省检出的铜绿假单胞菌对喹诺酮类耐药率低于10.0%,对氨基苷类耐药率低于5.0%,这可能与本地区临床对此类药物使用率低,且氨基苷类与其他抗菌药物联合使用有关。全国数据显示[10-12],不同地区铜绿假单胞菌耐药情况有所不同,若仅凭经验用药可能会导致细菌耐药情况更加严重,因此临床应根据本单位耐药监测资料合理选用抗菌药物。
研究中,本省分离的革兰阳性菌以凝固酶阴性葡萄球菌(CNS)和金黄色葡萄球菌为主,其中表皮葡萄球菌居第3位,人葡萄球菌居第6位,溶血葡萄球菌居第8位,使得总体CNS的构成比较高。究其原因,CNS是人体皮肤、黏膜的正常菌群,但随着各种侵入性操作的增多,尤其留置导管和医用装置植入,易使皮肤正常菌群进入机体,引发血液感染。但同时也应注意,CNS是血培养最常见的污染菌,对于判断是污染还是感染,需要加强与临床的沟通,采集血培养时须做好严格规范的消毒措施,建议双瓶多套、不同部位采血送检,以提高送检率与合格率。同时结合降钙素原检测结果、患者临床症状以及血培养阳性报告时间等,这些都可为确定是否为病原菌提供参考依据。本监测中显示,MRCNS和MRSA检出率分别为71.7%和25.5%,低于全国水平[12]。MRCNS对大多数检测药物的耐药率高于MSCNS株,但万古霉素、利奈唑胺对两者敏感率为100.0%,表明这类药物仍可作为治疗首选。MRSA株对青霉素的耐药率为100.0%,克林霉素耐药率71.4%,红霉素耐药率82.3%,显示这些药物已不再适用四川省MRSA株治疗;对万古霉素、利奈唑胺仍保持100.0%敏感性;对其他药物如奎奴普丁/达福普汀、利福平、复方磺胺甲唑敏感性较高,表明这些药物也可作为治疗选择。然而随着万古霉素的广泛使用,也应警惕是否出现对万古霉素中介的SA(VISA)及对万古霉素耐药的SA(VRSA)[22-23],为了预防低易感株的出现、高剂量使用万古霉素导致的肾毒性,美国FDA批准了利奈唑胺、达普霉素、替加环素、特拉万辛和头孢洛林五种药物用于治疗MRSA感染[24]。
肠球菌的检出以屎肠球菌为主,监测显示,屎肠球菌对万古霉素、利奈唑胺的耐药率从2016年的2.9%、1.3%下降至2020年的0.2%、0.2%,粪肠球菌从2016年的0.9%、4.9%下降至2020年的0.0%、1.5%,均呈逐年递减趋势。虽然耐万古霉素的肠球菌(VRE)检出有所下降,但也不能忽视VRE引发血流感染(VRE-BSI)带来的高病死率、住院时间延长及医疗支出增加等问题[25]。对于VRE-BSI的治疗,目前利奈唑胺、达托霉素、替加环素保持较高体外活性[26-27],但由于利奈唑胺易产生红细胞、血红蛋白、血小板降低等血液系统不良反应[28-29],因而达托霉素在安全性上更具优势,且高剂量达托霉素的疗效和预后效果更佳[30],临床医生可根据需要选用药物。
综上所述,2016—2020年四川省血流感染病原菌以革兰阴性菌为主,葡萄球菌、肠球菌也应予与重视。由于血流感染病原菌分布广泛,不同菌株对抗菌药物耐药性不同,因此对其进行长期动态监测,实时了解药敏变化趋势非常重要。临床应不断规范血培养等无菌体液标本的留取与送检,提升送检率与合格率,正确解读检测报告,合理选用抗菌药物,从而减少耐药菌株的产生,延缓细菌耐药速度。
