益生菌干预肝脏组织DAG-PKC的表达对肥胖小鼠胰岛素抵抗的影响*
2021-07-29易嘉岱常向云王晓丽程运杰
易嘉岱,常向云,王晓丽,程运杰
(1.石河子大学医学院第一附属医院内分泌与代谢科,石河子 832002;2.浙江省立同德医院内分泌与代谢科,杭州 310012)
肥胖是一种常见病,属于世界性公众健康问题,当机体的能量消耗远小于摄入时便会导致体脂沉积,从而造成体质量增加[1],临床上定义身体质量指数(BMI)≥30 kg·(m2)-1为肥胖[2]。研究显示糖尿病、冠心病的患病风险会随着BMI的增加而增加[3],因此肥胖不仅对人类的身体健康带来伤害,也给社会经济的发展以及医疗卫生事业带来巨大的负担。肥胖是引起胰岛素抵抗(IR)的主要潜在原因[4]。肥胖引起IR的机制可能与胰岛素信号通路受损、糖脂代谢紊乱、慢性炎症以及氧化应激有关[5]。近年来多个研究显示二酰甘油(DAG)-蛋白激酶C(PKC)与IR有关,在多种包括饮食介导的肥胖大鼠和肥胖人群、输注葡萄糖或2型糖尿病的啮齿动物模型中发现,当存在IR状态时,机体内的DAG、PKC含量增加,且PKC的分布、活性也发生了改变[6]。DAG是PKC的生理激活因子,当循环中血糖升高时,DAG主要依赖于从头合成磷脂,DAG的含量增加,PKC的活性及分布发生改变,使得DAG-PKC通路的活性升高,引起胰岛素受体的磷酸化和下调[10],这一过程导致了脂质代谢紊乱和IR。益生菌作为微生态制剂,在维持肠道菌群的平衡方面起着重要作用[8]。多项研究显示肠道菌群失调与肥胖等多种慢性疾病相关[9]。补充益生菌可改善2型糖尿病的IR状态[10],但相关的机制暂不明确。故本研究旨在通过研究益生菌干预饮食介导的肥胖小鼠肝脏组织中 DAG、 PKC的表达情况,进一步探讨益生菌对改善脂代谢及IR的可能机制。为肥胖及IR的预防和治疗提供新的思路及理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 C57BL/6N雄性野生型小鼠60只,5周龄,无特定病原体(SPF)级,购于北京维通利华实验动物技术有限公司[SCXK(京)-2016-0006],平均体质量(19±1.0) g,适应性喂养1周。所有小鼠分笼饲养于清洁动物房,每笼 5只,保持温度在17~21 ℃,相对湿度保持在约50%,每日光照12 h。
1.1.2主要试剂和仪器 DAG酶联免疫检测试剂盒(上海江莱生物科技有限公司,批号:JL18401);PKC酶联免疫检测试剂盒(上海江莱生物科技有限公司,批号:JL13990);磷酸盐缓冲液(Biosharp公司,批号:69010707)(pH值7.4);小鼠饲料均购于华雅思创生物科技有限公司(高脂饲料,批号:D12492;普通饲料,批号:D12450B);益生菌VSL#3购于美国VSL公司(V1209-0917)(成分包括乳酸杆菌属、拟杆菌属、链球菌属);血糖仪和血糖试纸(Roche,德国);酶标仪(Molecular Devices,美国) ;全自动化学发光免疫分析仪(Roche,德国)。
1.2方法
1.2.1实验分组及VSL#3干预 C57BL/6N雄性野生型小鼠60只,采用配对比较法进行随机分为2组,正常脂肪饮食(NFD)30只给予普通饲料(脂肪热卡占10%),高脂肪饮食(HFD)30只给予高脂饲料(脂肪热卡占 60%),饲养8周后,将两组小鼠称质量并记录其体质量(WT),评估造模结果,HFD组小鼠体质量相较于NFD组小鼠平均体质量增加20%定义为肥胖小鼠[11]。将造模成功的肥胖小鼠及NFD组小鼠分别随机分为活性益生菌干预(VSL#3)、灭活益生菌干预(灭活VSL#3)、空白对照(等量纯化水)继续干预4周。VSL#3剂量及给药方式:参照人的口服剂量换算出小鼠所需VSL#3为1.2 g·kg-1·d-1;以每只小鼠体质量20 g计算,VSL#3的剂量约为每只24 mg·d-1,溶于普通纯化水,每日一次灌胃;灭活益生菌干预组将VSL#3溶于60 ℃ 热纯化水中灭活后,同等剂量灌胃。空白对照组予以等量蒸馏水灌胃。
1.2.2血糖、血脂检测 干预结束后,所有小鼠空腹8 h,内眦静脉采血,抗凝管收集小鼠静脉血,静置30 min,3000 r·min-1(r=10 cm),离心5 min,取上清液,采用化学发光法测量空腹胰岛素(FINS),酶比色法测量三酰甘油(TG)、胆固醇(TC);胰岛素抵抗指数HOMA-IR(insulin resistance index,IRI),IRI=INS(mU·L-1)×FBG(mmol·L-1)/22.5。
1.2.3标本制备及ELISA 干预结束后,所有小鼠禁食8 h,称定质量并记录,处死小鼠,在无菌环境下打开腹腔,摘取肝脏,放入无菌冻存管,并取小鼠肝脏组织(50±5)mg,进行称定质量并记录,加入1000 μL的磷酸盐缓冲液,用干燥无菌玻璃研磨器将肝脏标本研磨充分,研磨好的组织匀浆转入 1.5 mL EP管内,4 ℃,3000 r·min-1(r=10 cm),离心20 min,小心吸取上清液转入另一新EP管中,备用。
向预先包被相关抗体的酶标孔中依次分别加入标准品、稀释后的待测样本,再依次加入酶标试剂,使其形成抗体抗原酶标抗体复合物,随后将酶标包被板置于37 ℃温箱中温育60 min,经过5次充分洗涤未结合的成分,再分别向每孔中先后加入显色剂,置于37 ℃温箱中避光温育15 min后,向每孔加入终止液,终止反应后15 min内上机检测,以空白孔调零,450 nm波长测定各反应孔的吸光度(A值),根据标准品浓度与其对应的A值绘制出标准曲线,根据标准曲线计算出各孔的浓度,再乘以样本稀释浓度后得出每个样品DAG、PKC的浓度。
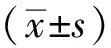
2 结果
2.1肥胖小鼠模型制备结果 高脂饲养8周后,HFD组小鼠体质量每只为(32.91±0.25) g,NFD组体质量每只为(26.80±0.21) g,HFD组小鼠平均体质量相较于NFD组小鼠平均体质量增加20%,造模成功率为100%。
2.2益生菌对小鼠体质量、糖代谢指标及IR的影响 在益生菌干预第4周末,对小鼠的体质量及糖代谢水平进行评估。在给予相同活性益生菌干预的条件下,HFD各组较NFD各组小鼠具有较高水平的体质量、FBG、FINS及HOMA-IR水平(P<0.05);经过益生菌干预,VSL#3+HFD组的体质量、FBG、FINS及HOMA-IR水平相较与HFD空白对照组及灭活VSL#3+HFD组明显降低(P<0.05);HFD空白对照组与灭活VSL#3+HFD组比较差异无统计学意义(P>0.05);VSL#3+NFD组体质量、糖代谢水平及HOMA-IR较NFD空白对照组及灭活VSL#3+NFD组无明显差异(P>0.05)。见表1。
2.3益生菌对小鼠脂代谢水平的影响 益生菌干预4周后,检测各组小鼠血TC、TG水平。在相同活性的益生菌干预条件下,HFD各组TC、TG水平较对应的NFD各组小鼠升高,差异有统计学意义(P<0.05);经过益生菌干预后,VSL#3+HFD组相较于HFD空白对照组小鼠以及灭活VSL#3+HFD组小鼠的TC、TG水平下降,差异有统计学意义(P<0.05);而灭活VSL#3+HFD组与HFD空白对照组比较水平稍低,但差异无统计学意义(P>0.05);VSL#3+NFD组TC、TG水平与NFD空白对照组及灭活VSL#3+NFD组比较,差异无统计学意义(P>0.05)。见表2。
2.4益生菌对小鼠肝脏组织中DAG、PKC表达的影响 HFD各组较NFD各组小鼠肝脏组织中均具有较高水平的DAG、PKC,差异有统计学意义(P<0.05);经过活性益生菌干预后,VSL#3+HFD组DAG、PKC水平较HFD空白对照组及灭活VSL#3+HFD组均有所下降,差异有统计学意义(P<0.05);HFD空白对照组与灭活VSL#3+HFD组之间比较,差异无统计学意义(P>0.05);而VSL#3+NFD组较灭活VSL#3+NFD组及NFD空白对照组比较较其肝脏组织中DAG表达水平稍降,但差异无统计学意义(P>0.05),PKC在NFD3组间的表达无明显差异(P>0.05)。见表3。
2.5代谢指标与肝脏组织内DAG及PKC的相关性分析 通过对各组小鼠体质量的评估以及其TC、TG、FBG、FINS、HOMA-IR及肝脏组织中DAG、PKC水平的检测,并以Pearson法行相关性分析,结果显示DAG与PKC表达呈正相关关系(P<0.05);DAG水平的升高与体质量、FBG及HOMA-IR呈正相关(P<0.05);PKC水平的升高与TG、FBG、HOMA-IR呈正相关(P<0.05)。见表4。
3 讨论
2型糖尿病发病机制主要为IR。IR是指靶细胞(肝脏、骨骼肌等)对循环中正常水平的胰岛素反应性降低,导致糖脂代谢紊乱,进而引起了机体胰岛素水平的升高[12]。目前已知引起IR有多个危险因素,包括吸烟、服用噻嗪类利尿药、使用糖皮质激素等,最关键的是肥胖[13]。肥胖主要是因为能量代谢失衡导致脂质在体内蓄积,而肝脏在机体能量代谢中有着重要的作用,同时肝脏也是重要的胰岛素靶器官。正常状态下,胰岛素可促进肝脏脂肪的合成,抑制糖异生,脂肪酸与甘油骨架缩合形成TG,而当营养摄入过剩时,脂肪酸向肝脏的输送远远超过了脂肪氧化和TG的合成和储存的速度,引起肝内脂质含量的净增加,进而引起肝脏组织内DAG含量增加,这是导致肝脏IR的主要原因[6-7]。DAG作为PKC的激活剂,既往在多项动物实验中已证实了DAG-PKC通路在肥胖介导的IR中发挥着作用[6]。在一项对肥胖患者的研究中显示,糖尿病(DM)较非DM患者细胞中DAG水平增加,同时伴随着PKC的增加,DAG水平与胰岛素敏感性呈负相关[14]。本实验中,小鼠经过高脂饲养后体质量、TC、TG、FBG、HOMA-IR水平上升,提示小鼠经过高脂喂养出现了肥胖与IR,这与既往研究一致[15]。进一步检测显示HFP各组小鼠肝脏组织中DAG、PKC水平增加,经Pearson相关性分析提示DAG-PKC表达增加与IR的发生有正相关关系。

表1 益生菌干预对高脂饮食小鼠WT、FBG、FINS及HOMA-IR的影响

表2 益生菌干预对高脂饮食小鼠血脂的影响

表3 益生菌干预对高脂饮食小鼠肝脏组织内DAG、PKC表达的影响

表4 代谢指标与肝脏组织内DAG及PKC的相关性分析
益生菌作为一种微生物制剂,在调节机体肠道菌群的平衡方面起着重要作用。研究显示肠道微生物群的变化可能在代谢疾病的发展中发挥重要作用[16]。既往多个研究中显示,IR可通过短期内高脂肪含量饮食干预引起,当血糖异常升高时,肠道菌群在构成上发生改变,因此高脂饮食不仅会改变肠道菌群组分,还可对肥胖患者/小鼠的能量代谢产生影响,而益生菌补充已被证明能改善肥胖或糖尿病等存在IR状态的患者/小鼠的糖脂代谢水平[10,17]。在使用不同种类益生菌(嗜酸性乳杆菌、短双歧杆菌)对高脂饮食饲养大鼠进行干预实验中,结果显示两种益生菌都可改善IR相关指标,同时对大鼠的生长发育无干扰。并提出两种益生菌在调脂、减重方面的作用相差不大,但在调节IR方面,前者则略差于后者[18]。益生菌补充可能是改善代谢健康和预防饮食诱导的IR和2型糖尿病的有效策略。本实验中,在经过活性VSL#3干预后肥胖小鼠糖脂代谢相关指标水平有所下降,肝脏组织中的DAG和PKC的表达降低,而灭活VSL#3+HFD组较HFD空白对照组无明显变化;活性/灭活VSL#3干预对于普通饮食组小鼠的糖脂代谢指标及肝脏组织中DAG、PKC变化则无明显差异,这表明活性益生菌和DAG-PKC途径在肥胖介导的IR发生中起重要作用,补充益生菌可缓解高脂饮食诱导的IR,这种机制可能与DAG-PKC信号通路降低有关。
肥胖诱导代谢综合征机制十分复杂,且多种机制之间可能存在着相互影响。本实验通过饮食诱导肥胖,证实了肥胖可通过介导DAG-PKC信号通路引起IR及脂代谢的紊乱,进一步通过研究益生菌干预对IR的影响,验证了活性益生菌可改善肥胖引起的IR及脂代谢紊乱,该机制可能与DAG-PKC信号通路有关。为益生菌对肥胖等代谢综合征的影响及其相关机制提供了新的理论基础和思路。但益生菌的种类繁多,且DAG、PKC存在多种分型,参与多种生理传导活动,在今后的研究中,应对不同亚型的DAG、PKC以及不同种类和剂量的益生菌进行深入研究。
