2021国际血脂专家组意见书:急性冠脉综合征后降脂治疗的最佳应用*
——解读
2021-07-29韩丽珠尹琪楠边原黄雪飞雷洋童荣生
韩丽珠,尹琪楠,边原,黄雪飞,雷洋,童荣生
(四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部·个体化药物治疗四川省重点实验室,成都 610072)
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)导致心肌缺血,是欧洲和世界范围内发病率和死亡率高的重要因素[1]。2017年,在欧洲心脏病学会(European Society of Cardiology,ESC)54个成员国中,估计有3490万人患有缺血性心脏病(ischaemic heart disease,IHD)[2],欧洲经皮心血管干预协会(European Association of Percutaneous Cardiovascular Interventions,EAPCI)报告称,每年每百万人接受经皮冠状动脉介入治疗(percutaneous cardiovascular interventions,PCI)手术的中位数为2478例[3]。多项证据表明,一个人终身暴露于高低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)决定了其患ASCVD的风险,故降脂治疗(lipid-lowering therapy,LLT)可以很大程度上降低该疾病负担[4]。然而他汀类药物治疗的依从性差是很常见的,这导致治疗目标的达标率差,并且与较差的预后相关。目前,除了他汀类药物和依折麦布,前蛋白转化酶枯草溶菌素/kexin 9型(proprotein convertase subtilisin/kexin type 9 inhibitors,PCSK9)抑制剂为降低ASCVD的风险提供了新的机会。
2019年ESC/欧洲动脉粥样硬化协会(European Atherosclerosis Society,EAS)血脂异常管理指南(下称ESC/EAS指南)[5]在许多地方更多的是学术性而不是临床性,在许多国家,无法达到极高风险的患者LDL-C<1.4 mmol·L-1、超高风险患者LDL-C<1.0 mmol·L-1的目标,不是由于缺乏认识或不遵从指南,而只是因为缺乏有效的LLT。并且,指南对于“超高风险”人群并未详细阐明,而急性冠状综合征(acute coronary syndromes,ACS)后患者被归类为“极高风险”组,但实际上ACS患者与该组其他人群并不相同,合并危险因素时其ASCVD事件风险更高。故2021年2月,国际血脂专家组(International Lipid Expert Panel,ILEP)发布了ACS后降脂治疗的最佳应用意见书[6],对ACS患者血脂管理现有指南进行了补充,对于LLT不达标的人群提出了切实的解决方案,定义了ACS后的“超高风险”人群,并制定了这类患者降脂治疗的具体措施。
1 ESC/EAS血脂异常管理指南存在的不足
ESC/EAS指南涵盖了LLT在ACS中的应用,涉及一系列一级和二级预防方案。该指南基于合理的降低LDL-C的原则:越早越好、越低越好、越长越好,强烈推荐心脏康复计划,并强调早期获得他汀类药物治疗的重要性和益处。ESC/EAS指南建议,如果没有达到治疗目标,应加强他汀类药物治疗,并加用依折麦布(Ⅱa类)。此外,如果使用最大耐受剂量的他汀和依折麦布4~6周后,LDL-C目标仍未达到,建议加用PCSK9抑制剂(Ⅰ类)。ESC/EAS指南还首次提出对ACS住院患者使用PCSK9抑制剂(Ⅱa类)。
然而,意见书认为这种在LDL-C未达标后再递增药物的方式并不可取,因为目前的治疗可以实现的降脂比例是可预测的,并且在许多LDL-C基线非常高的患者中,单药治疗几乎不可能使患者达到治疗目标。这种方式会导致达标延迟,让患者不必要地长时间暴露于高LDC-C。此外,指南将所有ASCVD患者视为“极高风险”,没有考虑到ASCVD患者群体中的差异性。ASCVD患者:既往ACS(心肌梗死或不稳定型心绞痛)、稳定型心绞痛、冠状动脉血运重建[PCI、冠状动脉旁路移植术(coronary artery bypass grafting,CABG)和其他动脉血运重建程序]、脑卒中和短暂性脑缺血发作以及外周动脉疾病。
2 欧洲ACS后LLT现状
出院后的强化降脂治疗常常是导致LDL-C的达标率很低的一个问题。最新数据表明,仅18%的患者LDL-C水平达到了1.4 mmol·L-1。在大多数情况下,只有他汀类药物、依折麦布和PCSK9抑制剂的联合治疗才能使大多数心血管风险极高和超高的患者达到目标。未能强化他汀治疗的原因有很多,其中许多都属于“治疗惰性”的范畴。一些国家报道全科医生无证据的定期减少他汀类药物的剂量或建议每年的“他汀假期”。他汀类药物可能有“杜鲁塞博效应”,即预期的不良反应(特别是肌肉疼痛)而不是药物的药理作用使患者感受到不良反应。鉴于此,一些初级保健医生(但也有心脏病专家和其他专家)开具小剂量的他汀类药物,认为这会减少不良反应,避免出现不良反应而停止治疗。在多药联用时,患者和医生经常优先使用其他治疗心血管疾病(cardiovascular disease,CVD)的药物,而不是他汀类药物。此外,在老年病患者中还观察到他汀类药物“停药”现象。在血管介入治疗之前、期间或之后是否曾用他汀类药物负荷剂量,根据ESC/EAS指南,建议行PCI和CABG之前使用大剂量的他汀类药物预处理,并且在急性心血管事件和血管介入治疗期间应避免停用他汀类药物。
3 意见书的降脂措施和建议
意见书对ACS最佳LLT制定了主要的治疗路径,并为少数特定的临床情况提供了特殊路径。这些路径是基于降低LDL-C的原则:“越早越好,越低越好,越久越好”,在ESC/EAS指南的基础上,对于那些复发风险最大的患者更加强调减少降脂的延迟。
ACS后最佳LLT的主要路径可分为3个部分(图1):诊断和分层、目标驱动LLT、支持和随访。
在诊断和分层阶段,确定特殊路径的患者群体。这些患者包括家族性高胆固醇血症(杂合子或纯合子)或ASCVD超高风险(图2),他汀类药物不耐受(图3),以及接受至少8周的高强度他汀类药物和依折麦布联合治疗但LDL-C>3.0 mmol·L-1的患者(图4)。
所有其他患者都可以通过三阶段目标驱动的方法进行LLT。对于曾使用他汀类药物治疗的LDL<2.5 mmol·L-1的患者,必须给予最大耐受量他汀类药物治疗。对于未使用他汀类药物的LDL-C<3.0 mmol·L-1的患者,应给予大剂量阿托伐他汀或瑞舒伐他汀治疗。目标都是将LDL-C降低50%(目标<1.4 mmol·L-1)。对于使用他汀类药物治疗的LDL-C为2.5~7.5 mmol·L-1的患者或未使用他汀类药物的LDL-C为3~7.5 mmol·L-1的患者,应给予最大耐受剂量的他汀类药物联合依折麦布治疗,以使LDL-C降低50%~80%(目标<1.4 mmol·L-1)。对于入院时LDL-C>7.5 mmol·L-1的患者,LDL-C需要降低80%以上,以达到<1.4 mmol·L-1的目标,可以采用三联疗法(他汀类药物+依折麦布+PSCK9抑制剂)。所有患者应在4~6周后随访,必要时(或尚未加强)应加强治疗以达到目标。LDL-C达到目标(<1.4 mmol·L-1)可以减少随访。以上治疗仍无效的情况下,患者应被转诊到血脂管理专家。
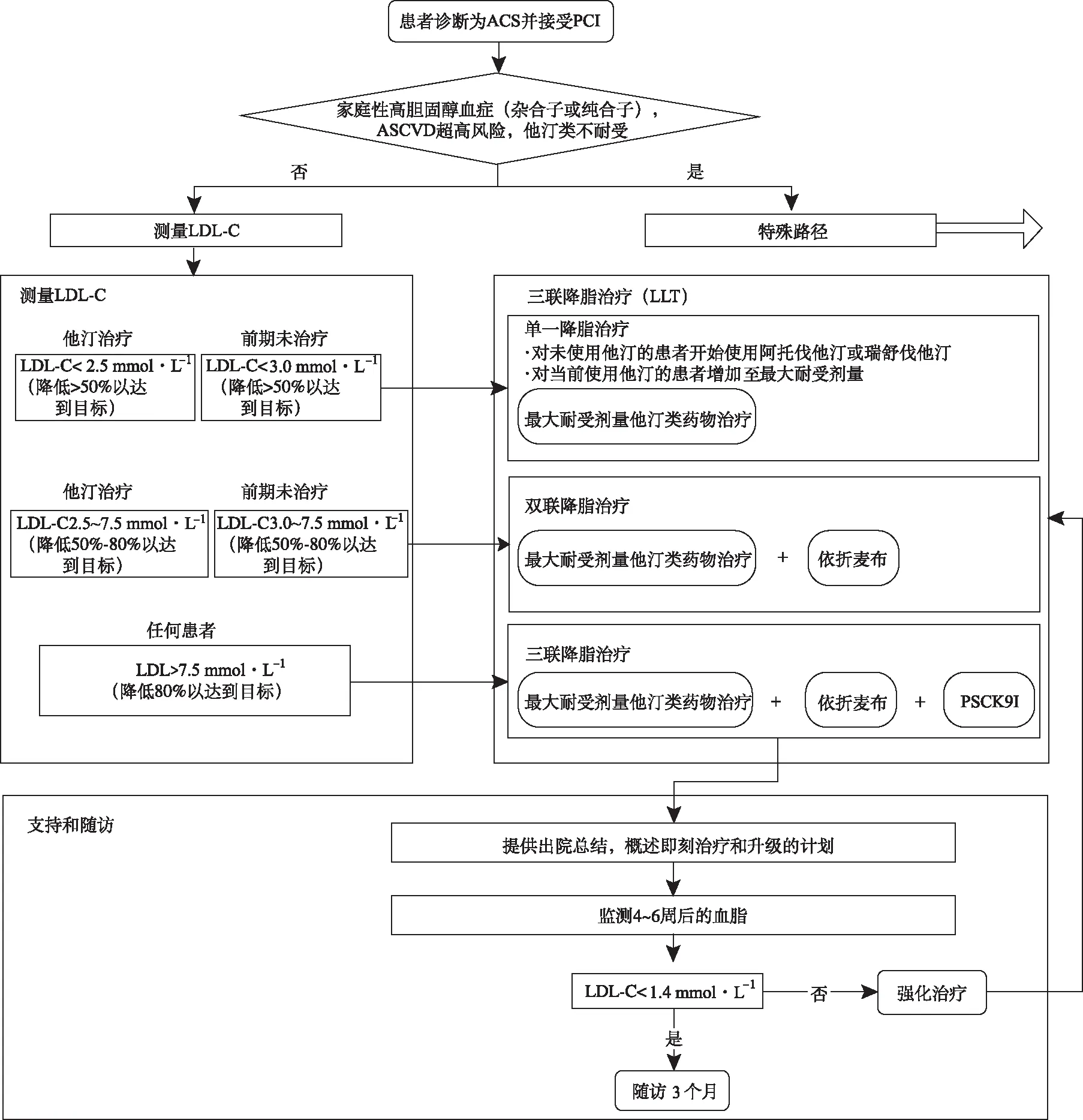
图1 急性冠脉综合征后最佳降脂治疗的总体路径
3.1特殊路径 但确定诊断和分层阶段需要护理的患者群体,按照以下方案进行。
3.1.1超高心血管风险 ESC/EAS指南将所有ASCVD患者列入“极高风险”类别,关于超高风险患者的定义是不完整的。根据ILEP最近的声明[7],以及波兰实验室诊断学会(Polish Society of Laboratory Diagnostics,PSLD)和波兰脂质协会(Polish Lipid Association,POLA)的联合建议[8],提出了以下“超高风险”的定义(基于PCSK9抑制剂试验的大量数据)。
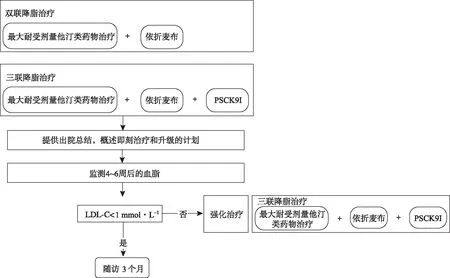
图2 特殊路径:超高心血管风险人群
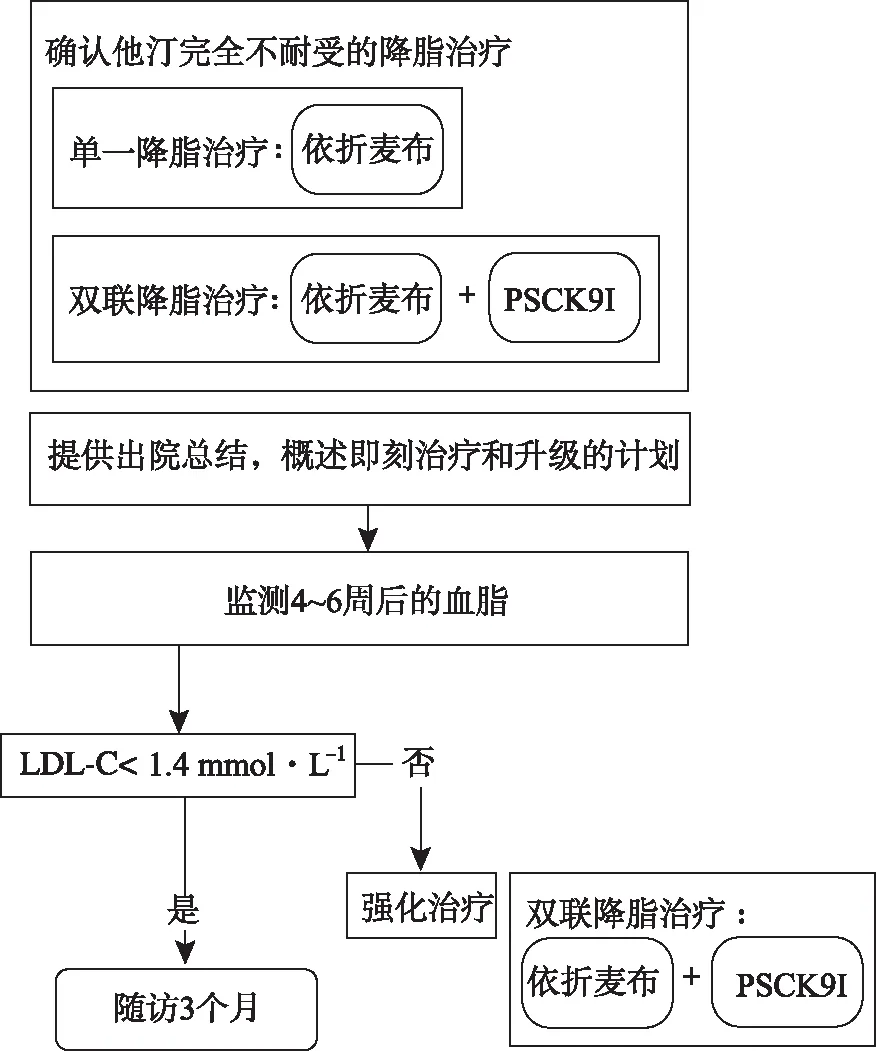
图3 特殊路径:客观确认完全他汀类药物不耐受的患者
符合以下任何一项标准的患者(尽管强化/最大耐受剂量的他汀类药物和依折麦布治疗后LDL-C仍未达标)应被认为是“超高风险”:①心肌梗死复发+近2年的既往血管事件;②ACS+多支病变;③ACS+多血管疾病;④ACS+家族性高胆固醇血症;⑤ACS+糖尿病+至少一个额外的风险因素[包括超敏C反应蛋白≥3 mg·L-1和(或)慢性肾病eGFR<60 mL·min-1·1.73(m2)-1和(或)脂蛋白(a)>50 mg·dL-1]。
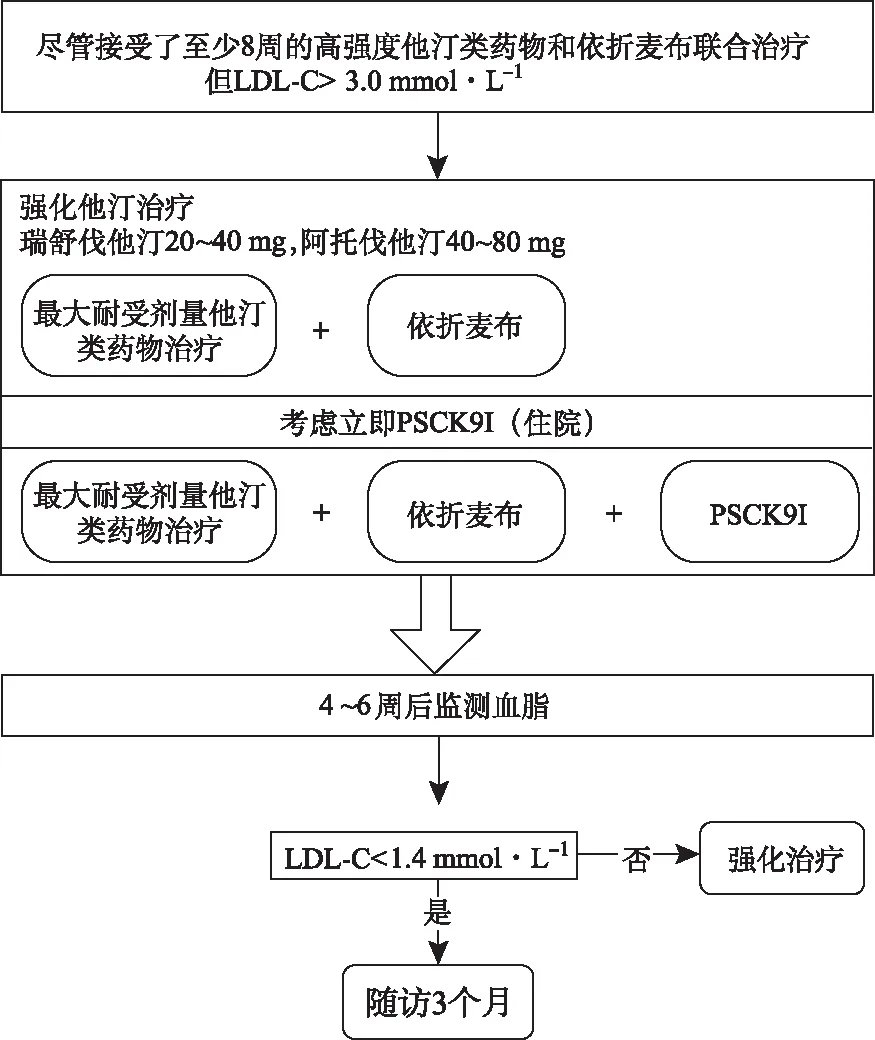
图4 特殊路径:高强度他汀类药物联合依折麦布治疗不达标的患者
超高风险人群要求较低的LDL-C目标(<1 mmol·L-1)。为了最大限度地减少其降脂达标延迟,并考虑到实现较低目标的潜在困难,最初即应双联治疗,使用最大耐受剂量的他汀类药物和依折麦布,随访时若未达标可使用PCSK9抑制剂(图2)。
我国《超高危动脉粥样硬化性心血管疾病患者血脂管理中国专家共识》[9]也对“超高风险”进行定义:中国超高危ASCVD患者的风险分层采用严重事件+高风险因素模式,定义为:发生过≥2次严重的ASCVD事件或发生过1次严重的ASCVD事件合并≥2个高风险因素的患者为超高危ASCVD患者(表1)。其降脂目标建议见表2。

表1 严重ASCVD事件和高风险因素的定义
另外在我国《急性冠状动脉综合征患者血脂管理临床路径专家共识》中[10],虽未对超高风险人群进行定义,但对“ACS合并高风险因素患者”制定了血脂管理路径,其降脂目标也建议LDL-C<1.4 mmol·L-1,且较基线水平降幅≥50%。并且指出,当LDL-C水平≤ 0.4 mmol·L-1,应根据各种药物对 LDL-C 水平的降低幅度来考虑停药顺序。即高风险因素包括:复发的动脉粥样硬化性心血管事件;冠状动脉多支血管病变;糖尿病;心、脑或外周多血管床动脉粥样硬化性心血管病;LDL-C≥4.9 mmol·L-1。

表2 超高危ASCVD患者血脂的干预靶标
3.1.2他汀类药物不耐受 客观确认他汀类药物不耐受的患者(通常仅3%~5%他汀类药物治疗的患者),应立即使用非他汀类药物进行LLT(图3)。在部分他汀不耐受的情况下,主要路径(图1)允许最大耐受剂量的他汀类药物和额外的LLTs进行联合治疗,这时应考虑早期启动额外的LLTs与小剂量的他汀联合,而不是缓慢地上调他汀类药物剂量来延迟目标的实现。这种方法会降低LDL-C就诊变异性,显著增加CVD事件的复发。
3.1.3高强度他汀类药物联合依折麦布治疗不达标 根据ESC/EAS指南的Ⅱa类建议,ACS患者入院前服用最大耐受剂量的他汀类药物和依折麦布,但仍未达到LDL-C目标水平,应考虑在住院期间开始PCSK9抑制剂治疗(图4)。
3.2支持和随访 应特别注意二级和初级保健之间的沟通,最大限度地坚持治疗路径,进行LLT的随访和升级。所有患者都应使用标准化的出院告知书,特别重要的是包括个人的LDL-C目标,以及关于如果治疗未达标应该如何及何时升级治疗的具体说明。此外,告知书应说明定期监测的过程(包括远程监测、电子探访、电子咨询、电子处方、电子转诊),见表3。
ILEP意见书提出降脂治疗可以降低ASCVD及随之的ACS的疾病负担,并且根据ESC/EAS指南基于合理的降低LDL-C“越早越好,越低越好,越久越好”的原则,制定了ACS患者最佳降脂治疗的治疗路径。意见书定义了ACS后的“超高风险”人群,并为该人群制定了特殊治疗路径,结合我国最新的两项专家共识,临床可根据具体情况予以参考;对于“他汀类药物不耐受”以及“高强度他汀类药物联合依折麦布治疗不达标”的患者,也专门制定了特殊路径以供临床参考。意见书强调应尽可能地坚持治疗路径,进行降脂治疗的随访和升级,对于改善患者依从性,尽快达到并维持降脂目标,最大限度降低心血管风险至关重要。
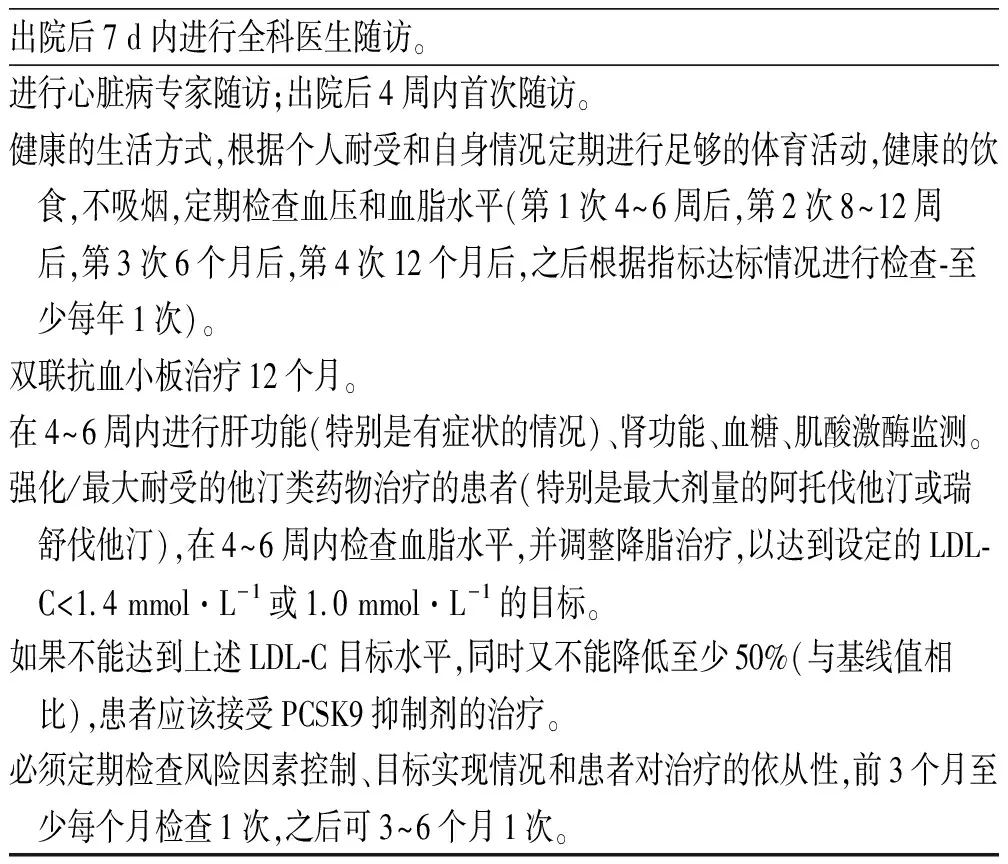
表3 ACS患者出院告知书建议
